镉诱导小鼠十二指肠上皮细胞损伤及机制
2019-08-12吴晓利张志明何冬旭
吴晓利,张志明,何冬旭
(江南大学1.生物工程学院,2.国家功能食品工程技术研究中心,江苏无锡214122)
镉(cadmium,Cd)是中国土壤的主要重金属污染物之一。Cd 在人体内的半衰期长达30~40 年,是最易在人体内积聚的有毒重金属之一,具有致畸性和致癌性[1-4],国际癌症研究机构已确认Cd 及其化合物为Ⅰ类致癌物。
环境污染和职业接触均可造成Cd 中毒,Cd 及含Cd 化合物主要从呼吸系统和消化系统进入体内[5-6]。其中,Cd污染食品的摄入是人体Cd暴露的主要途径。食物中的Cd 在摄入后,首先经胃肠道吸收进入血液循环,之后在肝、肾、骨骼及其他组织中蓄积[7-8],该过程伴随着消化道、肝、肾等组织的损伤,临床典型症状主要表现为肠胃炎、肝功能异常、肾炎和骨质疏松等。由于肝、肾损伤是Cd 中毒中最为典型的症状,目前国内外对其损伤的评价方法和机制研究有较多报道[9-10]。相比而言,针对胃肠道Cd损伤的研究较少,损伤机制尚不明确。因此,本研究利用小鼠Cd中毒模型探讨Cd对十二指肠的损伤作用及其机制,进一步阐明Cd的毒性作用,并为Cd中毒患者的肠道损伤护理提供一定的实验依据。
1 材料与方法
1.1 药品、试剂和主要仪器
CdCl2(CdCl2·5/2 H2O)购自上海麦克林生化科技有限公司;胎牛血清购自浙江天杭生物科技股份有限公司;青霉素-链霉素溶液(100×)、细胞周期与细胞凋亡检测试剂盒、细胞核荧光染料DAPI 均购自上海碧云天生物技术有限公司;胰岛素购自江苏万邦生化医药股份有限公司;表皮细胞生长因子购自美国派普泰克公司;胶原酶XI购自西格玛奥德里奇(上海)贸易有限公司;DMEM 培养基和Cd/铅绿色荧光探针Leadmium Green AM购自赛默飞世尔(苏州)仪器有限公司;兔抗小鼠活化的胱天蛋白酶3多克隆抗体购自沈阳万类生物科技有限公司;小鼠抗小鼠E-钙黏蛋白单克隆抗体购自艾博抗(上海)贸易有限公司;小鼠抗小鼠β肌动蛋白单克隆抗体、辣根过氧化物酶标记的山羊抗兔IgG(H+L)和山羊抗小鼠IgG(H+L)抗体、Alexa Fluor®488 驴抗小鼠IgG(H+L)抗体购自美国英杰生命技术有限公司;CellTiter-Blue®细胞活力试剂盒购自北京普洛麦格生物技术有限公司。
Synergy H4 全功能微孔板检测仪购自美国伯腾仪器有限公司;TCS SP8激光共聚焦显微镜购自德国莱卡公司;C6流式细胞仪购自美国碧迪公司。
1.2 动物和分组
6 周龄雄性C57BL/6 小鼠,体质量20~25 g,购自南京大学模式动物研究所,动物合格证号:SYXK(苏)2016-0012。小鼠饲养在江南大学医学院动物中心,光照12 h,环境湿度50%,温度22~25℃,自由进食饮水。
小鼠随机分成染毒组和正常对照组,参照文献[11-12]的Cd中毒剂量和方法,连续30 d每天1次ig给予小鼠CdCl210 mg·kg-1或生理盐水,建立慢性Cd中毒小鼠模型;参照文献[11,13-14]的Cd中毒剂量和方法,单次ig给予CdCl280 mg·kg-1或生理盐水,建立急性Cd中毒小鼠模型,并持续观察小鼠生存状况和生存率。
1.3 十二指肠上皮细胞的制备与培养
参照文献[15-17],小鼠脱颈处死,取十二指肠2~3 cm,转移至PBS中,移液管多次冲洗肠内容物。剪切组织至约2 mm大小,加入胶原酶Ⅺ0.3 g·L-1,37℃水浴震荡消化3 次,每次5 min,静置,弃上清液;再加入胶原酶Ⅺ0.3 g·L-1,37 ℃水浴震荡消化3 次,每次10 min,静置,上清液均收集至新的离心管中,100×g离心3 min,将细胞重悬于完全培养基(含10%胎牛血清、1%青霉素-链霉素、表皮生长因子1 g·L-1和胰岛素0.25 kU·L-1的DMEM)中,于37℃,5%CO2及饱和湿度的培养箱中培养,24 h后弃未贴壁的细胞,PBS 清洗2 次,加入完全培养基继续培养3~4 d 后用于实验。
1.4 十二指肠上皮细胞的鉴定
将1.3分离培养的小鼠十二指肠上皮细胞以每皿4×104细胞接种于共聚焦小皿中,培养24 h 后弃培养液,4%多聚甲醛室温固定30 min,PBS清洗小皿3次,封闭1 h,加小鼠抗小鼠E-钙黏蛋白一抗(1∶250)4℃孵育过夜。之后,PBS 清洗并加入Alexa Fluor®488 驴抗小鼠荧光二抗(1∶200),室温孵育2 h。再加入细胞核荧光染料DAPI(1∶1000)孵育10 min。最后,避光条件下进行激光共聚焦显微镜拍照。Alexa Fluor®488 驴抗小鼠荧光二抗的激发光波长和发射光波长分别为488 和519 nm;DAPI的激发光波长和发射光波长分别为364 和454 nm。
1.5 激光共聚焦检测Cd暴露小鼠十二指肠上皮细胞内Cd离子含量
小鼠急、慢性Cd 中毒后24 h,将小鼠处死,按1.3 和1.4 制备和鉴定十二指肠上皮细胞。将细胞以每皿4×104接种于共聚焦小皿中,于培养箱内培养24 h,弃去培养液,0.85%氯化钠溶液清洗3 次,加入5 mg·L-1Leadmium Green AM[18],37℃避光孵育30 min,0.85%氯化钠溶液清洗3次,加入0.85%氯化钠溶液500 μL,使用激光共聚焦显微镜于激发光波长490 nm 和发射光波长520 nm 检测荧光强度,表示细胞内Cd离子含量。
1.6 CellTiter-Blue®检测体外培养的小鼠十二指肠上皮细胞的细胞活力
取正常小鼠,按1.3和1.4制备和鉴定十二指肠上皮细胞。将细胞以每孔1×104接种于96孔板,在细胞培养箱内孵育培养24 h。细胞分别与终浓度为0(细胞对照组),2.5,5,10,15,20,30,40,50,60,80 和100 μmol·L-1的CdCl2共孵育24 h 后,每孔加入10 μL CellTiter-Blue®检测试剂,继续孵育4 h,于560 和590 nm 双波长下测吸光度(absorbance,A)值[19]。各组设5 个复孔,实验重复3 次。细胞存活率(%)=(Cd 处理组A 值/对照组A 值)×100%,用Logit 法计算CdCl2抑制细胞存活的半数抑制浓度(IC50)。
1.7 流式细胞术检测体外培养小鼠十二指肠上皮细胞的细胞周期
取正常小鼠,按1.3和1.4制备和鉴定十二指肠上皮细胞。将细胞以每孔5×105接种于6 孔板,在细胞培养箱内孵育培养24 h。根据1.6 所得的IC50值和预实验结果,将细胞随机分为细胞对照组和CdCl215 μmol·L-1处理组,分别给药孵育24 h 后,胰酶消化细胞。按细胞周期与细胞凋亡检测试剂盒操作说明向细胞悬液中加入碘化丙啶染色液,37℃避光温育30 min,于流式细胞仪上检测细胞周期[20]。每组设2 个复孔,实验重复3 次。
1.8 Western 印迹法检测体外培养的小鼠十二指肠上皮细胞中活化的胱天蛋白酶3蛋白表达水平
取正常小鼠,按1.3和1.4制备和鉴定十二指肠上皮细胞。将细胞以每孔4×105接种于6 孔板,在细胞培养箱内孵育培养24 h。根据1.6 所得IC50和预实验结果,细胞随机分为细胞对照组和CdCl230 μmol·L-1处理组,分别给药孵育3,6,9 和12 h后,收集细胞,加入200 μL 细胞裂解液,4℃裂解细胞2 h,提取细胞总蛋白。经聚丙烯酰胺凝胶电泳后,将蛋白转至PVDF膜上,封闭2 h,加活化的胱天蛋白酶3(1∶500)和β 肌动蛋白(1∶3000)一抗4℃孵育过夜,洗膜后加入二抗(1∶5000),室温孵育2 h后ECL 发光法显影,用ImageJ 1.42 软件分析各蛋白条带积分吸光度(integrated absorbance,IA)值,以目标蛋白与内参蛋白IA 比值反映目标蛋白的相对表达量[21]。实验重复3 次。
1.9 统计学分析
2 结果
2.1 急性和慢性Cd中毒对小鼠生存的影响
慢性Cd中毒小鼠染毒后7 d内无死亡,且小鼠活动正常(数据略)。急性Cd中毒小鼠在染毒第1天即出现萎靡不振,进食减少的状况;第2天部分动物出现四肢抽搐、行动障碍和死亡;随着时间延长,小鼠生存率逐渐下降,第5天时小鼠生存率降至40%,第6和第7天生存率维持不变(图1)。

Fig.1 Survival curve of mice with acute cadmium(Cd)poisoning. Mice were ig given a single dose of CdCl2 80 mg·kg-1 or saline(normal control,NC),and the survival status of mice was recorded for 7 d.
2.2 十二指肠上皮细胞的鉴定
如图2 所示,本实验分离制备的小鼠十二指肠上皮细胞多呈扁平短梭状,贴壁生长。经E-钙黏蛋白免疫荧光染色特异性标记后呈现绿色荧光,占细胞总数>95%,可用于后续实验。
2.3 急性或慢性Cd中毒小鼠十二指肠上皮细胞中Cd离子含量
结果如图3所示,急性或慢性Cd中毒小鼠十二指肠上皮细胞的荧光强度相比于各自正常对照组均显著增加(P<0.01),表明Cd 离子在急、慢性Cd中毒小鼠十二指肠上皮细胞中显著富集。

Fig.2 ldentification of primary duodenal epithelial cells by E-cadherin immunofluorescence staining. The duodenal epithelial cells were separated from mouse duodenum by collagenase Ⅺand cultured in complete medium for 3-4 d. Light microscopy and immunofluorescence image of duodenal epithelial cells that were stained with DAPI(blue)and E-cadherin(green).
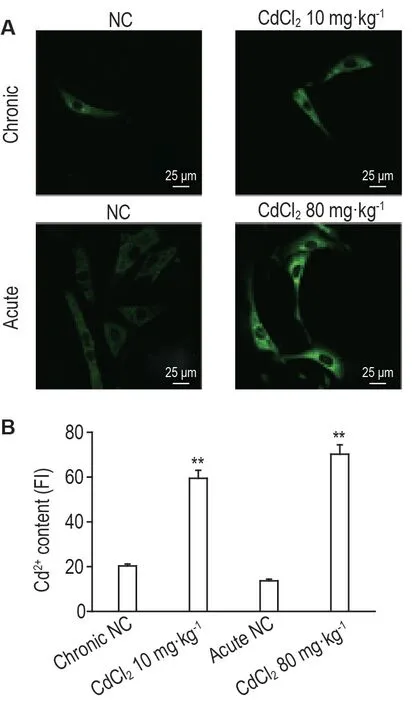
Fig.3 Cd2+content in duodenal epithelial cells of mice with acute and chronic cadmium poisoning by confocal fluorescence detection. Chronic cadmium poisoning model:mice were ig administered with CdCl2 10 mg·kg-1 once per day for 30 d;acute cadmium poisoning model:mice were ig administered with single dose of CdCl2 80 mg·kg-1. After 24 h of the last administration,the duodenal epithelial cells were separated and cultured as described in Fig.2. Cells were incubated with Leadmium Green AM dye(5 mg·L-1)for 30 min,and fluorescence intensity(FI)was detected(A). B was the quantitative result of A.x±s,n=5.**P<0.01,compared with corresponding NC group.
2.4 Cd 对体外培养的小鼠十二指肠上皮细胞存活的影响
如图4 所示,CdCl2作用24 h 对十二指肠上皮细胞活力具有抑制作用,且抑制作用随浓度的增加逐渐增强。其IC50值为(24.55±0.84)μmol·L-1。

Fig.4 Effect of CdCl2 on viability of mouse duodenal epithelial cells in vitro by CellTiter-Blue®assay. See Fig.2 for the duodenal epithelial cell treatment. Cells were treated with CdCl2 0(cell control),2.5,5,10,15,20,30,40,50,60,80 and 100 μmol·L-1 for 24 h. Cell viability(%)=〔(A560/590 nm of CdCl2-treated group/A560/590 nm of control group〕×100%.±s,n=3.
2.5 Cd 对体外培养的小鼠十二指肠上皮细胞细胞周期的影响
实验结果(图5)表明,相对于细胞对照组,CdCl215 μmol·L-1处理组细胞G0/G1期比例显著增加(P<0.05),S 期和G2/M 期比例显著降低(P<0.05,P<0.01)。提示CdCl2可使十二指肠上皮细胞细胞周期阻滞于G0/G1期,抑制DNA 合成,从而抑制细胞增殖。
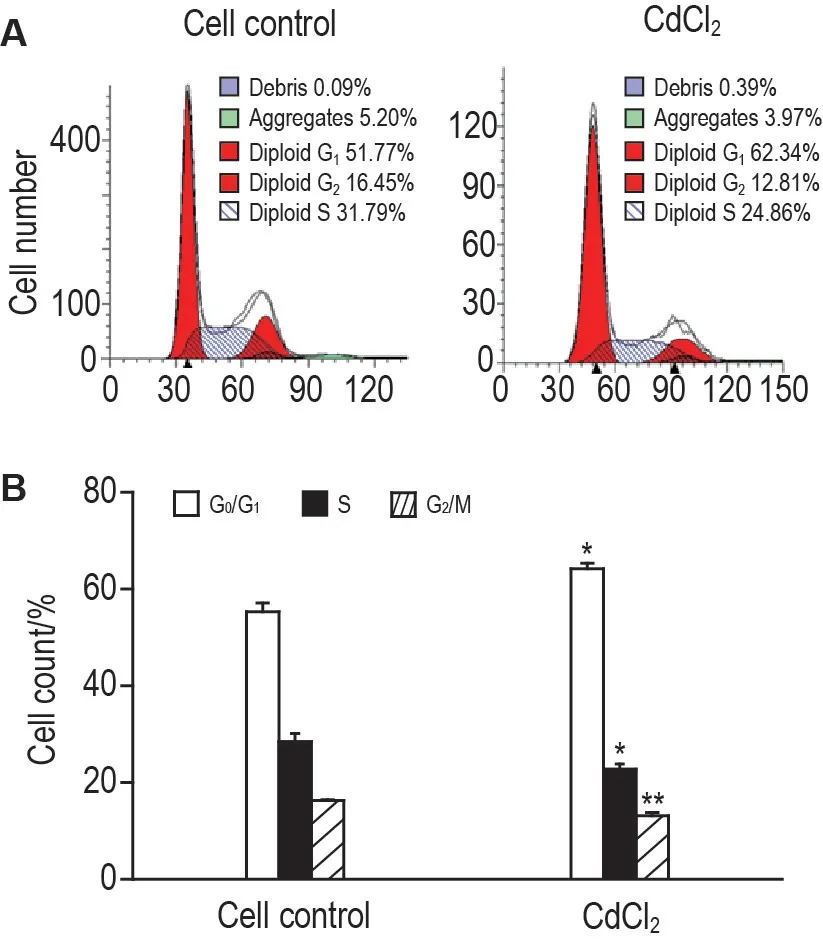
Fig.5 Effect of CdCl2 on cell cycle of mouse duodenal epithelial cells detected by flow cytometry. The duodenal epithelial cells were treated with CdCl2 15 μmol·L-1 for 24 h.B was the quantitative result of A.,n=3. *P<0.05,**P<0.01,compared with cell control group.
2.6 Cd 对体外培养的小鼠十二指肠上皮细胞中活化的胱天蛋白酶3蛋白表达水平的影响
检测结果(图6)显示,与细胞对照组相比,随着CdCl2处理时间的增加,十二指肠上皮细胞活化的胱天蛋白酶3 表达水平逐渐增加。CdCl2处理6,9和12 h的上皮细胞相对于对照组(0 h)活化的胱天蛋白酶3显著增加(P<0.05,P<0.01),提示CdCl2可使十二指肠上皮细胞中活化的胱天蛋白酶3表达量增加,从而引发细胞凋亡。
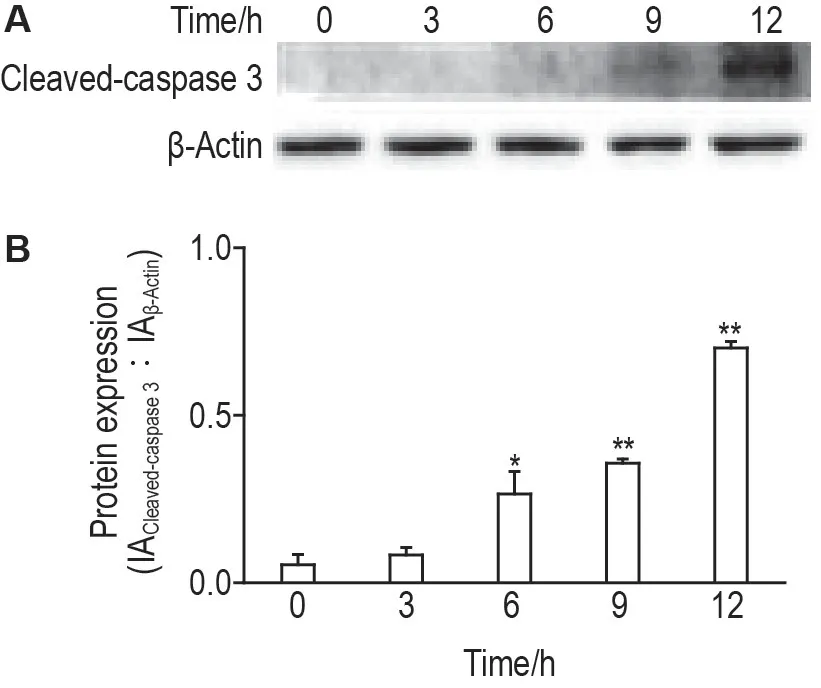
Fig.6 Effect of CdCl2 on expressions of cleaved-caspase 3 protein in mouse duodenal epithelial cells by Western blotting. Cells were treated with CdCl2 30 μmol·L-1 for 3,6,9 and 12 h.B was the semi-quantitative result of A.n=3.*P<0.05,**P<0.01,compared with cell control(0 h)group.
3 讨论
研究发现,一次性ig 给予高剂量的Cd 在短期内会对小鼠造成严重的损伤,并且急、慢性Cd中毒小鼠十二指肠上皮细胞Cd 离子含量均显著增加;在离体实验中,Cd以浓度依赖方式降低十二指肠上皮细胞活力,提示经消化道进入体内的Cd 对十二指肠上皮细胞造成损伤,且这种损伤作用可能涉及到细胞周期阻滞和胱天蛋白酶3介导的细胞凋亡。
需要指出的是,关于急性Cd中毒的ig剂量,国内外报道很少,曾有文献报道,小鼠Cd经口急性毒性LD50为150 mg·kg-1[12],本实验室前期采用6 周龄C57BL/6小鼠预实验发现,CdCl2150 mg·kg-1的剂量对小鼠伤害过大,肠胃道损伤严重,不利于后期原代细胞分离培养等实验的进行。根据预实验结果,并参照Zhao 等[11]和Yang 等[13]的ig 剂量,本实验采用单次ig给予CdCl280 mg·kg-1的剂量建立急性Cd 中毒模型,染毒期间小鼠随染毒天数增加逐渐显示出萎靡不振,饮食减退,并死亡的现象,稳定地体现了小鼠每个中毒阶段的反应。
Cd 经口进入体内,主要消化吸收的部位在小肠,而十二指肠是小肠吸收的重要的肠段。研究发现,急、慢性Cd中毒小鼠的十二指肠上皮细胞中都富集了大量的Cd离子,这些Cd离子的富集可能会直接打破细胞本身的离子平衡进而引发细胞损伤[22]。胱天蛋白酶家族在细胞凋亡的调控网络中起到关键性作用[23],其中胱天蛋白酶3 是凋亡执行蛋白,在细胞凋亡早期的启动与执行过程中起重要作用,是细胞凋亡发生的关键酶[24]。胱天蛋白酶3的激活常被作为细胞凋亡的一个重要指标[25]。本研究结果表明,随着CdCl2暴露时间的增加,十二指肠上皮细胞中活化的胱天蛋白酶3 表达量逐渐增加,表明细胞启动了凋亡程序。细胞周期同细胞凋亡的发生密切相关,对细胞周期的调控能阻止或促进细胞凋亡的发生[26]。本研究表明,Cd可使十二指肠上皮细胞G0/G1期细胞比例增多,而S 期和G2/M期细胞比例相对减少,可能是因为Cd 对十二指肠上皮细胞DNA损伤较重,超出了机体细胞正常存在的损伤修复调控体系的修复能力,进而促进细胞凋亡的发生。
综上所述,本研究利用在体动物和离体细胞研究发现,Cd诱导小鼠十二指肠上皮细胞损伤的内在机制可能涉及到胱天蛋白酶3 介导的细胞凋亡,以及细胞周期阻滞,为Cd 中毒患者的治疗和后期护理提供了一定的理论依据。
