蛹虫草类胡萝卜素双加氧裂解酶基因的克隆及表达分析
2019-08-07林俊芳叶志伟郭丽琼康林芝
李 栋 林俊芳,2, 刘 聪,2 叶志伟,2 郭丽琼,2,* 云 帆 康林芝
(1 华南农业大学食品学院 食品生物技术研究所 广州510642 2 广东省微生态制剂工程技术研究中心 广州510642 3 广州市澳键丰泽生物科技股份有限公司 广州510760)
蛹虫草(Cordyceps militaris)隶属于子囊菌的虫草属(Cordyceps),又名北冬虫夏草[1],是在中国和一些亚洲国家广泛分部的一种传统食药用菌,因具有多种生物学活性和生理功能[2],同时易于人工培养获得子实体[3],而受到广泛关注,对其主要活性物质虫草素、真菌多糖已做大量研究[4]。早在2005年付鸣佳等[5]就证实蓝光可以诱导蛹虫草菌丝体累积类胡萝卜素。2010年有报道[6]在蛹虫草子实体中分离到叶黄素。2013年Dong 等[7]进一步研究蛹虫草的类胡萝卜素,分离纯化出4 种水溶性极好的类胡萝卜素,分别命名为北虫草黄素(Cordyxanthin)Ⅰ、Ⅱ、Ⅲ、Ⅳ,这4 种类型的类胡萝卜素占到总含量的86.7%。作为迄今为止罕见的水溶性类胡萝卜素,其理论上具有更强的生理活性和应用价值,然而蛹虫草类胡萝卜素的生物合成途径至今尚未阐明。
天然类胡萝卜素是一类分部最广泛的色素,所有光合生物以及许多非光和细菌、真菌都能合成[7]。在过去的20年间,几乎所有与类胡萝卜素代谢途径相关的酶都被鉴定出来[8]。通过对主要合成途径的考察发现:类胡萝卜素是含有C40骨架并有多至15 个共轭双键的异戊二烯化合物[9]。以类胡萝卜素为前体进行裂解而获得更短链的脱辅基类胡萝卜素(apocarotenoid),是普遍的合成机制[10]。1997年第1 个涉及类胡萝卜素裂解氧化酶的成员VP14 酶被分离鉴定出来,随后,一个能裂解不同类胡萝卜素产生脱辅基类胡萝卜素的酶家族,称为类胡萝卜素裂解氧化酶(Carotenoid Cleavage Oxygenase,CCOs)被鉴定[11]。该家族的酶从多种植物中分离[12-13],而蛹虫草中的CCD 酶基因还未见报道[14]。本研究从蛹虫草中克隆该基因,分析其序列和表达,为全面解析蛹虫草类胡萝卜素的生物合成途径中的关键酶基因奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种、质粒 蛹虫草菌种(Cordyceps militaris CM04)菌株、大肠杆菌DH5α,华南农业大学食品生物技术研究所;克隆载体pGEM-T,美国Promega 公司。
1.1.2 试 剂 和 试 剂 盒 Ex Taq 酶、dNTPs、T4 DNA 连接酶,大连宝生物公司;Fungal RNA Kit,美国OMEGA 公司;反转录试剂盒FastQuant RT Kit (with gDNase)、荧光定量预混液SuperReal PreMix Plus(SYBR Green)、胶回收和质粒小提试剂盒,天根生化科技有限公司;PCR 引物合成和测序由广州吉美生物科技有限公司完成,其它化学试剂均为国产或进口分析纯级。
1.2 试验方法
1.2.1 总DNA 提取 取0.5 g 菌丝用液氮法粉碎,将粉末转入800 μL(68 ℃)的FDEB Buffer 混匀温育30 min,后加300 μL 3 mol/L KAc(pH 5.2),轻轻混匀,并于20 min,4 ℃,12 000 r/min 离心6 min,上清液转移至新管;加入等体积酚-氯仿-异戊醇(25∶24∶1)混匀,4 ℃,12 000 r/min 离心6 min,上清液转移至新管加0.6 倍体积异丙醇混匀,-20 ℃静置30 min,12 000 r/min 离心6 min 弃去上清,沉淀用70%乙醇洗2 次,真空干燥,沉淀用ddH2O 溶解-20 ℃保藏待用。
1.2.2 全长基因克隆及测序 从NCBI 上下载已公布的蛹虫草基因组序列,采用GeneScan 软件从头基因预测,建立本地BLAST 数据库,下载典型的CCD 酶水稻恶苗病菌(Fusarium fujikuroi)圆酵母素加氧酶(Torulene oxygenase)基因cao-2 进行本地比对[15],找到蛹虫草中高度同源的基因,利用Primer5.0 软 件 设 计5'CarT-F (5'-ATGGCACT CAACGGCCCGGGTA-3')和3'CarT-R(5'-TCACAGCTGGCTCTGGTAATGTCCATGAA-3')扩增引物。用此引物对目的基因进行扩增,产物用1%琼脂糖凝胶电泳检测并回收,纯化后链接到pGEM-T 载体,转化大肠杆菌DH5α 感受态细胞,用蓝白斑筛选法选取阳性克隆,鉴定正确后送广州美吉生物技术公司测序。
1.2.3 序列分析 利用NCBI BLAST 进行相似性比对,ORF finder 确定开放阅读框架。运用DNAStar 软件分析氨基酸序列、分子质量和等电点,核酸及蛋白序列同源比对在NCBI BLAST(http://blast.ncbi.nlm.nih.gov)上进行,使用DNAStar 软件包进行基因格式编辑和翻译,使用Prot-Param(http://web.expasy.org/protparam/)进行一级结 构 分 析 、ProtScale (http://web.expasy.org/protscale/) 进行亲疏水性分析、SignalP4.1(http://www.cbs.dtu.dk/services/SignalP/) 分析其信号肽和亚 细 胞 定 位、ProteinPredict(https://www.predictprotein.org/) 进 行 二 级 结 构 预 测、COILS(http://www.ch.embnet.org/software/COILS_form.html)分 析卷曲螺旋区段、Pfam(http://pfam.xfam.org/)进行蛋白质家族和结构域分析、InterPro(http://www.ebi.ac.uk/interpro/)检索其特征结构域,ExPaSy(http://www.expasy.org/proteomics)进行三级结构建模,应用MAGA 6.06 进行本地建树,多重序列比对采用ClustalX 完成。
1.2.4 总RNA 提取 取新鲜菌丝50 mg,用液氮法粉碎至于1.5 mL 离心管中,按照天根公司所提供的真菌RNA 小量提取试剂盒R6840 的步骤提取总RNA。
1.2.5 单链cDNA 的合成 cDNA 第一链的获得利用天根公司Fast Quant RT Kit (with gDNase)试剂盒,5×gDNA Buffer 2 μL 和Total RNA 2 μL混合,用RNase-Free ddH2O 补足至10 μL,42 ℃,孵育3 min,去除基因组DNA,反转录体系包含10×Fast RT Buffer 2 μL,RT Enzyme 1 μL,FQRT Primer Mix 2 μL,添加ddH2O 到10 μL 42 ℃孵育15 min,95 ℃孵育3 min 后冰浴,所得cDNA待用。
1.2.6 定量表达分析 以反转录得到的cDNA 为模板,以car-TC 全长序列设计特异性正反向引物:Car -Trna -F (5' -GACCGCAAACCTACAGAACAG-3') 和Car-Trna-R (5'- TACCCCAGAGGCTCAAGAGT-3')。以fef1 基因作为内参,按照SYBR Green 试剂盒要求在Bio-Rad CFX96荧光定量PCR 仪中进行反应。RT-qPCR 反应程序为:95 ℃15 min;95 ℃10 s;60 ℃32 s;72 ℃45个循环。
2 结果与分析
2.1 car-TC 基因的克隆
提取蛹虫草CM04 的总DNA,以CarT-F 和CarT-R 为正反向引物扩增靶序列,通过凝胶电泳,得到的PCR 产物为一条约1 700 bp 的片段,结果如图1,其片段的大小和预测结果相符,扩增特异性好,纯度高。
2.2 阳性克隆质粒的鉴定
1%琼脂糖凝胶电泳割胶回收PCR 产物,连接pGEM-T 克隆载体,并转化至E.coli DH5α 感受态细胞中,蓝白斑筛选阳性克隆菌落,摇菌过夜,进行菌液PCR 鉴定,电泳结果中条带清晰(图2),插入片段约1 700 bp,取1,2,3 保种后送广州美吉生物测序。

图1 car-TC 基因的PCR 扩增电泳图Fig.1 Electrophoresis of amplified car-TC gene
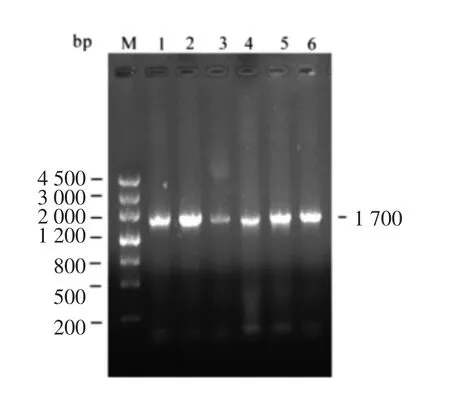
图2 pGEM-car-TC 重组质粒PCR 验证Fig.2 Electrophoresis detection of pGEM-car-TC gene amplified
2.3 car-TC 基因和蛋白序列的分析
2.3.1 理化性质分析 测序结果经BLAST 比对,该基因被NCBI 登录的蛹虫草Cordyceps militaris CM01 dioxygenase,putative (CCM_06728),partial mRNA 基因覆盖,覆盖率达到84.6%,覆盖区段完全相同。在线进行ORF 查找,阅读框架1 734 bp,应用DNAStar 软件包翻译成氨基酸序列,在线提交ProtParam (http://web.expasy.org/protparam/)进行一级结构的预测和分析。得出该基因编码蛋白的一级结构特征:氨基酸残基总数577 个,分子质量64.8 ku,理论等电点5.82,分子式C2892H4437N801O874S12,总原子数量为9 046,不稳定系数为35.55,为稳定蛋白质,理论半衰期大于20 h (在酵母,真菌体内)。脂肪族系数71.96。在ProtScale(http://web.expasy.org/protscale/)在线分析,平均亲水性-0.574,为亲水蛋白,符合其在水溶液中起催化作用的特性,与其定位于有色体基质相符合。
2.3.2 信号肽预测分析和亚细胞定位 应用SignalP4.1 在线分析其信号肽和亚细胞定位。由信号肽分析图谱可见,C 值最高值为0.110,表明无剪切位点,S 值最大为0.118,表明该蛋白不含信号肽,S-mean=0.100,该蛋白属于非分泌蛋白。应用TMHMM Server 2.0 在线分析跨膜螺旋结果显示该蛋白序列不含有跨膜区域。同样的结果也在Protein Predict 得到证明,该蛋白定位于有色体基质。
2.3.3 二级结构预测与分析 氨基酸序列在线提交ProteinPredict,预测其二级结构以卷曲为主,占到了73.14%,其次为β-折叠占23.05%,α-螺旋最少,为3.81%。
2.3.4 结构域和超家族 应用NCBI BLAST 分析其保守结构域,结果表明该蛋白具有视网膜上皮色素膜蛋白(Retinal pigment epithelial membrane proein)的典型结构域RPE65,该结构域长422aa。在InterPro(http://www.ebi.ac.uk/interpro/)中检索,其登入号为IPR004294。该酶属于类胡萝卜素裂解氧化酶家族,该家族代表在视网膜上皮细胞的膜上皮细胞受体的一类蛋白,同时,该家族还包含了在很多光合和非光合的植物和真菌体内的类胡萝卜素β-双加氧裂解酶。含有一个特征结构域。
2.3.5 三级结构预测分析 将翻译的氨基酸序列在线提交 ExPaSy (http://www.expasy.org/proteomics),进行同源建模,对蛹虫草CCD 酶蛋白质进行三维结构预测,通过比对,该酶与多种已知结构的RPE65 家族的酶类高度同源,多种建模方式表明,该酶以单体形式完成催化反应(Matching prediction)。
选择可信度最好的4zhk.1.A 模型建模,该模型包含RPE65 典型结构域,覆盖率达到0.84,认为接近试验数据,评分0.65,预测的蛋白三级结构如图3所示。可见其包含了CCD 催化活性所必须的4个保守的组氨酸残基(HIS236、His288、His358、His570),这4 个组氨酸聚集在由β-折叠构成的螺旋桨形三维结构的轴线附近,可以结合催化活性所需要的非血红素形式的亚铁离子。
2.3.6 多重序列比对和系统发育进化树的构建选取已有报道的真菌源CCD 基因,以粗糙链孢菌(Neurospora_crassa) 的类胡萝卜素裂解氧化酶(CCO)为外群,运用ClustalX 进行多序列比对,运用MAGA6.06 软件,按照邻接法 (neighbor-joining,NJ)建树,bootstrap=1 000[16]。结果见图4。分支上的数字代表该分支的可靠性。
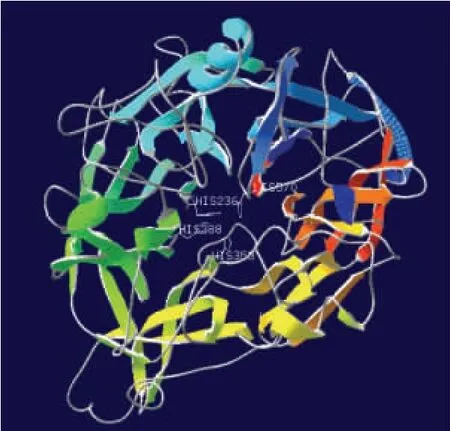
图3 蛹虫草CCD 酶的三维结构Fig.3 Tertiary dimensional structure of CCD enzyme of Cordyceps militaris

图4 蛹虫草CCDs 氨基酸序列系统进化分析Fig.4 Phylogenetic tree analysis of CCDs amino acid sequence
通过ClustalX 对该蛋白质的氨基酸序列进行多重序列比对并建树。与相关研究结果[17]一致,不同物种乃至成员之间的CCDs 基因的氨基酸序列差距较大,然而序列中结合亚铁离子的4 个组氨酸位点高度保守。
2.4 表达量差异
从图5中可以看出,在白色菌丝阶段,car-TC基因的表达量最高,且与其它生长阶段的表达量有显著差异。总体而言,表达量呈逐渐降低的趋势。
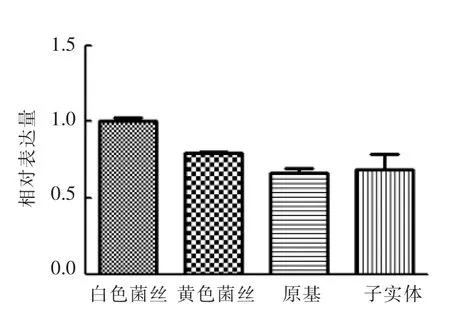
图5 car-TC 基因随生长阶段的相对表达量Fig.5 Transcription level of car-TC genes in different growth stage
3 讨论
随着分离提纯技术的发展,越来越多的生物活性成分被鉴定出来,其中类胡萝卜素独特的双键系统赋予其很多优良的性质,如抗氧化,抗肿瘤等。其中,蛹虫草类胡萝卜素因其具有良好的水溶性,而引起人们的注意。蛹虫草类胡萝卜素中的北虫草黄素是一种脱辅基类胡萝卜素,在所有报道的生物中,脱辅基类胡萝卜素的合成都是由含有非血红素Fe2+的酶催化的,被鉴定为类胡萝卜素氧化裂解酶(CCDs),该酶广泛的分部在动物、植物、微生物等物种中,在水稻恶苗病菌(Fusarium.fujikuroi)中催化番茄红素氧化裂解为链孢霉黄素(neurosporaxanthin) 的酶揭示了该类酶在子囊菌类胡萝卜素合成中的功用[18]。
随着apocarotenoid-15',15'-oxygenase (ACO)的三维结构被测定[19],CCDs 序列和结构有广泛的共性:CCDs 的三维结构是由β-折叠组成的螺旋桨形结构,在螺旋桨的中轴线上有通过保守的组氨酸残基结合活性中心Fe2+,可以通过活化分子氧,将氧插入双键之间造成双键断裂,已有研究证明将氧分子的两个氧原子同时加在断裂的碳链两端的双加氧催化过程是双键裂解酶的普遍特征[20]。通过对保守区域的比对和三维结构的构建,可以看出克隆到的基因即是一个CCD 酶基因,该基因所编码的酶的结构和功能还有待进一步研究,本研究为阐明蛹虫草类胡萝卜素的生物合成途径奠定了基础。
4 结论
从蛹虫草子实体中克隆了一个car-TC 基因,长1 784 bp,包含一个RPE65 特征结构域并含有CCD 保守的4 个组氨酸残基起到结合催化中心铁离子的作用,定位于有色体基质。实时荧光定量PCR 分析表明其表达量随着生长阶段的进行有下降的趋势,在白色菌丝中表达量最高,推测是产物积累对其表达产生的抑制,其具体的调控机制有待于进一步考察。
