沙棘粕醇提取物对小鼠氧化应激损伤的保护作用及机制
2019-08-07张佳婵化璟琳王昌涛孙宝国
张佳婵 程 琳 化璟琳 王昌涛* 赵 丹 孙宝国
(1 北京工商大学 北京食品营养与人类健康高精尖创新中心 北京100048 2 北京工商大学理学院 植物资源研究开发北京市重点实验室 北京100048 3 北京工商大学食品学院 食品添加剂与配料工程研究中心 北京100048)
人体的衰老与氧化应激密不可分。通常情况下机体内氧自由基的产生和清除处于动态平衡。低剂量的活性氧能够激发机体产生保护性应激反应,延缓衰老;当氧化损伤在体内的聚集程度超过机体抗氧化系统自身的清除能力时,自由基大量生成,进一步引起核酸、蛋白质等大分子物质的异常表达[1-3]。
随着社会的发展,人们越来越关注机体健康的防护。对天然抗氧化活性成分的发掘和作用机制的研究越来越受到人们的关注。这些抗氧化活性物质[4-7]不仅能直接清除自由基,还能提高机体的抗氧化酶活性,降低过氧化产物如丙二醛(Malondialdehyde,MDA)、脂褐素(Lipofuscin,LP)的积累,发挥防护作用。此外,机体在防御氧化应激的过程中也会激活一系列细胞因子,如核因子E2 相关因子2(NF-E2-related factor 2,Nrf2)、核因子kappa-B (Nuclear factor kappa-light-chain-enhancer of activated B cells,NFκB)、p38 激酶等。其 中,Kelch 样 ECH 关 联 蛋 白1 (Kelch-like ECH-associated protein-1,Keap1)-核因子相关因子 (NF-E2-related factor 2,Nrf2)/抗氧化反应元件(Antioxidant response element,ARE)信号通路被认为是机体抗氧化应激的关键通路,该通路调控的抗氧化酶系和Ⅱ相解毒酶能够清除ROS 等有害物质,因而表现出解毒和中和的作用[8-9]。
沙棘粕是沙棘籽经过脱油处理后的副产物,前期研究已证实沙棘粕醇提物中富含丰富的黄酮、多酚、原花青素等活性成分,具有显著的抗氧化,抗衰老的功能[10-12]。然而,目前还未开展以动物为载体的实验研究。本试验采用D-半乳糖腹腔注射建立氧化应激模型,同时灌注不同剂量的SBSE,测定小鼠肝脏组织和脑组织的总抗氧化能力(Total antioxidant capacity,T-AOC)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、超氧化物歧化酶(Superoxide dismutase,SOD)和过氧化氢酶(Catalase,CAT)活性以及丙二醛(Malondialdehyde,MDA) 和脂褐素(Lipofuscin,LP)含量,测定小鼠血清中白介素-2(Interleukin-2,IL-2)和白介素-6(Interleukin-6,IL-6)含量,并探索SBSE 对肝脏组织抗氧化相关基因表达水平的影响,从基因水平探索SBSE 对氧化应激损伤的保护机制,为SBSE 的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
沙棘粕,青海康普生物科技股份有限公司,均烘干粉碎,过筛;ICR 小鼠,雄性,(23±3)g,北京维通利华实验动物技术有限公司。
D-半乳糖,美国Sigma Aldrich 公司;生理盐水、无水乙醇(均为分析纯),北京化工厂;考马斯亮蓝蛋白测定试剂盒、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)检测试剂盒、超氧化物歧化酶(Superoxide dismutase,SOD) 检测试剂盒、过氧化氢酶(Catalase,CAT)检测试剂盒、脂质氧化(Malonaldehyde,MDA)检测试剂盒、总抗氧化能力监测试剂盒(Total antioxidant capacity assay kit with ABTS method,T-AOC),碧云天生物技术有限公司;组织脂褐素(Lipofuscin,LP)含量荧光定量检测试剂盒,上海极威生物科技有限公司;小鼠白细胞介素-2(IL-2)ELISA 试剂盒、小鼠白细胞介素-6(IL-6)ELISA 试剂盒,上海裕平生物科技公司;动物组织总RNA 提取试剂盒、FastQuant RT Kit(含gDNase)、SYBR green,天根生物科技(北京)有限公司。
1.2 仪器与设备
BS2202S 型电子天平,北京赛多利斯仪器系统有限公司;DSHZ-300 恒温水浴振荡器,江苏省太仓市实验设备厂;T6 新世纪紫外-可见分光光度计,北京普析通用仪器有限公司;YJ-2450 医用超净工作台,苏州净化设备厂;SPx-250BF-2 生化培养箱,上海福玛实验设备有限公司;FC Multiskan 酶标仪,赛默费世尔(上海)仪器有限公司;Anke 3-30K 台式高速冷冻离心机,德国Sigma 公司。
1.3 试验方法
1.3.1 SBSE 制备及初步分离 SBSE 的制备及初步分离方法参照文献[11],最终获得试验用SBSE。经测定,10 mg/mL SBSE 溶液中黄酮含量为(2.97±0.31) mg/mL,总酚含量为(4.71±0.21) mg/mL,原花青素含量为(5.67±0.17)mg/mL。
配制0.5%的羧甲基纤维素钠水溶液,以该溶液为溶剂,配制25 mg/mL SBSE 灌胃溶液。
1.3.2 动物实验
1.3.2.1 实验动物分组及氧化模型的制备 SPF级ICR 雄性小鼠50 只,平均体质量(23±3) g,适应性饲养一周,随机分成5 组,每组10 只,分别为:对照组、模型组、SBSE 高剂量组(SBSE-H)、SBSE 中剂量组(SBSE-M)、SBSE 低剂量组(SBSE-L)。除对照组外,其它各组腹腔注射10% D-半乳糖溶液,剂量为100 mg/(kg·d),以体质量计,下同;对照组小鼠注射相同剂量生理盐水;低、中、高剂量组小鼠分别以100,300,600 mg/(kg·d)的SBSE 灌胃。对照组和模型组灌胃等体积生理盐水。持续处理42 d。灌胃期间自由饮水和进食,饲养环境温度22~25 ℃,相对湿度50%~60%,每隔3 d 更换一次垫料,光照充足。
1.3.2.2 小鼠实验样本收集 实验结束时,小鼠处死前12 h 禁食,摘眼球取血,4 000 r/min 4 ℃离心15 min,分离血清,分装保存于-20 ℃备用。颈椎脱臼法处死小鼠,取一部分肝脏、脑组织液氮条件下速冻后置于-80 ℃保存,用于相关基因表达水平的检测。另一部分肝脏和脑组织以1∶9(m/V)的比例加入预冷的生理盐水,冰浴下匀浆制备10%匀浆液,3 000 r/min 4 ℃离心15 min,取上清液用于测定组织生化指标。
1.3.2.3 SBSE 对小鼠生化指标的测定 小鼠血清中IL-2、IL-6 含量的测定按照试剂盒说明书的方法进行。肝脏、脑组织匀浆中SOD、GSH-Px、CAT、T-AOC 活力、氧化产物脂褐素和MDA 含量的测定均按照试剂盒说明书的方法进行。
1.3.2.4 肝组织抗氧化相关基因表达水平的测定取出保存于-80 ℃的肝脏和脑组织,依次进行组织RNA 的提取、RNA 纯度及完整性的鉴定、合成cDNA 以及利用半定量实时荧光定量聚合酶链式反应 (quantitative Real-Time PCR,qRT-PCR)方法监测肝脏中相关抗氧化基因mRNA 的表达情况。各基因引物序列见表1。
1.4 统计学分析
试验数据利用SPSS 19.0 数据处理软件进行统计学处理,组间比较采用单因素ANOVA 分析,两两比较采用t 检验,以P<0.05 为差异有统计学意义,所得结果以±s 表示。
2 结果与分析
2.1 SBSE 对小鼠肝脏和脑组织T-AOC 水平的影响
图1为SBSE 对小鼠肝脏组织和脑组织的总抗氧化能力水平的影响。模型组小鼠肝脏组织和脑组织的T-AOC 活力显著低于对照组,且差异显著(肝脏组织,P<0.01;脑组织,P<0.05),说明D-半乳糖诱导小鼠氧化应激损伤模型成功建立。SBSE对小鼠肝脏组织和脑组织的T-AOC 水平有显著影响:SBSE-L 组的T-AOC 水平显著高于模型组(肝脏组织,P<0.05;脑组织,P<0.01)。SBSE-M 组和SBSE-H 组小鼠肝脏组织和脑组织的T-AOC水平与模型组相比无显著性差异(P>0.05)。

表1 抗氧化相关基因实时荧光定量PCR 引物序列Table 1 Primer sequences of anti-oxidative related genes for real time PCR

图1 肝脏组织、脑组织总抗氧化能力的变化Fig.1 Levels of T-AOC in liver and brain in rats
2.2 SBSE 对小鼠肝脏和脑组织LP 和MDA 水平的影响
D-半乳糖的连续注射会导致小鼠机体细胞内糖代谢紊乱,破坏机体抗氧化防御系统,积累大量自由基,过剩的自由基攻击蛋白质、DNA 等生物大分子,引发氧化反应产生大量的LP、MDA 等,最终导致机体衰老。LP 和MDA 是公认的评价氧化应激损伤、机体衰老的标志。表2为SBSE 对小鼠肝脏组织和脑组织中LP 和MDA 的影响结果。由表2可知,D-半乳糖诱导的模型组小鼠LP 和MDA水平显著高于对照组(LP,P<0.05;MDA,P<0.01),氧化应激损伤模型建立;SBSE 处理小鼠后,肝脏组织和脑组织中LP 和MDA 含量均显著低于模型组。
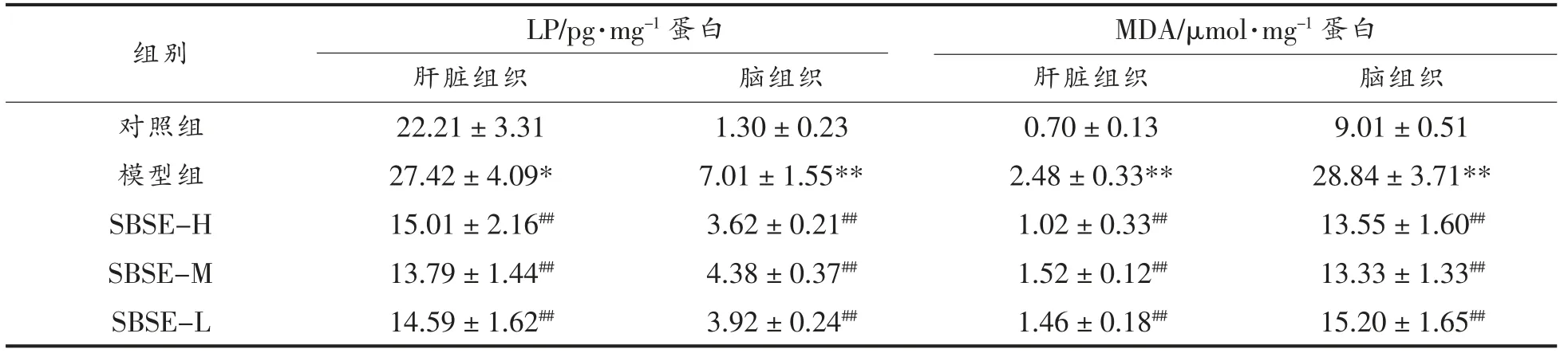
表2 小鼠肝脏组织和脑组织中LP 和MDA 水平变化Table 2 Levels of LP and MDA in liver and brain in rats
2.3 SBSE 对小鼠肝脏和脑组织抗氧化酶活性的影响
机体通过自身的氧化还原系统应对外界刺激导致的氧化应激失衡。SOD、GSH-Px 和CAT 的活性直接反映了机体清除自由基的能力。表3为SBSE 对小鼠肝脏组织和脑组织中SOD、GSH-Px和CAT 水平的影响结果。与对照组相比,模型组小鼠肝脏组织和脑组织中SOD、GSH-Px 和CAT水平均显著降低(P<0.01);SBSE-M 组和SBSE-L组小鼠肝脏SOD 水平显著高于模型组,然而,SBSE-H 组肝脏SOD 水平与模型组差异不显著(P>0.05);脑组织SOD 水平与SBSE 剂量存在正相关,在中、高剂量组中的含量显著高于模型组(P<0.01),SBSE-L 组与模型组差异不显著(P>0.05);SBSE-L 组肝脏GSH-Px 水平(77.85±13.10 mU/mg 蛋白)显著高于模型组(P<0.01),随着SBSE 剂量的增加,并不能显著增加肝脏GSH-Px 水平,SBSE-M 组GSH-Px 含量与模型组无显著差别(P>0.05),SBSE-H 组GSH-Px 含量为(48.61± 9.12)mU/mg 蛋白,显著高于模型组,而低于SBSE-L组;SBSE 并未对脑组织GSH-Px 水平有显著影响,SBSE 低、中、高剂量组GSH-Px 水平与模型组相比无显著性差异(P>0.05);SBSE 对氧化损伤小鼠的CAT 活力影响显著,SBSE-L 组小鼠肝脏CAT 活力达到(587.66±25.63)U/mg 蛋白,显著高于模型组(551.00± 41.85)U/mg 蛋白,中、高剂量SBSE 对小鼠肝脏CAT 活力与模型组相比无显著影响(P>0.05),而SBSE 对脑组织中CAT 活力有极显著作用,与模型组(42.42± 6.64 U/mg 蛋白)相比,SBSE 低、中、高剂量组均显著提高(P<0.01),且随着剂量的增大,CAT 活力呈上升趋势。
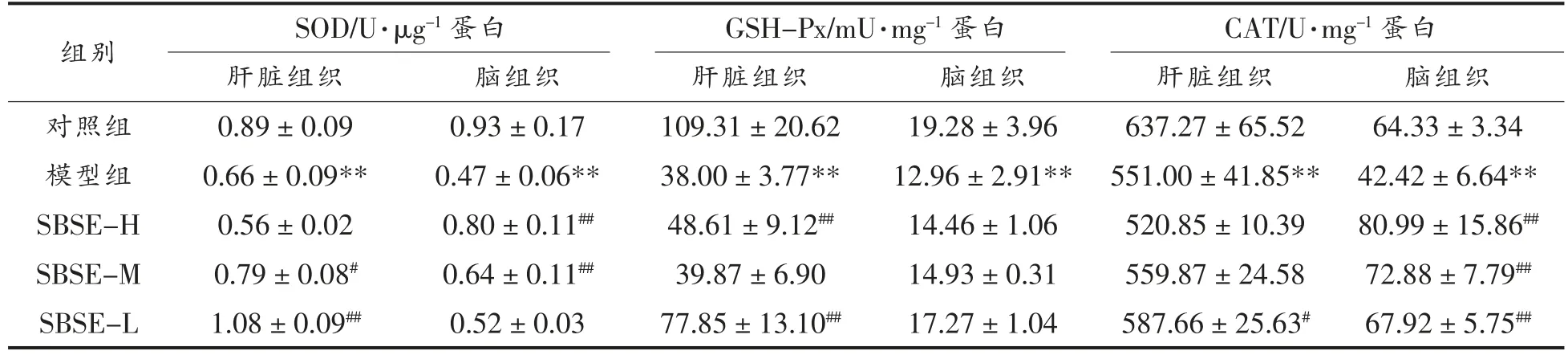
表3 小鼠肝脏组织和脑组织中SOD、GSH-Px 和CAT 水平变化Table 3 Levels of SOD,GSH-Px and CAT in liver and brain in rats
2.4 SBSE 对小鼠血清IL-2 和IL-6 水平的影响
机体氧化应激损伤导致免疫功能低下,免疫系统是哺乳动物抵抗恶劣环境袭击的第一道防线。血清中IL-2 和IL-6 是机体免疫调节中最重要的细胞因子之一。D-半乳糖导致氧化应激损伤,机体免疫系统迅速作出应答,模型组IL-2 和IL-6 水平显著高于对照组(P<0.01)(图2)。SBSE处理氧化应激损伤的小鼠后,IL-2(图2a)和IL-6(图2b) 水平与模型组相比出现显著影响,SBSEM 组小鼠IL-2 和IL-6 水平显著高于模型组 (P<0.05),低剂量和高剂量组小鼠IL-2 和IL-6 水平与模型组相比无显著性差异(P>0.05)。

图2 小鼠血清中IL-2,IL-6 水平的变化Fig.2 Levels of IL-2 and IL-6 in the serum of rats
2.5 SBSE 对小鼠肝脏抗氧化相关基因mRNA水平的影响
Keap1-Nrf2/ARE 信号通路是抗氧化应答机制中最重要的一条信号通路[13]。在正常情况下,核转录因子Nrf2 的转录活性被其负调节因子Keap1控制在细胞质中,且被泛素蛋白酶体途径迅速降解。当细胞受到氧化应激时,Nrf2 从Keap1 的捕获中解离出来,转位入核,与核内抗氧化应答元件ARE 相结合,激活下游基因,调节解毒酶和抗氧化酶基因的表达水平,维持体内平衡。被激活的抗氧化酶基因包括血红素加氧酶1 (Heme Oxygenase 1,HO-1),NAD(P)H 醌氧化还原酶1(NAD(P)H:quinine oxidoreductase 1,NQO1)等。
图3为小鼠肝脏与Keap1-Nrf2/ARE 信号通路相关的Keap1、Nrf2、HO-1、NQO1 基因的表达情况。模型组Keap1 mRNA 相对表达量显著低于对照组 (P<0.01,图3a),Keap1 相对表达量的降低,释放了核转录因子Nrf2,使模型组Nrf2 mRNA 相对表达量显著提高(P<0.05,图3b),进而激活下游抗氧化酶,使模型组抗氧化基因HO-1和NQO1 的相对表达量显著上升(P<0.01,图3c、3d),以应对外界引起的氧化应激损伤。由图3可知,SBSE 的摄入具有提高小鼠氧化应激应答的效果:SBSE-M 组和SBSE-H 组Keap1 mRNA 相对表达水平与对照组相比显著降低,低剂量SBSE-L组Keap1 mRNA 表达水平与对照组无显著差异(图3a);SBSE 处理组的小鼠肝脏Nrf2 mRNA 表达水平显著高于对照组,且呈剂量依赖型特征,与模型组相比也有增加趋势,说明SBSE 促进Nrf2与ARE 的结合(图3b);与空白对照组相比,3 种剂量SBSE 处理小鼠均可提高下游抗氧化基因HO-1 mRNA 的表达水平,与模型组相比也具有增加趋势 (图3c);SBSE-L 组小鼠NQO1 mRNA表达水平显著高于对照组和模型组,但是SBSEM 组与对照组无显著性差异,SBSE-H 组与对照组差异显著(图3d)。
3 讨论
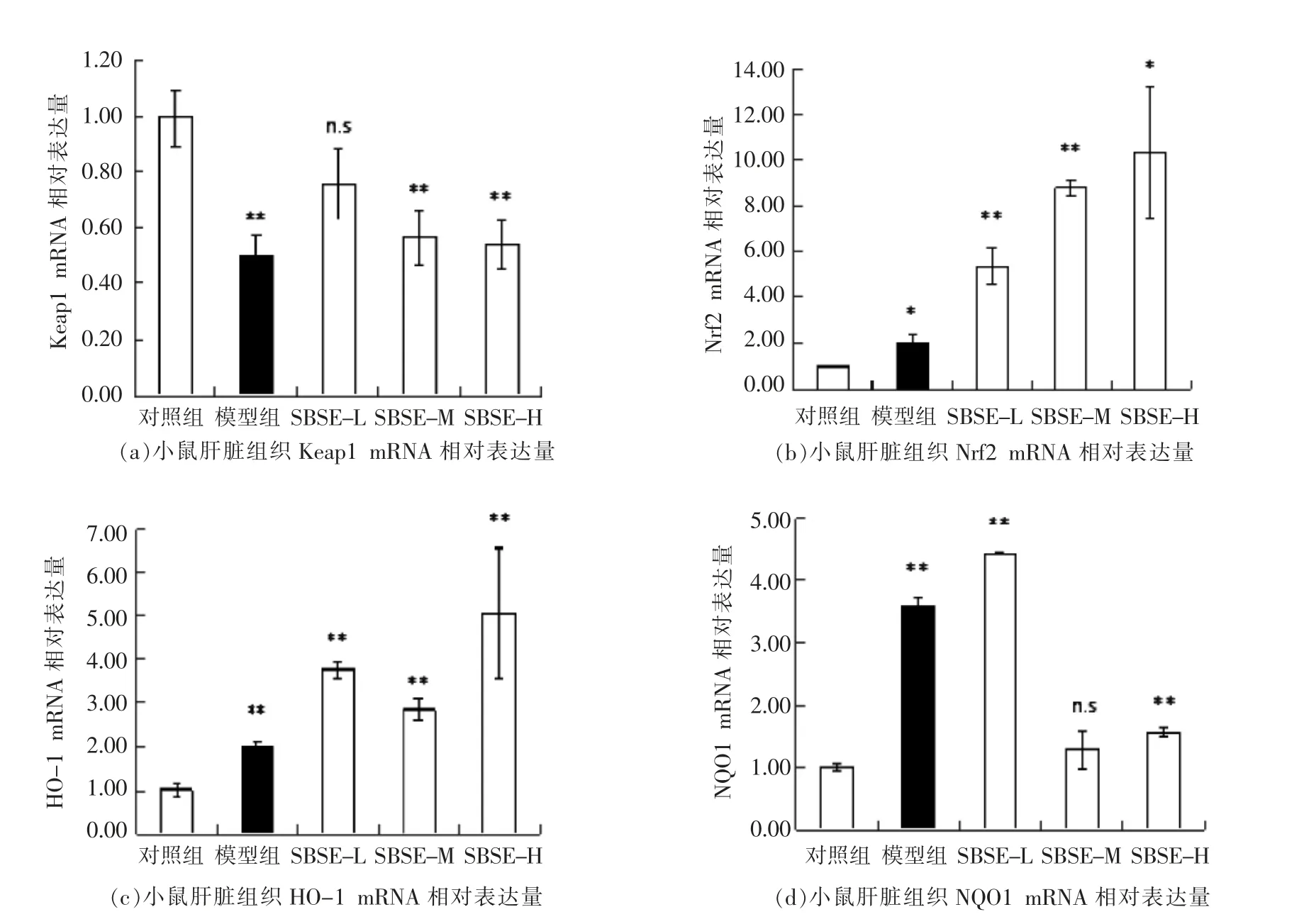
图3 SBSE 对小鼠肝脏组织抗氧化相关基因相对表达量的影响Fig.3 Effect of SBSE on the antioxidant genes in liver
D-半乳糖的长期注射使小鼠不能完全代谢,进而堆积在体内导致细胞渗透压变化,细胞肿胀,代谢紊乱。同时,代谢过程中大量的自由基积累,导致机体氧化应激损伤[14-15]。研究证实,D-半乳糖诱导的氧化应激导致小鼠衰老,已被广泛应用于抗氧化剂、抗衰老药物等的筛选[5,16-17],如阿魏酸[18]、银杏叶提取物[19]、槲皮素[20]、阿托伐他汀[21]等。
在正常情况下,机体氧化与抗氧化处于动态平衡,机体自身的抗氧化酶如SOD、CAT、GSH-Px等在清除自由基方面发挥重要作用。当外界刺激导致氧化应激损伤,使机体代谢紊乱,无法维持起初的平衡状态时,脂质过氧化导致机体产生大量过氧化产物。MDA 是目前公认能反映氧自由基产生及引发的脂质过氧化反映的间接指标,其含量变化不但可以反映氧自由基生成量及氧化反应的强烈程度,还可反映其对组织损伤的严重程度[22]。LP 是过氧化脂质分解产物,是一种长期积累在细胞内的残余体,是目前公认的老化指标之一[23]。随着损伤的加剧,过氧化产物增多。与此同时,机体氧化应激损伤导致免疫功能低下,血清中IL-2 和IL-6 是机体免疫调节中最重要的细胞因子之一,在机体内产生积极的生物学活性。
在本试验中,模型组小鼠肝脏组织和脑组织T-AOC 活力显著低于对照组,且差异显著(肝脏组织,P<0.01;脑组织,P<0.05);抗氧化酶SOD、GSH-Px 和CAT 活性显著低于对照组 (P<0.01);过氧化产物MDA 和LP 含量均与对照组有显著差距(P<0.05);机体免疫系统迅速作出应答,IL-2 和IL-6 迅速升高,小鼠氧化应激损伤模型建立成功。与模型组相比,SBSE-L 组(低剂量组)灌胃损伤小鼠,小鼠T-AOC 水平显著上升(肝脏组织,P<0.01;脑组织,P<0.05),中、高剂量组与模型组差异不显著;一定剂量下,SBSE 可以显著提高损伤小鼠肝脏和脑组织中抗氧化酶SOD、GSH-Px 和CAT 活性,说明SBSE 有助于机体清除自由基,修复抗氧化系统。并且,灌胃SBSE 一段时间后,机体过氧化产物LP 和MDA 含量均显著低于模型组(P<0.01),说明SBSE 能够减轻小鼠脂质过氧化,缓解氧化应激对组织的损伤程度。与此同时,SBSE-M 组 (中剂量组)IL-2 和IL-6 含量与模型组相比有显著增加(P<0.05),低剂量组和高剂量组小鼠血清IL-2 和IL-6 含量与模型组无显著性差异,这说明一定剂量的SBSE 还可以提高小鼠免疫系统功能,促进免疫细胞因子IL-2 和IL-6 的分泌。
Keap1-Nrf2/ARE 通路被认为是机体最重要的内源性抗氧化信号通路。外界刺激引发Nrf2/ARE 信号的激活,Keap1 相对表达量降低,释放了核转录因子Nrf2,促进Nrf2 与ARE 结合,进一步激活下游抗氧化酶及Ⅱ型解毒酶基因,使机体发挥抗氧化调节作用[8]。许多植物来源活性成分可以通过激活该通路来对抗机体的氧化应激损伤。白藜芦醇是葡萄籽、葡萄皮中的重要活性成分,白藜芦醇可能通过激活Nrf2/ARE 信号通路降低心肌缺血再灌注损伤大鼠炎症和氧化应激[24]。柿叶提取物通过激活Nrf2/HO-1 信号途径,促进Nrf2 合成和核转位,从而促进下游抗氧化蛋白HO-1 的表达来减弱阿尔茨海默病细胞模型HEK293-APPswe(20E2)氧化应激的损伤[25]。橙皮素是植物来源黄酮类物质,研究证明它可以通过激活Nrf2/ARE/HO-1 与PPARγ 途径来达到抑制肝脏细胞的氧化应激、炎症以及细胞增殖从而降低癌症的发生[26]。从鹿蹄草中提取的活性成分2'-O-金丝桃苷具有显著的防护肝损伤的作用,其机制也是围绕Nrf2/ARE 信号通路发挥防护氧化应激损伤的作用[27]。本课题研究对象SBSE,其发挥保护作用的机制与Keap1-Nrf2/ARE 信号通路密切相关。研究发现,SBSE 降低了负调节因子Keap1 的表达水平,促进Nrf2 与Keap1 的解离;Nrf2 表达水平均显著高于对照组,且存在剂量依赖型特征;与对照组相比,SBSE-L 组下游抗氧化基因NQO1 mRNA 表达水平显著增加(P<0.05),并且在试验考察剂量范围内,HO-1 mRNA 的表达水平显著上升(P<0.05)。
综上所述,SBSE 能够提高损伤小鼠肝脏和脑组织的T-AOC 活力、抗氧化酶活性,降低过氧化产物MDA 和LP 的含量,增加小鼠血清中免疫调节因子IL-2 和IL-6 的水平,其作用机制与其提高机体的抗氧化能力,增强机体免疫调节功能有关,其中,Keap1-Nrf2/ARE 信号通路在SBSE 发挥保护功能的过程中起到重要作用。
