奥曲肽对胰腺癌模型大鼠细胞凋亡的影响及作用机制研究
2019-07-31杨梅柳英辉陈文习
杨梅,柳英辉,陈文习
胰腺癌是一种临床较为常见的消化系统恶性肿瘤,恶性程度极高,直接导致临床诊断和治疗均较为困难[1-2]。胰腺癌症状主要临床表现为腹痛、乏力、黄疸以及一系列的消化道症状,对患者的生活质量造成严重的影响,因此寻找一种安全有效的治疗方法具有重要意义[3]。奥曲肽能够调控胰腺分泌,临床常应用于胰腺炎的治疗,但是关于其对胰腺癌症状干预效果的研究还相对较少。大量实验研究表明,肿瘤组织的发生发展与细胞凋亡能力密切相关[4],本文研究中设计实验,建立胰腺癌大鼠模型,并使用奥曲肽进行干预,旨在探究奥曲肽对胰腺癌模型大鼠细胞凋亡的影响及相关作用机制。
1 材料与方法
1.1 材料
1.1.1 研究动物 选取50只SD健康雄性大鼠,由广西医科大学实验动物中心提供,年龄3~5个月,平均年龄(4.1±0.5)月,体质量200~252 g,平均体质量(225.3±10.6)g。所有大鼠均养殖在干净笼子里,室温控制在20.3~23.9 ℃,相对湿度35%~40%,每天光照12 h,喂饮纯净水,饲养时间为1周。本文研究所做实验均获得我院伦理委员会批准。
1.1.2 主要试剂 奥曲肽(北京诺华制药有限公司);大鼠抗小鼠Bcl-2抗体(Gibco公司);小鼠抗大鼠PI3K抗体(Invitrogen公司);大鼠抗兔Akt抗体(Sigma公司);兔抗大鼠IL-6、TNF-α抗体(Dako公司);PBS缓冲液、SDS-PAGE蛋白缓冲液、TBST缓冲液、BCA蛋白定量试剂盒(BD公司)。
1.2 方法
1.2.1 建模及分组 使用随机数字表法选取10只大鼠作为本文研究正常组,不做任何处理,其余40只大鼠进行胰腺癌模型建立,建模方法参照王云检[5]研究中建模标准并作出适当改动:建模前1 d对所有大鼠禁食不禁水。对大鼠进行麻醉处理后于上腹部正中部位作一1 cm左右切口,使胰腺组织暴露出来,在胰腺组织尾部将胰腺组织被膜以及部分实质切开1 mm左右,将9 mg DMBA植入,之后将切口缝合,并进行预防感染处理。1周后对造模大鼠进行观察,大鼠皮下出现直径0.8 cm左右的结节视为建模成功,最终建模成功37只,将37只胰腺癌大鼠随机分为模型组10只以及低、中、高剂量奥曲肽组各9只。分别使用0.2 mg、0.4 mg、0.6 mg奥曲肽对低、中、高剂量奥曲肽组大鼠进行皮下注射,1次/d,连续给药10周,正常组与模型组大鼠均使用生理盐水进行干预。
1.2.2 标本采集 停止用药后,对五组大鼠进行全麻处理,采用断头法处死,将大鼠胰腺组织完全剥离出来,并对胰腺癌组织体积、质量进行检测,然后进行病理组织切片。
1.2.3 肿瘤细胞凋亡率、周期分布检测 使用流式细胞仪检测细胞凋亡、周期分布情况,将细胞传代至5孔板之中,并将细胞在37 ℃、5% CO2的环境中进行培养,加入0.25%胰蛋白酶消化,使用2 000 r/min的离心机处理5 min后使用PBS缓冲液清洗2次,再次离心处理并收取细胞,加入1 mL PI染液,在避光的常温环境中放置1 h,然后用特异荧光标记后,在鞘液包裹下高速流动中,流动期间会发射出光子,严格按照流式细胞仪检测细胞凋亡及周期分布情况。
1.2.4 HE染色处理 对五组大鼠切片样本进行染色处理,使用二甲苯进行常规脱蜡处理2次,每次5 min,然后在梯度酒精下水花处理3 min,自来水冲洗1次;使用苏木素染色5 min,自来水冲洗1次;使用浓度为1%的盐酸酒精分化处理30 s,在0.2%氨水中反蓝处理2 min,自来水冲洗1次;在浓度0.5%伊红染色10 min,自来水冲洗1次;使用乙醇梯度进行脱水处理,最后用中性树胶进行封片,使用光学显微镜进行图像分析。
1.2.5 Western blot法检测Bcl-2、PI3K、Akt、PTEN、p-Akt、mTOR表达 使用PBS缓冲液清洗标本3次,分离缓冲液之后裂解0.5 h,对蛋白浓度进行测定。取20 μg/孔蛋白质,加入适量SDS-PAGE蛋白缓冲液后电泳10 min,在10%的牛奶中浸泡电转膜,摇床上常温封闭1.5 h;与一抗结合之后使用TBST进行稀释,并孵育、保存;次日使用TBST液进行清洗,与二抗结合后常温孵育1 h,再次清洗,加入显影剂显色,对Bcl-2、PI3K、Akt、PTEN、p-Akt、mTOR表达进行测定。
1.3 统计学方法

2 结果
2.1 各组大鼠胰腺组织病理组织学观察
如图1所示,正常组大鼠胰腺组织正常,模型组大鼠胰腺组织出现大量的炎症细胞浸润现象,细胞排列不规则,低、中、高剂量奥曲肽组大鼠炎症细胞浸润现象出现减轻,高剂量奥曲肽组大鼠仅有轻微的炎症细胞浸润现象,胰腺组织基本正常。

图1 各组大鼠胰腺组织病理组织学观察图(HE染色,×200)
2.2 各组大鼠肿瘤体积、质量比较
如表1所示,模型组大鼠肿瘤体积、质量均高于低、中、高剂量奥曲肽组,差异具有统计学意义(P<0.05);高剂量奥曲肽组大鼠肿瘤体积、质量均低于低、中剂量奥曲肽组,差异具有统计学意义(P<0.05)。
2.3 各组大鼠肿瘤细胞凋亡、周期分布情况对比
如表2所示,模型组大鼠肿瘤细胞凋亡率低于其他三组,且高剂量奥曲肽组大鼠肿瘤细胞凋亡率高于低、中剂量奥曲肽组,差异具有统计学意义(P<0.05)。低、中、高剂量奥曲肽组处于G1期的细胞比例高于模型组,处于S期与G2期的细胞比例低于模型组,且高剂量奥曲肽组处于G1期的细胞比例高于低、中剂量奥曲肽组,处于S期与G2期的细胞比例低于低、中剂量奥曲肽组,差异具有统计学意义(P<0.05)。
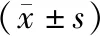
表1 各组大鼠肿瘤体积、质量比较
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量奥曲肽组比较,△P<0.05;与中剂量奥曲肽组比较,☆P<0.05
2.4 各组大鼠细胞凋亡相关蛋白Bcl-2、PI3K、Akt表达情况对比
如表3、图2所示,正常组大鼠细胞凋亡相关蛋白Bcl-2、PI3K、Akt相对表达量均低于其他四组,模型组大鼠细胞凋亡相关蛋白Bcl-2、PI3K、Akt相对表达量均高于低、中、高剂量奥曲肽组,且高剂量奥曲肽组大鼠细胞凋亡相关蛋白Bcl-2、PI3K、Akt相对表达量均低于低、中剂量奥曲肽组,差异具有统计学意义(P<0.05)。

表2 各组大鼠肿瘤细胞凋亡、周期分布情况对比
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量奥曲肽组比较,△P<0.05;与中剂量奥曲肽组比较,☆P<0.05

表3 各组大鼠细胞凋亡相关蛋白Bcl-2、PI3K、Akt表达水平对比
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量奥曲肽组比较,△P<0.05;与中剂量奥曲肽组比较,☆P<0.05

图2 Bcl-2、PI3K、Akt表达WB图
2.5 各组大鼠细胞周期蛋白PTEN、p-Akt、mTOR表达情况对比
如表4、图3所示,正常组大鼠细胞周期蛋白PTEN相对表达量高于其他四组,p-Akt、mTOR相对表达量低于其他四组;模型组大鼠细胞周期蛋白PTEN相对表达量低于低、中、高剂量奥曲肽组,p-Akt、mTOR相对表达量高于低、中、高剂量奥曲肽组,且高剂量奥曲肽组大鼠细胞周期蛋白PTEN相对表达量高于低、中剂量奥曲肽组,p-Akt、mTOR相对表达量低于低、中剂量奥曲肽组,差异具有统计学意义(P<0.05)。
3 讨论
胰腺癌是一种临床较为常见的消化系统恶性肿瘤,相比其他恶性肿瘤,胰腺癌恶性程度更高,因此又被称为“癌症之王”[6]。据相关流行病学调查数据显示,近年来我国胰腺癌症状发病率不断提升,并且发病早期无明显症状,因此早期诊断率相对较低,病死率较高,对患者的身体健康甚至生命安全造成严重威胁[7-8],但是目前临床医学对胰腺癌症状的发病机理尚未研究透彻,病因的不确定性加上其恶性程度高、多转发、肿瘤耐药等诸多原因,也导致临床上对胰腺癌的治疗一直是一个难题[9-10]。因此,寻找一种安全有效的治疗胰腺癌的方法具有重要意义。
奥曲肽是一种广谱的生长抑素的八肽衍生物,具有较多的生物活性,并且作用时间较长[11]。大量临床研究表明,奥曲肽能够调控胰腺分泌,因此奥曲肽常应用于胰腺炎的临床治疗[12],但是,关于奥曲肽对胰腺癌症状干预效果的研究还相对较少,因此,本文研究设计实验,建立胰腺癌大鼠模型,并使用奥曲肽进行干预,结果显示,使用奥曲肽进行干预之后,胰腺癌模型大鼠肿瘤体积、重量出现下降,且奥曲肽剂量越大,肿瘤体积、重量下降幅度越明显,说明奥曲肽能够抑制胰腺癌组织生长,且具有一定的剂量依赖性。

表4 各组大鼠细胞周期蛋白PTEN、p-Akt、mTOR表达水平对比
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量奥曲肽组比较,△P<0.05;与中剂量奥曲肽组比较,☆P<0.05

图3 PTEN、p-Akt、mTOR表达WB图
本文研究中对胰腺癌模型大鼠肿瘤细胞凋亡情况进行检测,结果显示,使用奥曲肽进行干预后,大鼠肿瘤细胞凋亡率出现上升,说明胰腺癌细胞凋亡速度加快,可能是因为奥曲肽对细胞凋亡相关通路进行干预,从而起到诱导胰腺癌细胞凋亡的作用。有学者在研究中表示,PI3K/Akt/Bcl-2通路蛋白的表达与细胞凋亡密切相关[13]。Bcl-2是在线粒体通路中起着调节作用的一种重要基因,也是细胞的抑制与凋亡过程中比较重要的基因,当Bcl-2的表达水平下降时,与其相关的Bax表达水平便会随之升高,能够起到促进组织细胞凋亡的作用,许多抗肿瘤药物就是通过对Bcl-2表达进行抑制来达到治疗目的[14]。PI3K是一种磷脂酰肌醇3激酶,能在机体生长因子的作用下集成细胞膜[15]。Akt是在处于PI3K下游的靶蛋白,将它激活后,即激活其他靶蛋白,能促使细胞生长,具有抗凋亡的作用[16]。本文研究中对PI3K/Akt/Bcl-2通路相关蛋白表达情况进行检测,结果显示,相比正常大鼠,胰腺癌模型大鼠Bcl-2、PI3K、Akt相对表达量较高,使用奥曲肽进行干预后,Bcl-2、PI3K、Akt相对表达量受到调控而出现明显的下调,说明奥曲肽可能是通过调控PI3K/Akt/Bcl-2通路相关蛋白Bcl-2、PI3K、Akt的表达而发挥促进胰腺癌大鼠癌组织细胞凋亡的作用。
本文研究中还对胰腺癌模型大鼠肿瘤细胞周期分布情况进行检测,结果发现,使用奥曲肽进行干预后,胰腺癌模型大鼠肿瘤细胞周期分布情况受到明显的调控,出现这一情况的原因可能是奥曲肽调控细胞周期相关通路,进而改善胰腺癌细胞周期。大量实验研究表明,PTEN、p-Akt、mTOR的表达与细胞周期分布情况密切相关[17-19]。徐萍[20]等在研究中表示,使用药物对胰腺癌细胞进行干预,能够调控周期相关蛋白PTEN、p-Akt、mTOR的表达,进而改善胰腺癌细胞周期分布。本文研究结果显示,使用奥曲肽进行干预后,胰腺癌模型大鼠PTEN表达出现上调,p-Akt、mTOR表达出现下调,说明奥曲肽能够通过调控细胞周期相关蛋白PTEN、p-Akt、mTOR的表达,从而改善胰腺癌大鼠肿瘤细胞周期分布情况,起到阻滞细胞周期的作用。
综上所述,使用较高剂量奥曲肽对胰腺癌模型大鼠进行干预,能够使大鼠肿瘤体积、重量下降,调控细胞凋亡相关蛋白Bcl-2、PI3K、Akt的表达,从而促进细胞凋亡,抑制炎症反应,为胰腺癌的治疗提供理论帮助。
