饲粮α-亚麻酸水平对意大利蜜蜂工蜂幼虫生理机能的影响
2019-07-29于静张卫星马兰婷胥保华
于静,张卫星,马兰婷,胥保华
饲粮-亚麻酸水平对意大利蜜蜂工蜂幼虫生理机能的影响
于静,张卫星,马兰婷,胥保华
(山东农业大学动物科技学院,山东泰安 271018)
【】探究饲粮中-亚麻酸的添加水平对意大利蜜蜂()工蜂幼虫抗氧化活性和免疫能力的影响。移取1日龄意大利蜜蜂工蜂幼虫1 200只,随机分为5组,每组5个重复,每个重复48只;其中1组为对照组,饲喂不添加-亚麻酸的基础饲粮,4组为处理组,分别饲喂-亚麻酸添加水平为0.02%、0.04%、0.06%和0.08%的饲粮。按照室内蜜蜂幼虫饲养方法,将1日龄幼虫用移虫针移至温度适宜的加入200 μL饲粮的24孔细胞培养板内,培养板置于恒温培养箱中(温度33℃,相对湿度55%),试验期间每天更换饲粮。饲养至第6天末或第7天初,幼虫开始有直立或排便现象时,将幼虫转移至提前铺好灭菌纸的24孔细胞培养板内准备化蛹。从饲养第1天开始,每天检查并记录幼虫和蛹的死亡数量,并将死亡个体及时移除,直至未死亡的蛹全部羽化新蜂,记录成功化蛹和羽化新蜂个体数量,统计幼虫化蛹率和羽化率。各组分别取5、6和7日龄幼虫测定抗氧化、免疫、脂质代谢指标及相关基因表达量。饲粮中-亚麻酸的添加水平为0.02%和0.04%时,化蛹率和羽化率显著高于与其他处理组(<0.05),而工蜂幼虫血淋巴中甘油三酯(TG)、总胆固醇(TC)和低密度脂蛋白(LDL)含量显著低于对照组,高密度脂蛋白(HDL)的含量却显著高于对照组(<0.05)。饲粮中-亚麻酸的添加水平为0.04%时,工蜂幼虫超氧化物歧化酶(T-SOD)的活性较对照组显著增加,丙二醛(MDA)的含量显著降低(<0.05)。饲粮中-亚麻酸的添加水平为0.02%、0.04%和0.06%时,6日龄工蜂幼虫的溶菌酶(lysozyme)和酚氧化酶(PO)活性显著高于对照组(<0.05)。饲粮中-亚麻酸添加水平为0.04%时,6日龄工蜂幼虫脂肪酸合成酶(FAS)和乙酰辅酶A羧化酶(ACC)活性显著低于对照组(<0.05)。饲粮中-亚麻酸添加水平为0.04%时,5和7日龄工蜂幼虫和相对表达量显著高于对照组,但饲粮中-亚麻酸添加水平为0.08%时,相对表达量会显著降低(<0.05)。-亚麻酸对意大利蜜蜂工蜂幼虫抗氧化活性和免疫能力有一定影响,幼虫饲粮中-亚麻酸适宜添加水平为0.02%—0.04%。
意大利蜜蜂;工蜂;-亚麻酸;添加水平;抗氧化活性;免疫
0 引言
【研究意义】脂肪酸是细胞膜的主要成分,对细胞膜的功能起着重要的作用。脂肪酸也是蜜蜂繁殖和发育所必需的,是蜜蜂冬季能量和脂肪体发育的来源[1]。-亚麻酸是动物体内一种必需的不饱和脂肪酸,它是所有n-3多不饱和脂肪酸的前体物质,在体内可转化为长链的n-3多不饱和脂肪酸DHA和EPA,从而发挥与DHA和EPA相似的生理功能,对机体生长发育和正常代谢起重要作用[2]。-亚麻酸能抑制脂肪酸合成酶、COA-羧化酶、二酰甘油乙酰转移酶和3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methyl glutarylcoenzyme A reductase,HMGR)等活性,并可加强线粒体中的-氧化,减少甘油三酯和胆固醇的合成,从而起到降血脂作用。-亚麻酸通过抑制ω-6系PUFA的代谢,减少前列腺素PGE2、前列腺环素PGI2、血栓素TXA2的合成,从而产生抗炎、抗过敏、抗血栓等作用。蜜蜂幼虫的主要脂肪酸来源是蜂王浆,蜂王浆中-亚麻酸含量极少,而-亚麻酸在体内不能合成,必须从食物中获得,因此探究幼虫饲粮中-亚麻酸适宜添加水平十分必要。【前人研究进展】大量研究表明,与哺乳动物相似,-亚麻酸等ω-3脂肪酸对蜜蜂的认知功能有着至关重要的作用[1],也有研究认为蜜蜂肠道中高浓度的亚麻酸和亚油酸具有抵抗真菌和细菌感染的作用[3]。Arien等[4]研究了-亚麻酸等ω-3脂肪酸缺乏对蜜蜂的营养影响,发现饲喂低-亚麻酸饲粮的蜜蜂嗅觉和触觉联想学习能力明显下降;李兴鹏等[5]研究发现,含有-亚麻酸等不饱和脂肪酸的人工饲料更适合蠋蝽()老龄若虫生长发育,提高成虫获得率和种群增长率;姚思宇等[6]以不同剂量的-亚麻酸给小鼠连续灌胃30—35 d,发现小鼠的抗体生成细胞数和血清溶血素水平显著提高,说明-亚麻酸具有增强小鼠免疫力的作用;朱保忠等[7]研究发现,-亚麻酸具有抗氧化和延长寿命的作用,而且-亚麻酸与抗氧化剂联用能强化这种作用;马兰婷[8]研究表明,代用花粉中-亚麻酸水平能够影响蜜蜂血淋巴中脂质含量、蜂体脂肪酶活性及蜂体相关基因表达水平等,但在代用花粉中添加过高或过低的-亚麻酸都会降低意大利蜜蜂()的寿命。【本研究切入点】目前,关于-亚麻酸对意大利蜜蜂营养作用的研究较少,而其幼虫对-亚麻酸的营养需要量未见报道。【拟解决的关键问题】以人工饲养的意大利蜜蜂工蜂幼虫为研究对象,通过探究幼虫饲粮中不同-亚麻酸水平对其生长发育、抗氧化活性和免疫指标的影响,明确工蜂幼虫对-亚麻酸的适宜需要量,为制定蜜蜂饲养标准提供依据。
1 材料与方法
试验于2018—2019年在山东农业大学动物科技学院完成。
1.1 材料
意大利蜜蜂工蜂幼虫取自山东农业大学试验蜂群。对照组饲粮参照Vandenberg等[9]的配方配制,在基础饲粮中分别添加0.02%、0.04%、0.06%、0.08%的-亚麻酸,制成4种试验组饲粮(表1)。

表1 试验饲粮组成
主要试剂:Total RNA Kit II试剂盒购自OMEGA公司,荧光定量试剂盒购自TransGen公司,Transcript First Strand cDNA Synthesis Kit试剂盒购自Roche公司,昆虫酶联免疫吸附试验(ELISA)试剂盒购自科诺迪生物科技有限公司,-亚麻酸(浓度80%以上)购自江苏天凯生物有限公司。
1.2 试验方法
首先用蜂王隔离器将蜂王固定在一张巢脾上产卵,12 h内产完足够多的卵时,标记产卵区,释放蜂王,经过3 d,工蜂卵孵化为小幼虫,即1日龄幼虫。试验选取1 200只1日龄意大利蜜蜂工蜂幼虫,600只用于幼虫化蛹率和羽化率指标测定,另外600只用于生理生化指标测定。试验幼虫均按单因素随机设计分为5组,每组5个重复,每个重复48只。将1日龄幼虫用移虫针移至温度适宜的加入200 μL饲粮的24孔细胞培养板内,培养板置于恒温培养箱中(温度33℃,相对湿度55%),试验期间每天更换饲粮。饲养至第6天末或第7天初,幼虫开始有直立或排便现象时,将幼虫转移至提前铺好灭菌纸的24孔细胞培养板内准备化蛹,具体饲养方法参照王颖[10]。
1.3 测定指标与方法
1.3.1 化蛹率和羽化率测定 从饲养第1天开始,每天检查并记录幼虫的死亡数量,并将死亡个体及时移除,直至未死亡的幼虫全部化蛹并羽化成新蜂,记录成功化蛹个体数量和羽化新蜂个体数量,统计幼虫化蛹率和羽化率。
1.3.2 粗脂肪含量测定 幼虫粗脂肪含量测定采用王少梅等[11]氯仿-甲醇抽提法。分别取5、7日龄工蜂幼虫样品10只,放在提前烘干称重的称量瓶中,置于65℃恒温干燥箱中12 h,将烘干样品置于10 ml离心管中,加入2 ml氯仿-甲醇(2﹕1)混合液,用全自动样品快速研磨仪匀浆3 min,静置24 h。向离心管中加入2 ml氯仿-甲醇(2﹕1)混合液,3 000 r/min离心10 min,将上清移至另一离心管中,向残渣中加入2 ml氯仿-甲醇(2﹕1)混合液,同样条件离心,将上清转移另一离心管中;向上清离心管中加入1.2 ml 1.6% CaCl2溶液,摇匀,静置1 h,同样条件离心,吸去上层液;将1 ml 2% CaCl2-氯仿-甲醇(3﹕8﹕4)混合液上层液沿壁缓缓加入离心管中,同样条件离心,吸去上层液;下层液转入已烘干称重的称量瓶中,70℃恒温烘干称重,称量瓶两次差值即为粗脂重。
1.3.3 幼虫血淋巴脂质含量测定 采用体积为40 μl的毛细血管吸取7日龄工蜂幼虫血淋巴,用吸耳球将血淋巴吹入已经加有少许苯基硫脲的1.5 ml离心管中,试验过程中离心管放在冰盒上,以防血淋巴被氧化,样品放在-80℃保存。测定时,4℃条件下13 000 r/min离心5 min,取100 μl上清备用,采用日立7020型全自动生化分析仪测定幼虫血淋巴中甘油三酯、胆固醇、高密度脂蛋白和低密度脂蛋白含量。
1.3.4 幼虫抗氧化指标和脂质代谢、免疫相关酶活性测定 每个重复随机选取1只6日龄工蜂幼虫,按1﹕9质量体积比加入一定量生理盐水于2 ml离心管中进行组织匀浆,以配制成10%匀浆液,在4℃条件下,13 000 r/min离心10 min,取100 μl上清备用。采用昆虫酶联免疫吸附试验(ELISA)测定丙二醛(MDA)含量、总超氧化物歧化酶(T-SOD)、乙酰辅酶A羧化酶(ACC)、脂肪酸合成酶(FAS)、酚氧化酶(PO)和溶菌酶(lysozyme)活性。
1.3.5 免疫相关基因表达量的测定 使用Total RNA Kit II试剂盒提取5和7日龄工蜂幼虫总RNA,并用超微量分光光度计检测其浓度和纯度。根据Transcript First Strand cDNA Synthesis Kit试剂盒,将总RNA反转录为cDNA,-20℃保存备用。内参基因选择表达稳定的,委托生工生物工程(上海)股份有限公司完成定量引物的设计与合成,引物信息见表2。按照实时荧光定量试剂盒操作指南,用美国ABI7500系统检测目的基因的相对表达量,反应体系为20 μL。反应条件:94℃30 s;94℃ 5 s,60℃34 s,40个循环。

表2 目的基因引物序列
1.4 数据分析
数据采用SAS 9.2软件进行单因素方差分析(one-way ANOVA)和Turkey检验进行比较分析,<0.05为差异显著,<0.01为差异极显著,试验数据均以“mean±SD”的形式表示。
2 结果
2.1 饲粮α-亚麻酸添加水平对意大利蜜蜂工蜂幼虫化蛹率和羽化率的影响
饲粮中-亚麻酸的添加水平为0.02%和0.04%时,化蛹率和羽化率显著高于其他处理组;-亚麻酸的添加水平为0.06%和0.08%时,化蛹率和羽化率均显著低于对照组(<0.05)(表3)。
2.2 饲粮中α-亚麻酸添加水平对7日龄意大利蜜蜂工蜂幼虫血淋巴生化指标的影响
饲粮中-亚麻酸添加水平为0.04%时,血淋巴中总蛋白(total protein,TP)含量显著低于对照组,而饲粮中添加-亚麻酸会显著降低工蜂幼虫血淋巴中甘油三酯(triglyceride,TG)和总胆固醇(total cholesterol,TC)的含量(<0.05)。与对照组相比,饲粮中-亚麻酸添加水平为0.02%、0.04%和0.06%时,高密度脂蛋白(high density lipoprotein,HDL)的含量显著升高,而低密度脂蛋白(low density lipoprotein,LDL)的含量显著降低(<0.05)(表4)。

表3 饲粮中α-亚麻酸添加水平对工蜂幼虫化蛹率和羽化率的影响
同行数据后不同小写字母表示差异显著(<0.05)。下同
Data with different lowercases in the same row indicate significant difference (<0.05). The same as below

表4 饲粮中α-亚麻酸添加水平对工蜂幼虫血淋巴生化指标的影响
2.3 饲粮中α-亚麻酸添加水平对5、7日龄意大利蜜蜂工蜂幼虫粗脂含量的影响
-亚麻酸添加水平为0.02%、0.06%和0.08%时,5日龄工蜂幼虫虫体粗脂含量显著高于对照组;-亚麻酸添加水平为0.06%和0.08%时,7日龄工蜂幼虫虫体粗脂含量显著高于对照组(<0.05)(表5)。
2.4 饲粮中α-亚麻酸添加水平对6日龄意大利蜜蜂工蜂幼虫抗氧化指标的影响
与对照组相比,当饲粮中-亚麻酸添加水平为0.02%和0.04%时,6日龄工蜂幼虫的丙二醛(MDA)含量显著降低(<0.05)(图1-A);饲粮中-亚麻酸添加水平为0.04%时,6日龄工蜂幼虫超氧化物歧化酶(SOD)活性显著高于对照组(<0.05)(图1-B)。

表5 饲粮中α-亚麻酸添加水平对工蜂幼虫粗脂含量的影响(干基,%)

柱上不同小写字母表示差异显著(P<0.05)。下同Different lowercases on the bars indicate significant difference (P<0.05). The same as below
2.5 饲粮中α-亚麻酸添加水平对意大利蜜蜂工蜂幼虫脂质代谢相关酶活性的影响
饲粮中-亚麻酸添加水平为0.02%和0.04%时,意大利蜜蜂工蜂幼虫体内乙酰辅酶A羧化酶(ACC)活性显著低于对照组(<0.05)(图2-A)。饲粮中-亚麻酸添加水平为0.02%时,工蜂幼虫体内脂肪酸合成酶(FAS)活性与对照组无显著差异(>0.05),但添加水平为0.04%、0.06%和0.08%时,FAS活性显著低于对照组(<0.05)(图2-B)。
2.6 饲粮中α-亚麻酸添加水平对意大利蜜蜂工蜂幼虫免疫能力的影响
饲粮中-亚麻酸添加水平为0.02%、0.04%和0.06%时,6日龄工蜂幼虫的溶菌酶(lysozyme)和酚氧化酶(PO)活性显著高于对照组(<0.05)(图3)。
饲粮中-亚麻酸添加水平为0.02%和0.04%时,5日龄工蜂幼虫和相对表达量显著高于对照组(<0.05),但当饲粮中-亚麻酸添加水平为0.06%和0.08%时,相对表达量会明显降低(图4-A)。与对照组相比,当饲粮中-亚麻酸添加水平为0.04%和0.06%时,7日龄工蜂幼虫和相对表达量显著增加,而当饲粮中-亚麻酸添加水平为0.08%时,e和相对表达量却显著降低(<0.05)(图4-B)。

图2 饲粮中α-亚麻酸添加水平对6日龄工蜂幼虫脂质代谢相关酶活性的影响

图3 6日龄工蜂幼虫溶菌酶和酚氧化酶活性
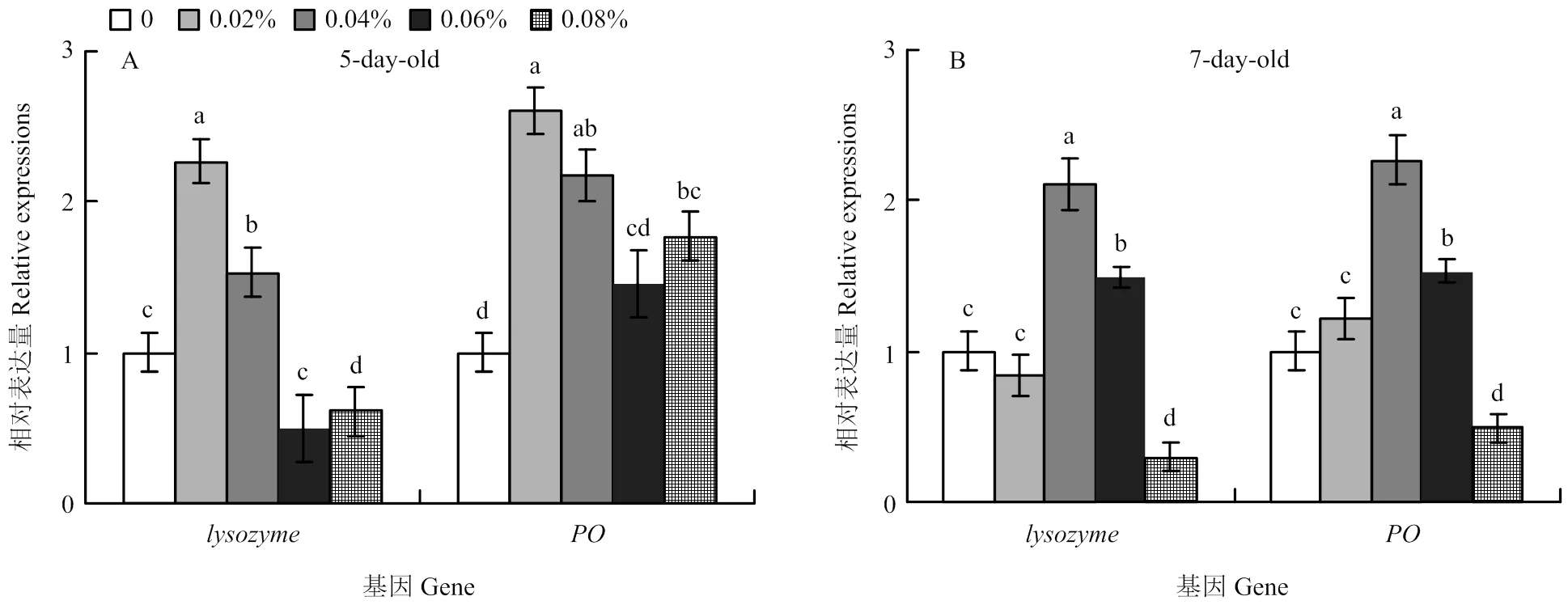
图4 酚氧化酶和溶菌酶基因相对表达量
3 讨论
3.1 饲粮中α-亚麻酸添加水平对意大利蜜蜂工蜂幼虫化蛹率和羽化率的影响
-亚麻酸作为n-3系列不饱和脂肪酸,对昆虫尤其蜜蜂生长性能的研究极少,但在畜禽上的研究较多。潘瑜等[12]研究表明,随着亚麻油替代鱼油水平的升高,鲤鱼生长性能呈现出先升高而后降低的趋势。也有大量研究表明,添加一定量的亚麻油对肉鸡和蛋鸡的生产性能无显著影响[13-15]。杜海涛等[16]研究表明,低水平的-亚麻酸添加量对肉兔生长性能影响不显著,而高水平的-亚麻酸添加量显著降低肉兔的生长性能。本试验表明,低水平的-亚麻酸添加量对意大利蜜蜂工蜂幼虫的化蛹率和羽化率无显著影响,而当饲粮中-亚麻酸添加水平达到0.06%时会显著降低幼虫的化蛹率和羽化率。李兴鹏等[5]采用两种分别添加棕榈油和亚麻酸的饲料饲喂蠋蝽,发现取食添加亚麻酸饲料的蠋蝽老龄幼虫的死亡率显著降低,成虫羽化率和雌雄成虫体重日均增长率亦显著高于取食棕榈油饲料的蠋蝽,而添加棕榈酸的饲料更适合低龄若虫。由此可见,-亚麻酸对畜禽乃至蜜蜂生长性能的影响仍存在争议,这可能与-亚麻酸的添加量和动物物种及其所处的生理阶段有关。
3.2 饲粮中α-亚麻酸添加水平对意大利蜜蜂工蜂幼虫脂质代谢的影响
3.2.1 对7日龄工蜂幼虫血淋巴生化指标的影响 昆虫血淋巴是血细胞、间质液和血浆的混合物,为昆虫新陈代谢中物质交换与储存的场所,在免疫、创伤、愈合、防御等方面有着重要作用[17]。总胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白含量是临床上用来反映血脂代谢功能的常用指标[18]。-亚麻酸可以降低肝脏胆固醇合成过程中的关键酶3-羟基-3-甲基戊二酰辅酶A还原酶的活性,从而降低肝脏胆固醇的合成量,同时也能增加血液高密度脂蛋白含量[19-20]。大量动物试验和临床试验表明,多不饱和脂肪酸(PUFA)可以降低甘油三酯、胆固醇和低密度脂蛋白水平,升高高密度脂蛋白水平。许继取[21]研究表明,增加-亚麻酸摄入的高脂饮食的大鼠血浆中甘油三酯、血浆总胆固醇水平均明显降低;MEDEIROS等[22]证明-亚麻酸可显著降低血清总胆固醇、甘油三酯、低密度脂蛋白胆固醇(LDL-C)水平;姚林杰等[18]研究表明,饲料中添加1.08%-亚麻酸能显著降低团头鲂血清总胆固醇和甘油三酯含量,而高密度脂蛋白含量则显著升高。
本研究表明,饲粮中添加-亚麻酸显著降低意大利蜜蜂工蜂幼虫血淋巴甘油三酯和总胆固醇的含量,0.02%和0.04%组总胆固醇含量显著低于其他试验组,-亚麻酸添加水平为0.02%、0.04%和0.06%时会显著降低低密度脂蛋白含量,升高高密度脂蛋白的含量,0.04%组低密度脂蛋白含量显著低于其他试验组,而高密度脂蛋白的含量显著高于其他组,这与上述研究结果相吻合,说明在适宜的添加量下,-亚麻酸具有降血脂的作用。
3.2.2 对6日龄工蜂幼虫脂质代谢相关酶活性的影响-亚麻酸作为结构物质和代谢调控物质,发挥着重要的生理作用,而-亚麻酸的某些生理作用是通过调节相关酶的活性来实现的。-亚麻酸的降血脂作用一方面是通过对代谢率的调节来实现,另一方面则是通过抑制有关脂肪和甘油合成酶系来实现的。Mersmann等[23]通过在成年猪饲料中添加脂肪酸的研究发现,PUFA对脂肪酸的合成速度以及FAS和ACC的活性具有抑制作用;Toussant等[24]分别用富含PUFA和饱和脂肪酸的饲粮饲喂大鼠,结果发现饲喂富含PUFA饲粮的大鼠肝脏FAS和ACC活性显著低于饲喂富含饱和脂肪酸饲粮的大鼠;Blake等[25]研究发现,饲喂PUFA的大鼠肝脏中FAS mRNA丰度是饲喂饱和脂肪酸大鼠的6%。
大量的研究结果表明,PUFA对脂肪合成酶系有抑制作用,这与本试验结果相一致,饲粮中-亚麻酸添加水平为0.04%时,会显著抑制FAS和ACC的活性,从而起到降血脂的作用。
3.3 饲粮中α-亚麻酸添加水平对意大利蜜蜂工蜂幼虫抗氧化能力的影响
自由基通过其强氧化作用对核酸进行氧化和交联,使DNA发生断裂、突变,对机体的抗氧化系统和大分子产生损伤,损伤的积累导致细胞衰老或死亡[7]。超氧化物歧化酶(SOD)是生物体内重要的抗氧化酶,它能清除超氧阴离子自由基,对抗与阻断因氧自由基对细胞造成的损害,并及时修复受损细胞,是体内抗氧化能力的总体体现。丙二醛(MDA)是膜脂过氧化的重要产物,其含量间接地反映机体细胞受自由基攻击的严重程度[26]。葛双双等[27]研究表明,余甘子核仁油具有较强的抗氧化作用,而其主要的抗氧化活性物质为-亚麻酸,随着余甘子核仁油-亚麻酸浓度的升高,对DPPH自由基和ABTS+·清除率也逐渐增大,抗氧化能力也逐渐增强;朱保忠等[7]研究表明,-亚麻酸能显著提高动物血清SOD、谷胱甘肽过氧化物酶水平,降低MDA含量,提高动物抗自由基能力并延长寿命;张利华等[28]研究表明,饮食补充-亚麻酸可显著增加糖尿病大鼠SOD和CAT活性,降低MDA含量,提高糖尿病大鼠的抗氧化能力。本研究表明,当-亚麻酸添加水平为0.02%和0.04%时显著降低工蜂幼虫MDA含量,而0.04%水平-亚麻酸能显著增加SOD的活性。这与上述报道一致,说明饲粮中添加适宜的-亚麻酸能够显著提高幼虫的抗氧化能力。
3.4 饲粮中α-亚麻酸添加水平对意大利蜜蜂工蜂幼虫免疫能力的影响
蜜蜂血细胞总数被认为是间接衡量细胞免疫能力的指标[29],血细胞数目与包囊反应、酚氧化酶活力和拟寄生抗性具有正相关性,一般认为,血细胞数目减少是免疫能力降低的体现[30-32]。体液免疫会激活信号通路引起抗菌肽(antimicrobial peptide)和溶菌酶的合成,并激发酚氧化酶原级联系统,它们能协同作用阻挡或杀死入侵微生物[33]。姚思宇等[6]研究表明,-亚麻酸能明显促进小鼠的单核-巨噬细胞和腹腔巨噬细胞的吞噬能力,提高小鼠NK细胞的活性,最终能增强小鼠的免疫力;双金等[34]研究表明,奶牛日粮中添加富含-亚麻酸的添加剂可明显改善或增强奶牛的体液免疫和细胞免疫功能;Lessard等[35]通过分别饲喂奶牛富含n-6和n-3多不饱和脂肪酸的日粮,发现喂食富含n-3 PUFA饲粮的奶牛与喂食富含n-6 PUFA饲粮的奶牛相比,淋巴细胞增殖反应显著增强。溶菌酶是巨噬细胞活化时释放的一种水解酶C,可水解溶壁微球菌、巨大芽孢杆菌及黄色八叠球菌等革兰氏阳性菌细胞壁上的糖苷键,使细菌溶解,溶菌酶含量可以评价动物机体的免疫状态。陈士勇等[36]研究表明,日粮中添加PUFA可以改善产蛋鸡体液免疫水平,提高抗体效价,但摄入过高的PUFA会显著降低产蛋鸡溶菌酶含量,从而降低了机体免疫反应。添加过高或过低的不饱和脂肪酸都会使免疫功能有所下降,只有适量的供给才能提高机体的免疫功能。
本研究表明,当饲粮中-亚麻酸的添加水平为0.02%、0.04%和0.06%时,可以显著提高幼虫溶菌酶和酚氧化酶活性。0.02%添加水平的-亚麻酸饲粮可以显著提高5日龄幼虫和相对表达量,而0.04%添加水平的-亚麻酸饲粮可以提高7日龄幼虫和相对表达量,但当饲粮中-亚麻酸添加水平为0.08%时,和相对表达量却显著降低。由此可以说明,适宜的-亚麻酸可以增强蜜蜂的免疫力,但如果添加量过高则会造成蜜蜂的免疫力下降。
4 结论
意大利蜜蜂工蜂幼虫饲粮中-亚麻酸添加水平对幼虫的化蛹率、羽化率以及抗氧化、免疫能力和脂质代谢均有一定程度的影响;意大利蜜蜂工蜂幼虫饲粮中-亚麻酸的添加水平为0.02%—0.04%时,幼虫的化蛹率和羽化率有所提高,且有利于增加其抗氧化和免疫能力,为较为适宜的-亚麻酸添加水平。
[1] MANNING R. Fatty acids in pollen: a review of their importance for honey bees., 2001, 82(2): 60-75.
[2] 吴俏槿, 杜冰, 蔡尤林, 梁钻好, 林志光, 邱国亮, 董立军.-亚麻酸的生理功能及开发研究进展. 食品工业科技, 2016, 37(10): 386-390.
WU Q J, DU B, CAI Y L, LIANG Z H, LIN Z G, QIU G L, DONG L J. Research development of alpha-linolenic acid., 2016, 37(10): 386-390. (in Chinese)
[3] FELDLAUFER M F, KNOX D A, LUSBY W R, SHIMANUKI H. Antimicrobial activity of fatty acids against, the causative agent of American foulbrood disease., 1993, 24: 95-99.
[4] ARIEN Y, DAG A, ZARCHIN S, MASCI T, SHAFIR S. Omega-3 deficiency impairs honey bee learning., 2015, 112(51): 15761-15766.
[5] 李兴鹏, 宋丽文, 陈越渠, 李亚男, 左彤彤, 武三安. 不同脂肪源人工饲料对蠋蝽生长发育及生殖力的影响. 林业科学, 2018, 54(6): 85-93.
LI X P, SONG L W, CHEN Y Q, LI Y N, ZUO T T, WU S A. Influence of different fatty acids in artificial diets on growth, development and fecundity of., 2018, 54(6): 85-93. (in Chinese)
[6] 姚思宇, 赵鹏, 李彬, 李风文, 马宇燕, 覃辉艳, 张陆娟, 苏爱荣, 梁慧莉.-亚麻酸对小鼠免疫功能影响的实验研究. 中国热带医学, 2007, 7(3): 334-349.
YAO S Y, ZHAO P, LI B, LI F W, MA Y Y, QIN H Y, ZHANG L J, SU A R, LIANG H L. Experimental study on the effect of linolenic acid on enhancement of mice’s immune function., 2007, 7(3): 334-349. (in Chinese)
[7] 朱保忠, 李琳.-亚麻酸与抗氧化剂联用对果蝇寿命及小鼠抗氧化能力的影响. 中国组织工程研究与临床康复, 2008, 12(7): 1264-1267.
ZHU B Z, LI L. Influence of alpha-linoleic acid plus anti-oxidant agent on drosophila life and mouse antioxidation ability., 2008, 12(7): 1264-1267. (in Chinese)
[8] 马兰婷. 代用花粉中-亚麻酸水平对蜜蜂采食量、群势及脂质代谢的影响[D]. 泰安: 山东农业大学, 2013.
MA L T. Effect of dietary-linolenic acid level on intake, colony development and lipid metabolism of honey bee (L.)[D]. Taian: Shandong agricultural university, 2013. (in Chinese)
[9] VANDENBERG J D, SHIMANNUKI H. Technique for rearing worker honeybees in the laboratory., 1987, 26(2): 90-97.
[10] 王颖. 营养和空间因素对蜜蜂级型分化的影响[D]. 泰安: 山东农业大学, 2015.
WANG Y. Effects of nutritional factors and living space on the caste determination of honey bees[D]. Taian: Shandong agricultural university, 2015. (in Chinese)
[11] 王少梅, 陈少莲, 崔奕波.用氯仿-甲醇抽提法测定鱼体脂肪含量的研究. 水生生物学报, 1993, 17(2): 193-196.
WANG S M, CHEN S L, CUI Y B. Study on the procedures of chloroform-methanol extraction for the determination of lipid content of fish samples., 1993, 17(2): 193-196. (in Chinese)
[12] 潘瑜, 陈文燕, 林仕梅, 高启平, 罗莉. 亚麻油替代鱼油对鲤鱼生长性能、肝胰脏脂质代谢及抗氧化能力的影响. 动物营养学报, 2014, 26(2): 420-426.
PAN Y, CHEN W Y, LIN S M, GAO Q P, LUO L. Effect of replacement of fish oil by linseed oil on growth performance, lipid metabolism and antioxidant ability in hepatopancreas of common carp () ., 2014, 26(2): 420-426. (in Chinese)
[13] 刘利晓. 富含n-3多不饱和脂肪酸鸡肉的研究[D]. 武汉: 华中农业大学, 2007.
LIU L X. Study on producing of chicken meat enriched in n-3 polyunsaturated fatty acids[D]. Wuhan: Huazhong agricultural university, 2007. (in Chinese)
[14] 汪鲲. n-3多不饱和脂肪酸在蛋黄和组织中的富集规律及其对产蛋鸡脂类代谢的影响[D]. 北京: 中国农业科学院, 2000.
WANG K. Enrichment of n-3 polyunsaturated fatty acid in egg yolk and tissue and its effect on lipid metabolism of laying hens[D]. Beijing: Chinese academy of agricultural sciences, 2000. (in Chinese)
[15] LOPEZ-Ferrer S, BAUCELLS M D, BARROETA A C, GALOBART J, GRASHORN M A. n-3 enrichment of chicken meat. 2. Use of precursors of long-chain polyunsaturated fatty acids: Linseed oil., 2001, 80(6): 753-761.
[16] 杜海涛, 王春阳, 王雪鹏, 麻名文, 李福昌. 日粮-亚麻酸水平对断奶至2月龄肉兔生长性能、脂肪酸构成及肝脏相关基因mRNA表达的影响. 畜牧兽医学报, 2011, 42(5): 671-678.
DU H T, WANG C Y, WANG X P, MA M W, LI F C. Effect of-linolenic acid in diets on growth performance, fatty acids composition of tissues andl mRNA expression of liver related genes in weaned to 2-month-old rabbits., 2011, 42(5): 671-678. (in Chinese)
[17] 张月月, 马振刚. 一种高效收集蜜蜂血淋巴的新方法. 中国蜂业, 2017, 68(6): 64.
ZHANG Y Y, MA Z G. A new method for efficient collection of haemolymph of bees., 2017, 68(6): 64. (in Chinese)
[18] 姚林杰, 叶元土, 蔡春芳, 许凡, 刘猛, 刘汉超, 董娇娇, 陈科全, 黄雨薇.团头鲂幼鱼饲料中-亚麻酸、亚油酸的适宜含量. 动物营养学报, 2015, 27(3): 766-774.
YAO L J, YE Y T, CAI C F, Xu F, LIU M, LIU H C, DONG J J, CHEN K Q, HUANG Y W. Optimal dietary-linolenic acid and linoleic acid contents of blunt snout bream () fingerlings., 2015, 27(3): 766-774. (in Chinese)
[19] SANGIOVANNI J P, CHEW E Y. The role of omega-3 long-chain polyunsaturated fatty acids in health and disease of the retina., 2005, 24(1): 87-138. (in Chinese)
[20] 双金, 黎明, 敖力格日玛, 侯先志, 闫素梅. 亚麻籽对肉羊血清脂蛋白和脂肪代谢相关生化指标的影响. 动物营养学报, 2014, 26(4): 918-929.
SHUANG J, LI M, AO L, HOU X Z, YAN S M. Effects of flaxseed on serum biochemical indices related to lipoprotein and fat metabolism of meat sheep., 2014, 26(4): 918-929. (in Chinese)
[21] 许继取. 亚麻酸对高脂大鼠血脂影响及促进肝脏SR-BI表达机制研究[D]. 武汉: 华中科技大学, 2006.
Xu J Q. Effect of-linolenic acid on plasma lipid of rats with high fat diet and mechanism of increasing hepatocyte SR-BI expression[D]. Wuhan: Huazhong university of science and technology, 2006. (in Chinese)
[22] MEDEIROS D M, HAMPTON M, KURTZER K, PARELMAN M, AL-TAMIMI E, DROUILLARD J S. Feeding enriched omega-3 fatty acid beef to rats increases omega-3 fatty acid content of heart and liver membranes and decreases serum vascular cell adhesion molecule-1 and cholesterol levels., 2007, 27(5): 295-299.
[23] MERSMANN H J, HOUK J M, PHINNEY G, UNDERWOOD M C, BROWN L J. Lipogenesis byliver and adipose tissue preparations from neonatal swine., 1973, 224(5): 1123-1129.
[24] TOUSSANT M J, WILSON M D, CLARKE S D. Coordinate suppression of liver acetyl-CoA carboxylase and fatty acid synthetase by polyunsaturated fat., 1981, 111(1): 146-153.
[25] BLAKE W L, CLARKE S D. Suppression of rat hepatic fatty acid synthase and S14gene transcription by dietary polyunsaturated fat., 1990, 120(12): 1727-1729.
[26] ZHANG L D, LI H C, CHONG T, GAO M, YIN J, FU D L, DENG Q, WANG Z M. Prepubertal exposure to genistein alleviates Di-(2-ethylhexyl) phthalate induced testicular oxidative stress in adult rats., 2014, 2014: Article ID 598630.
[27] 葛双双, 张雯雯, 李坤, 徐涓, 刘兰香, 郑华, 张弘. 余甘子核仁油的体外抗氧化活性及其作用机理. 食品科学, 2017, 38(15): 127-134.
GE S S, ZHANG W W, LI K, XU J, LIU L X, ZHENG H, ZHANG H. antioxidant activity and mechanismofL. seed oil., 2017, 38(15): 127-134. (in Chinese)
[28] 张利华, 张薇, 韦广洪, 杨沛, 刘军, 牛晓琳.-亚麻酸对糖尿病大鼠炎症介质和氧化应激的影响. 中国应用生理学杂志, 2012, 28(1): 64-67.
ZHANG L H, ZHANG W, WEI G H, YANG P, LIU J, NIU X L. Effect of alpha-linolenic acid on inflammation and oxidative stress in diabetic rats., 2012, 28(1): 64-67. (in Chinese)
[29] WILSON K, COTTER S C, REESON A F, PELL J K. Melanism and disease resistance in insects., 2001, 4(6): 637-649.
[30] RANTALA M J, KOSKIMAKI J, TASKINEN J, TYNKKYNEN K, SUHONEN J. Immunocompetence, developmental stability and wingspot size in the damselflyL.:, 2000, 267(1460): 2453-2457.
[31] COTTER S C, KRUUK L E B, WILSON K. Costs of resistance: genetic correlations and potential trade-offs in an insect immune system., 2004, 17(2): 421-429.
[32] KRAAIJEVELD A R, LIMENTANI E C, GODFRAY H C. Basis of the trade-off between parasitoid resistance and larval competitive ability in.:, 2001, 268(1464): 259-261.
[33] BEDICK J C, TUNAZ H, NOR ALIZA A R, PUTNAM S M, ELLIS M D, STANLEY D W. Eicosanoids act in nodulation reactions to bacterial infections in newly emerged adult honey bees,, but not in older foragers.:, 2001, 130(1): 107-117.
[34] 双金, 金曙光, 包鹏云, 杨爱军, 嘎尔迪. 探讨富含-亚麻酸的添加剂对奶牛脂肪代谢及免疫功能的影响. 黑龙江畜牧兽医, 2004(11): 16-18.
SHUANG J, JIN S G, BAO P Y, YANG A J, Ga R D. Investigation of the effects of alpha-linolenic acid-rich additives on fat metabolism and immune function of dairy cows., 2004(11): 16-18. (in Chinese)
[35] LESSARD M , GAGNON N, GODSON D L, PETIT H V. Influence of parturition and diets enriched in n-3 or n-6 polyunsaturated fatty acids on immune response of dairy cows during the transition period., 2004, 87(7): 2197-2210.
[36] 陈士勇, 呙于明, 夏兆刚, 袁建敏.不同类型多不饱和脂肪酸对产蛋鸡免疫功能及肝脏脂质过氧化的影响. 营养学报, 2003, 25(4): 383-388.
CHEN S Y, guO Y M, XIA Z G, YUAN J M. Effects of different types of polyunsaturated fatty acids on humoral immune function and hepatic lipid peroxidation of laying hens., 2003, 25(4): 383-388. (in Chinese)
Effect of dietary-linolenic acid levels on physiological function ofworker Bee larvae
YU Jing, ZHANG WeiXing, MA LanTing, xu baoHua
(College of Animal Science and Technology, Shandong Agricultural University, Taian 271018, Shandong)
】The objective of this study is to explore the effect of dietary-linolenic acid levels on the antioxidant activity and immunity ofworker bee larvae.【】Twelve hundreds 1-day-old worker bee larvae were randomly divided into 5 group, with 5 replicates in each group and 48 worker bee larvae in each replicate. The control group was fed with basic diets without-linolenic acid, and the 4 treatment groups were fed experimental diets containing different amounts of-linolenic acid (0.02%, 0.04%, 0.06%, and 0.08%). According to the indoor feedingmethod, the 1-day-old worker bee larvae were moved to a 24-well cell culture plate with 200 μL diet at suitable temperature. The larvae were moved by worm-moving needle. The culture plate was placed in a constant temperature incubator (temperature 33℃, relative humidity 55%), the diet was changed daily during the test. Feeding until the end of the 6th day or the beginning of the 7th day, when the larvae started to stand upright or defecate, the larvae were moved to the 24-well cell culture plate covered with sterilized paper in advance to prepare for pupation. From the 1st day of feeding, the death number of larvae and pupae was checked and recorded every day, and the dead individuals were removed in time until all adult emerged. The number of undead pupae and emergence new bees was recorded, and pupation rate and emergence rate were calculated. The 5-, 6- and 7-day-old worker bee larvae were used to measure antioxidant, immune, lipid metabolism indexes and related gene expression.【】 When the addition level of-linolenic acid in the diet was 0.02% and 0.04%, the pupation rate and emergence rate were significantly higher than those in other treatment groups (<0.05), while the contents of triglyceride (TG), total cholesterol (TC) and low density lipoprotein (LDL) in the hemolymph of worker bee larvae were significantly lower than those of the control group, the content of high density lipoprotein (HDL) was significantly higher than that of the control group (<0.05). Compared with the control group, the activity of superoxide dismutase (SOD) was significantly increased, while the content of malondialdehyde (MDA) was significantly decreased when the addition level of-linolenic acid was 0.04% (<0.05). When the addition level of-linolenic acid was 0.02%, 0.04% and 0.06%, the activities of lysozyme and phenoloxidase (PO) of 6-day-old worker bee larvae were significantly higher than those in the control group (<0.05). When the addition level of-linolenic acid was 0.04%, the activities of fatty acid synthase (FAS) and acetyl CoA carboxylase (ACC) of 6-day-old worker bee larvae were significantly lower than those in the control group (<0.05). When the addition level of-linolenic acid was 0.04%, the relative expression levels ofandof 5- and 7-day-old worker bee larvae were significantly higher than those in the control group, but when the addition level of-linolenic acid was 0.08%, the relative expression level ofwas significantly decreased (<0.05). 【】Different dietary supplementation levels of-linolenic acid have significant effects on antioxidant activity and immunity ofworker bee larvae, and the appropriate addition level of-linolenic acid in larval diet is 0.02%-0.04%.
; worker bee;-linolenic acid; addition level; antioxidant activity; immunity
10.3864/j.issn.0578-1752.2019.13.015
2019-03-07;
2019-03-27
国家蜂产业技术体系建设专项资金(CARS-44)、山东省农业良种工程(南种北繁)(2017LZN006)、山东省“双一流”学科建设经费(2016-2020)
于静,E-mail:1391031996@qq.com。
胥保华,E-mail:bhxu@sdau.edu.cn
(责任编辑 岳梅)
