骨架蛋白降解对冰鲜草鱼质构的影响
2019-07-20贾胜男臧金红夏文水姜启兴许艳顺于沛沛
贾胜男,杨 方,2,*,臧金红,夏文水,*,姜启兴,许艳顺,于沛沛
(1.江南大学食品学院,食品科学与技术国家重点实验室,江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122 ;2.徐州一统食品工业有限公司江苏省博士后创新实践基地,江苏 徐州 221004 )
我国是淡水渔业大国,淡水养殖鱼类产量丰富;草鱼是我国养殖产量最大的鱼种[1]。目前,国内淡水鱼市场仍以鲜销为主,加工比例低,成品或半成品种类较少,这成为制约我国淡水渔业健康可持续发展的技术瓶颈[2]。虽然海水产品的冷链销售初具规模,但由于淡水鱼肉质细嫩、水分含量高,与海水产品的组成成分、结构特点和生化特性不同,淡水鱼更易于腐败变质,冷鲜销售仍存在技术难题亟待解决,开发切实有效的保鲜技术对淡水鱼行业发展尤为重要[3]。现阶段应用较广的食品保鲜技术有冷冻、冷藏、冰藏等。冷冻会导致冰晶的产生进而破坏细胞结构,解冻过程中汁液流失严重,影响鱼肉品质[4];冷藏条件下,冰点以上的温度对微生物和酶活力抑制效果有限,鱼肉较易腐败变质,使货架期短[5]。冰藏条件下,冰晶产生少,减少了冷冻对细胞结构的破坏;冰藏温度比冷藏条件低,对微生物及酶活力的抑制效果更明显,具有较广阔的市场前景[6-7]。
冰藏相对于冷冻、冷藏等保鲜技术虽有一定优势,但冰藏条件下鱼肉质构劣化现象仍然存在。现有的对引起鱼肉质构劣化的肌原纤维蛋白的研究主要集中在较小分子质量肌球蛋白重链(220 kDa)、肌动蛋白(44 kDa)的降解上,而忽略了对细胞起支撑和链接作用的大分子质量的骨架蛋白[8]。在畜禽体系中,骨架蛋白的降解会使肌纤维解离及细胞结构坍塌,从而导致持水力、剪切力下降[9];但鱼肉纤维结构和蛋白特性与畜禽肉有本质区别,无法将畜禽肉的知识作简单的平行移动;因此鱼肉体系中,骨架蛋白降解如何影响质构还有待研究。目前普遍采用聚丙烯酰胺凝胶电泳和免疫印迹技术对蛋白进行分析;但针对大分子蛋白的检测,聚丙烯酰胺凝胶电泳技术检测结果缺少大分质子量蛋白的Marker标记,免疫印迹技术主要应用于分子质量较小蛋白的测定,两种实验方法都不是对大分子骨架蛋白进行表征的最合适的方法[10-11]。已有研究通过免疫组化技术对骨架大蛋白进行半定量分析,可以清晰观察目的蛋白的表达及分布[12-13]。
因此,本实验以草鱼作为研究对象,利用免疫组化技术特异性表征冰藏过程中骨架蛋白(伴肌球蛋白、伴肌动蛋白、抗肌营养不良蛋白)的降解情况,结合肌纤维结构、剪切力和滴水损失率等指标的分析,以期阐明冰鲜草鱼质构劣化的原因,从而为调控冰鲜淡水鱼的质构品质提供理论依据。
1 材料与方法
1.1 材料与试剂
实验用草鱼7 尾,2017年5月中旬购于无锡市滨湖区华润万家超市,草鱼体质量为(5.0±0.5)kg,体质健康、规格整齐。
伴肌球蛋白抗体、伴肌动蛋白抗体、抗肌营养不良蛋白抗体、山羊抗小鼠IgG(H+L) 美国Proteintech公司;氯化钠、三氯乙酸(trichloroacetic acid solution,TCA)、十二烷基硫酸钠(sodium dodecyl s ulfate,SDS)、甘氨酸等均为国产分析纯。
1.2 仪器与设备
3K-30型高速冷冻离心机 德国Sigma公司;FE20K型pH计 瑞士Mettler Toledo仪器有限公司;TA-XT2i型物性分析仪 英国Stable Micro Systems公司;UV-1000紫外-可见分光光度计 上海天美科学仪器有限公司;T18高速分散机 德国IKA公司;石蜡包埋机、石蜡切片机、Olympus BH-2生物显微镜、H-7500透射电子显微镜 徕卡显微系统(上海)贸易有限公司。
1.3 方法
1.3.1 实验设计
将草鱼剖杀,去头和内脏,用预冷的自来水冲洗干净,取背部白色肌肉,切成2 cm×2 cm×2 cm块状,并随机放置于多聚乙烯袋中,封口。将包装好的草鱼块样品放入装有碎冰的塑料泡沫箱,并将其放入4 ℃冰箱中。在贮藏过程中,定时更换碎冰,确保贮藏温度在(0.0±0.5)℃范围内。分别在第0、1、3、7、10、14、21天时取样,对冰藏过程中鱼肉骨架蛋白(伴肌球蛋白、伴肌动蛋白、抗肌营养不良蛋白)的降解及超微结构、剪切力、滴水损失率的变化进行测定分析。
1.3.2 免疫组化分析
将鱼肉从放满冰的泡沫箱中取出,用手术刀将鱼肉块切成10 mm×10 mm×3 mm的薄片;用体积分数3%戊二醛溶液(由0.1 mol/L pH 7.4的磷酸盐缓冲液配制)固定24 h;用不含戊二醛的相同磷酸盐缓冲液漂洗5 次,每次15 min;采用体积分数30%、50%、70%、80%、90%、95%、95%、100%乙醇分别梯度脱水2 h;分别采用体积分数50%二甲苯、50%乙醇、100%二甲苯、100%二甲苯按顺序各浸泡2 h。以上操作均在4 ℃条件下完成。然后在体积分数50%二甲苯、50%石蜡的混合体系中浸泡2 h后,用体积分数100%石蜡浸泡3 次,每次各2 h,在60 ℃下完成浸蜡操作。将蜡块固定于切片机上进行切片,切片厚度为6 µm。
参照Cruz-Rico等[14]的方法对切片进行免疫组化分析。取1 500 mL柠檬酸三钠溶液(0.01 mol/L、pH 6.0)于压力锅中,大火加热直至沸腾;将脱蜡水化后的组织切片置于耐高温塑料切片架上,浸入已沸腾的缓冲液中,热蒸汽修复20 min,自然冷却至室温;使用磷酸盐缓冲液(0.01 mol/L、pH 7.4)清洗3 次,每次5 min;使用免疫组化油性笔,圈出组织样本位置;用5 g/100 mL脱脂奶粉溶液封闭30 min;吸去多余的封闭液,滴加稀释的一抗溶液(空白对照组以0.01 mol/L pH 7.4磷酸盐缓冲液替代抗体),将含有抗体的湿盒在4 ℃冰箱孵育过夜。第2天将湿盒从冰箱拿出,室温放置15 min复温;用磷酸盐缓冲液(0.01 mol/L、pH 7.4)清洗5 次,每次5 min;吸去多余的磷酸盐缓冲液,滴加第二抗体,室温孵育30 min;再次使用磷酸盐缓冲液(0.01 mol/L、pH 7.4)清洗5 次,每次5 min,免疫组化显色;随后苏木素复染;梯度乙醇脱水,二甲苯透明,中性树胶封片。
采用BH-2生物显微镜观察拍照:先用肉眼观察选取染色均匀、无气泡、无断裂、形状完整的切片;然后在低倍镜下观察,找到厚度适宜、均匀平展、无污染的样品优质区后,用高倍镜观察;当发现了重点目标时,进行拍照。显色部分为目的蛋白的表达区。
使用IPP软件对免疫组化图片进行光密度灰度(integrated option density,IOD)分析,并按式(1)计算各个骨架蛋白的降解率。

式中:A为冰藏前IOD;B为冰藏后IOD。
1.3.3 超微结构观察
超微结构观察参照Ullah等[15]的方法并加以改进。将鱼肉从放满冰的泡沫箱中取出,用手术刀将鱼肉切成1 mm×1 mm×1 mm的薄片,加入2 倍体积的体积分数2.5%戊二醛溶液(0.1 mol/L pH 7.4磷酸盐缓冲液配制)预固定1 h;然后更换一次缓冲液,4 ℃过夜;将鱼肉在2 倍体积的磷酸盐缓冲液(0.1 mol/L,pH 7.4)中冲洗10 min;用体积分数70%、80%、95%、100%乙醇梯度脱水10 min;脱水后在丙酮和环氧树脂的混合液(1∶1,V/V)中室温浸泡过夜,次日用环氧树脂包埋(60 ℃聚合)。超薄切片机切片,切片厚度为70 nm。切片用透射电子显微镜观察并拍照。
1.3.4 剪切力测定
剪切力指标的测定参照Zang Jinhong等[16]的方法。采用质构仪测定草鱼鱼肉的剪切力,注意刀片平行于肌肉纤维的方向切割,速率2.0 mm/s,触发力5 g,压缩形变60%,刀片接触鱼肉后,以到达的最大峰值表征剪切力。
1.3.5 滴水损失率测定
滴水损失率的测定参照Mu Gang等[17]的方法并加以改进。取不同冰藏时间下的草鱼,用滤纸轻轻拭去肉样表面渗出水分并称剩余肉样的质量,按式(2)计算鱼片的滴水损失率。
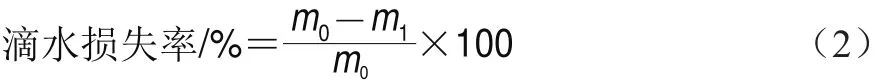
式中:m0为冰藏前鱼片的质量/g;m1为冰藏后鱼片的质量/g。
1.4 数据处理与分析
采用SPSS 19.0对数据进行统计分析,采用Duncan’s多重分析进行组间显著性检验,P<0.05表示差异显著。并用Origin 8.6软件作图。
2 结果与分析
2.1 草鱼在冰藏过程中伴肌球蛋白的降解
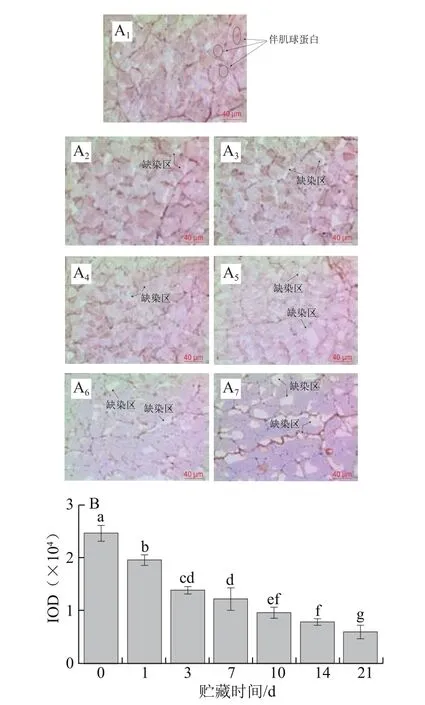
图1 草鱼在冰藏过程中伴肌球蛋白的免疫组化分析Fig. 1 Immunohistochemistry analysis of titin in ice-stored grass carp
伴肌球蛋白是分子质量约为3 000 kDa的肌原纤维大蛋白,约占肌原纤维质量的10%,间跨了半个肌节的长度,横跨整个半肌小节,将Z线连接到肌节中的M线,C端和M线交迭[18]。伴肌球蛋白可以与抗体发生免疫阳性反应,呈现出棕褐色区域块。如图1A、B所示,冰藏1~3 d,褐色变浅且缺染区出现,说明在此期间伴肌球蛋白已发生降解;随着冰藏时间的延长,伴肌球蛋白的降解程度逐渐增加,冰藏前3 d伴肌球蛋白已降解43.78%;冰藏第7~10天棕褐色变为浅褐色,降解率下降了10.59%;冰藏第14~21天褐色面积大幅度减少,缺染区增多,最终冰藏21 d时伴肌球蛋白的IOD由初始24 620减少至5 882,降解率达76.10%。实验结果表明冰藏前期伴肌球蛋白降解较快,后期降解较慢。研究发现,猪肉成熟过程中,伴肌球蛋白在冷藏前期降解较慢,冷藏后期降解速率反而较快[19]。Annderson等[20]研究发现,牛宰后前3 d伴肌球蛋白降解达70%,同时牛肉嫩度增加。这说明伴肌球蛋白的降解速度和程度随动物品种存在差异。
2.2 草鱼在冰藏过程中伴肌动蛋白的降解
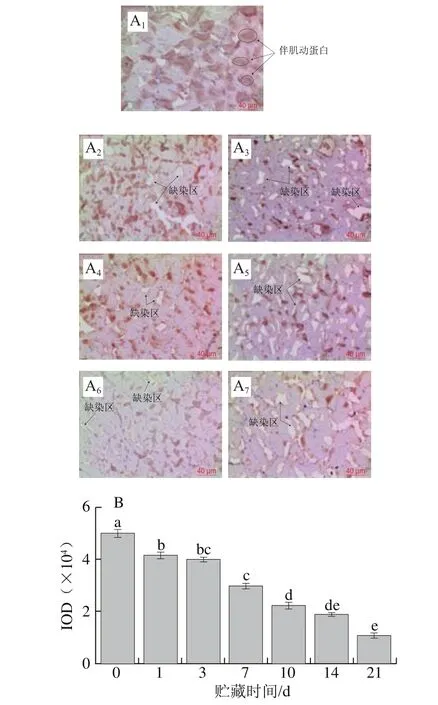
图2 草鱼在冰藏过程中的伴肌动蛋白的免疫组化分析Fig. 2 Immunohistochemistry analysis of nebulin in ice-stored grass carp
伴肌动蛋白是一种约600~900 kDa的高分子质量蛋白质,在肌原纤维蛋白中的质量分数约为5%,其多肽链横跨肌纤维I带并延伸至A带,起着联接肌动蛋白和Z盘的作用[21]。由图2A、B可知,伴肌动蛋白在冰藏第1天伴肌动蛋白IOD降低了8 100,降解了17.53%;冰藏第3天出现缺染区且整体颜色变淡,在第7~10天缺染区增大,说明伴肌动蛋白在冰藏7~21 d期间逐步降解;冰藏第14天褐色变成浅褐色,冰藏第21天缺染区域大幅度增多,最终伴肌动蛋白IOD下降至10 982,降解率高达78.21%。牛肉中同样发现伴肌动蛋白在贮藏期前7 d很容易发生降解,同时伴随剪切力下降[22]。鱼肉伴肌动蛋白的降解情况和鸡肉[23]有所不同,鸡肉样品在第1天和第3天成熟时,聚丙烯酰胺凝胶电泳出现降解带,但第1天和第3天的样本之间没有发现明显的差异,这是由于鸡肉中蛋白和酶的体系与鱼肉中蛋白和酶的体系完全不同;鸡肉体系中骨架蛋白的降解有利于鸡肉的成熟嫩化,但是淡水鱼中骨架蛋白降解会导致鱼肉质构软化,所以控制骨架蛋白降解对提高鱼肉品质是十分必要的。伴肌球蛋白和伴肌动蛋白是维持肌原纤维结构完整性的主要蛋白,其降解会导致肌原纤维结构的破坏[24]。现有研究表明内源蛋白酶是影响蛋白降解的主要因素[11],故后续研究可以通过抑制蛋白酶活性延缓骨架蛋白的降解。
2.3 草鱼在冰藏过程中抗肌营养不良蛋白的降解
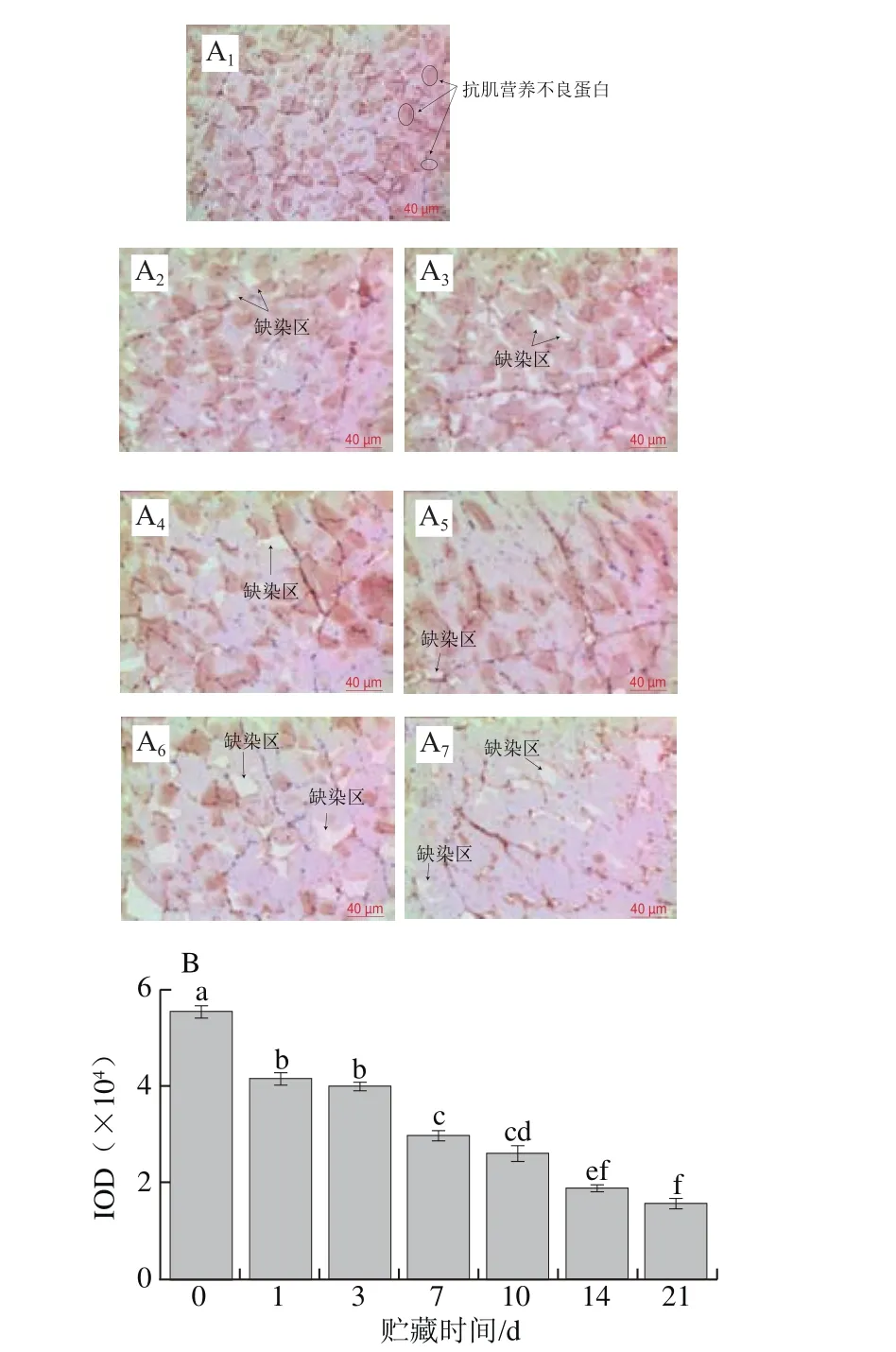
图3 草鱼在冰藏过程中的抗肌营养不良蛋白的免疫组化分析Fig. 3 Immunohistochemistry analysis of dystrophin in ice-stored grass carp
抗肌营养不良蛋白位于膜和肌动蛋白之间,它的破坏会导致Z线、M线、中间丝状体断裂,进而会造成肌纤维之间以及肌纤维与肌膜之间发生解离,引起肉品质构劣化[25]。图3A所示为草鱼冰藏期间背部肌组织上抗肌营养不良蛋白的表达、分布以及其含量的变化,肌细胞膜上出现强度不一的棕黄色完整条带。抗肌营养不良蛋白的降解随着贮藏时间的延长呈增加趋势,前7 d降解率近60%。在贮藏1 d的样品中没有发现抗肌营养不良蛋白的降解,这表明抗肌营养不良蛋白前期以完整的形式存在于样品中;冰藏第3天颜色变淡并开始出现缺染区,在7~10 d颜色变化不明显,且缺染区面积无明显变化;冰藏第14~21天,颜色由褐色变为淡褐色,缺染区明显增大;第21天时抗肌营养不良蛋白IOD降为15 982,降解率达71.14%。李经伦等[26]利用免疫组化技术表征小鼠抗肌营养不良蛋白的表达,发现随着饲养时间的减少淡染或缺染的情况显著。也有研究表明,抗肌营养不良蛋白的降解使骨架蛋白遭到不可逆的破坏,从而使得细胞膜结构不稳定,不能抵抗肌纤维的伸缩牵拉而损伤[27]。
2.4 草鱼在冰藏过程中组织超微结构
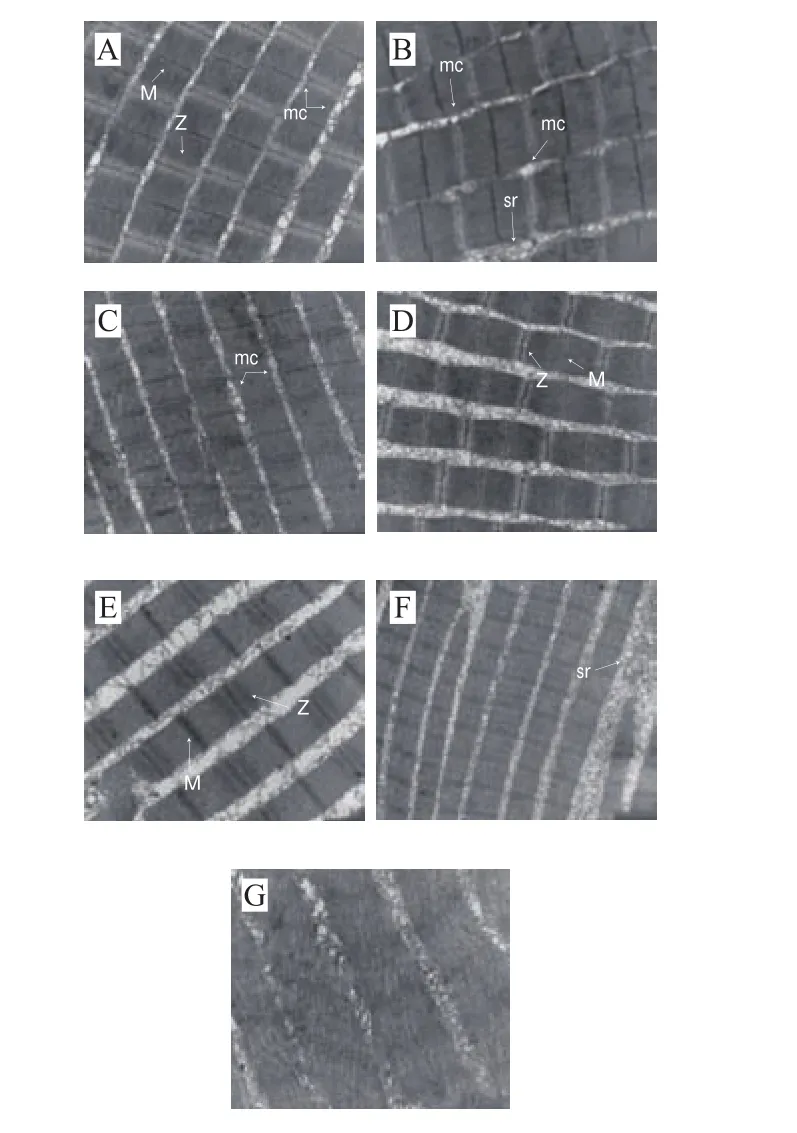
图4 草鱼在冰藏过程中的超微结构Fig. 4 Ultrastructure of ice-stored grass carp
如图4所示,新鲜草鱼肌原纤维结构排列整齐无空隙,可清晰观察到肌节、明暗带、M带、Z带的分布情况;冰藏第1天,肌纤维M带、Z带保持完整,具有清晰的明暗带分布;冰藏第3~7天,草鱼肌原纤维间隙扩大、扭曲断裂,肌浆网囊泡聚集在纤维间隙,Z带被破坏,其余条带及肌节结构尚完整;在冰藏第10天,肌纤维虽然排列整齐,但M带基本被破坏,明暗带不分明,结合伴肌球蛋白和伴肌动蛋白所处位置,说明这两种蛋白已开始降解;冰藏的第14天,肌原纤维结构破裂为分散的块状,各肌节条带均模糊不清,M带基本完全消失;冰藏的第21天,草鱼肌原纤维结构松散,M带、Z带完全消失,明暗带模糊,肌浆网溶解,说明各骨架蛋白大部分已降解,组织结构完全解离[28],草鱼组织结构随着冰藏时间的延长逐渐劣化。伴肌球蛋白可以将粗肌丝与Z线联结以维持肌原纤维的完整性和稳定性[29],但随冰藏时间延长,鱼背肌中伴肌球蛋白降解程度变大,肌原纤维的稳定性变差,鱼肉质构劣化严重。Takahash等[30]推测,伴肌动球蛋白的降解造成肌纤维结构的变化,破坏了原来肌纤维内部的紧密结构,使得肌肉舒张,质构劣化。草鱼肌肉组织学形态与质构密切相关,在冰藏过程中草鱼骨架蛋白的降解参与并影响鱼肉质构的劣变[31]。
2.5 草鱼在冰藏过程中剪切力和滴水损失率的变化
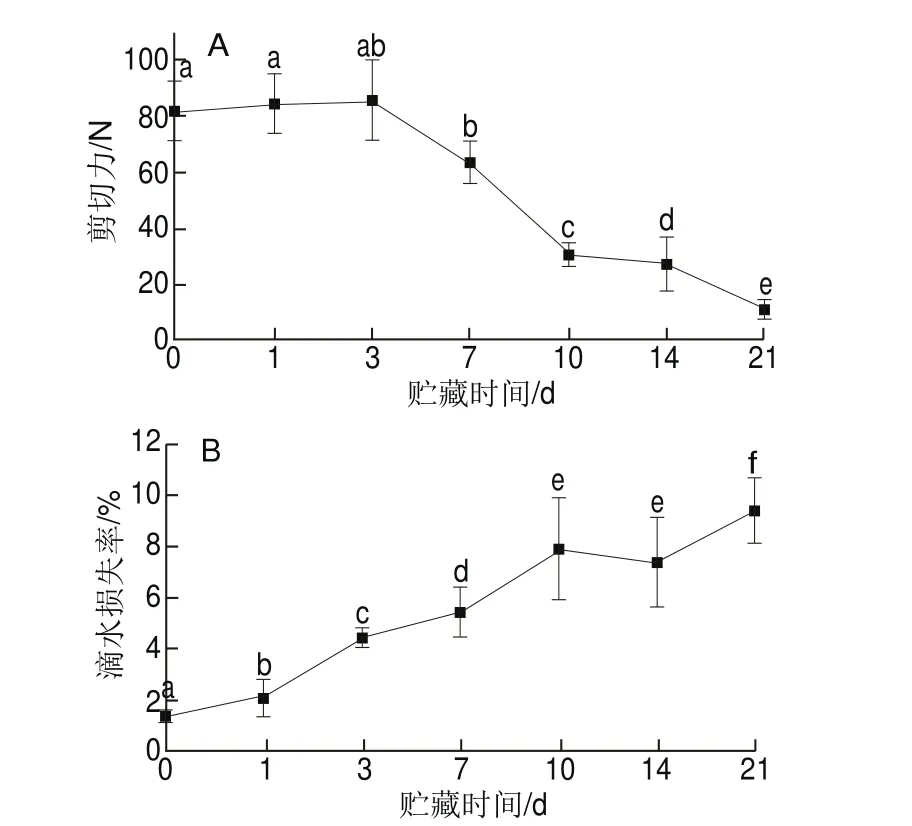
图5 草鱼在冰藏过程中的剪切力(A)和滴水损失率(B)变化Fig. 5 Changes in shear force (A) and drop loss (B) of ice-stored grass carp
剪切力和滴水损失率都是表征鱼肉贮藏过程中质构变化的重要指标。剪切力测定模拟鱼肉被牙齿咬断咀嚼过程中的用力变化情况,因此能直观表征鱼肉质构品质[32];滴水损失率可以衡量肌肉蛋白质保持水分的能力,直接影响肉的风味、质地、多汁性等,与品种和肌肉部位等因素有关[33]。如图5A、B所示,草鱼冰藏第1天有滴水损失,在冰藏第1~3天,草鱼肌肉出现僵直现象,且前3 d剪切力上升,但不显著;在冰藏初期剪切力上升是肌肉进入僵直状态的典型特征,随后下降被认为是因为肌肉解除僵直[34]。冰藏条件下草鱼块的剪切力在10 d内由81 N快速下降至32 N,剪切力降低了60.49%;同时冰藏7~10 d滴水损失急剧增大,第10天滴水损失率达到初始值的4.9 倍。冰藏10 d内滴水损失率由1.6%增加至7.8%。第21天剪切力下降至11 N,相比冰藏第0天鱼肉剪切力降低了86%;草鱼冰藏第10~14天,滴水损失率无显著变化。骨架蛋白降解会导致肌原纤维网格结构破坏,最终导致整个肌细胞结构损坏,系水能力变差,滴水损失率增加[35]。已有研究发现肌肉的滴水损失可归因于细胞骨架蛋白的加速降解[36]。影响鱼肉品质的因素很多,但归结到肌肉的生理生化水平上,蛋白质的变化对持水性的影响尤为重要,特别近年来的研究发现骨架蛋白降解程度加深的同时,质构劣化,汁液流失增加[37]。
2.6 草鱼在冰藏过程中骨架蛋白IOD与剪切力和滴水损失率的相关性分析结果
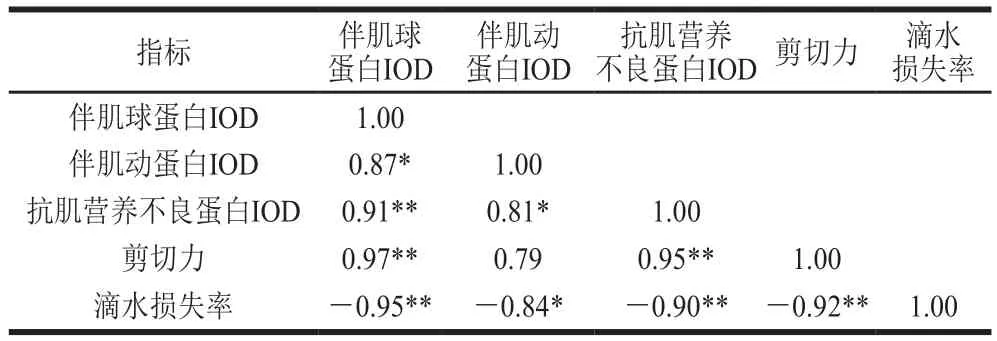
表1 草鱼冰藏过程中各指标相关性分析Table 1 Correlation analysis between cytoskeleton proteins and shear force and drip loss in ice-stored grass carp
如表1所示,剪切力与伴肌球蛋白IOD、抗肌营养不良蛋白IOD均呈极显著正相关(P<0.01),相关系数分别为0.97、0.95;滴水损失率与伴肌球蛋白、伴肌动蛋白、抗肌营养不良蛋白的IOD呈显著负相关(P<0.05,P<0.01),相关系数分别为-0.95、-0.84、-0.09。骨架蛋白的降解使得Z盘弱化,M带、Z带完全断裂,各蛋白间的链接细丝被破坏,细胞间隙增大,肌原纤维降解成数个肌节组成的串联体或小片段形式[23];整个降解过程最终导致细胞功能的丧失和肌原纤维结构的削弱,使得鱼肉剪切力下降,质构劣化。肌肉中的水分与蛋白质的极性基团结合形成水合离子而留存于蛋白质的空间结构中,这是肌肉具有持水性的原因[38];实验结果表明肌肉系统中伴肌动蛋白和伴肌球蛋白的完整性可能影响系水力[39]。吴霜等[40]同样发现滴水损失率与伴肌球蛋白和伴肌动蛋白的完整度有正相关性;这可能是由于伴肌球蛋白和伴肌动蛋白处于组织细胞明带处,它们的降解会导致肌细胞收缩变形,形成汁液流失通道,加速滴水损失。但是,由于各个骨架蛋白在细胞内所处的位置及功能的不同,其与滴水损失率呈现出的相关性也不同。实验结果进一步表明骨架蛋白的降解加速了鱼肉质构劣化,影响其体内固化水的硬度和分布,导致冰藏过程中滴水损失率增加、剪切力下降,从而导致质构劣化。
3 结 论
骨架蛋白(伴肌球蛋白、伴肌动蛋白、抗肌营养不良蛋白)与冰藏条件下的草鱼质构密切相关。草鱼伴肌球蛋白、伴肌动蛋白、抗肌营养不良蛋白都随着冰藏时间的延长而降解,且各骨架蛋白的IOD与剪切力均呈正相关,与滴水损失率均呈负相关。草鱼组织结构随着冰藏时间的延长逐渐劣化,说明骨架蛋白的降解参与并影响鱼肉质构的劣变。然而,鱼肉体系中骨架蛋白的降解途径还有待进一步研究分析。
