利用荧光定量PCR和荧光定量RT-PCR检测猪瘟活疫苗(细胞源)中的16种外源病毒
2019-07-19孙博宋新刚张萌萌张健高习文张立恒尹辉郭伟任德强
孙博 宋新刚 张萌萌 张健 高习文 张立恒 尹辉 郭伟 任德强


摘要:本文为分子生物学方法检测猪瘟活疫苗(细胞源)外源病毒提供实验数据。用经过验证的荧光定量PCR和荧光定量RT-PCR方法检测哈尔滨元亨生物药业有限公司生产的24批猪瘟活疫苗(细胞源)中的16种外源病毒(FMDV、PCV2、CSFVW、BCoV、BVDV、BPIV-3、TGEV、PEDV、RV、PRRSV、PCV1、MRV、JEV、PPV、PRV、BHV-1),结果显示24批猪瘟活疫苗(细胞源)成品均无以上16种外源病毒。
关键词:猪瘟活疫苗;PCR;RT-PCR;外源病毒
中图分类号:S852.4文献标识码:A文章编号:2095-9737(2019)01-0001-04
Abstract:It provides experimental data for the determination of classical live swine fever vaccine(cell source) exogenous virus by molecular biology method.Detection of 16 exogenous viruses (FMDV、PCV2、CSFVW、BCoV、BVDV、BPIV-3、TGEV、PEDV、RV、PRRSV、PCV1、MRV、JEV、PPV、PRV、BHV-1) from 24 batches of live classical swine fever vaccine(cell source) produced by Harbin Yuanheng Biopharmaceuticals Co. Ltd., the results showed that 24 batches of products did not have the above 16 exogenous viruses.
Key words:Living classical swine fever vaccine; PCR; RT-PCR; Exogenous virus
外源病毒的干扰,已经成为疫苗质量问题的隐形杀手,猪瘟活疫苗(细胞源)的外源病毒检测一项,参照《中华人民共和国兽药典》(2015年版第三部)要求,需要做荧光抗体检测、致细胞病变和红细胞吸附实验[1],以下简称细胞培养法。哈尔滨元亨生物药业有限公司,致力于生产行业内最纯净的疫苗,并始终关注检测方法的研究,希望通过有效的检测手段,合理、高效的保证产品质量。
哈尔滨元亨生物药业有限公司采购了14种荧光定量PCR和荧光定量RT-PCR商品化试剂盒,试剂盒分别经过特异性、敏感性、重复性方法学验证[2-14],检验方法已完成验证。现用经过验证的荧光定量PCR和荧光定量RT-PCR商品化试剂盒检测24批猪瘟活疫苗(细胞源)中的16种外源病毒(FMDV、PCV2、CSFVW、BCoV、BVDV、BPIV-3、TGEV、PEDV、RV、PRRSV、PCV1、MRV、JEV、PPV、PRV、BHV-1),以期为分子检测方法提供临床数据便于试验分析及在生产过程中有针对性的防止外源病毒污染。
1 材料与方法
1.1 材料
分子检测试剂盒:猪细小病毒实时荧光PCR检测试剂盒,猪伪狂犬病毒实时荧光PCR检测试剂盒,猪圆环病毒1型实时荧光PCR检测试剂盒,猪圆环病毒2型实时荧光PCR检测试剂盒,牛疱疹病毒Ⅰ型实时荧光RT-PCR检测试剂盒,口蹄疫病毒通用型实时荧光RT-PCR检测试剂盒,猪瘟病毒野毒株实时荧光RT-PCR检测试剂盒,牛冠状病毒实时荧光RT-PCR检测试剂盒,牛病毒性腹泻病毒实时荧光RT-PCR检测试剂盒,猪日本乙型脑炎病毒实时荧光RT-PCR 检测试剂盒,猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪轮状病毒三重实时荧光RT-PCR检测试剂盒,高致病性猪繁殖与呼吸综合征活疫苗(JXA1-R株)实时荧光RT-PCR检测试剂盒,牛副流感病毒实时荧光RT-PCR检测试剂盒,哺乳动物呼肠孤病毒实时荧光RT-PCR检测试剂盒(以上材料采购自TaKaRa、Promega、青岛巴特菲生物科技有限公司、北京世纪元亨动物防疫技术有限公司)。
哈尔滨元亨生物药业有限公司连续生产的24个批次猪瘟活疫苗(细胞源)每批3瓶。荧光定量聚合酶链反应(PCR)检测系统FQD-96A(购自杭州博日科技有限公司)。
1.2 方法
1.2.1 核酸提取
每批猪瘟活疫苗(细胞源)3瓶,用生理盐水稀释至完全溶解后混合,根据批号依次排列顺序并标记序号。参照试剂盒说明书,进行核酸提取。
1.2.2 扩增
核酸提取后扩增前将试剂盒从-20℃拿出,将试剂混匀后离心待用,每种试剂盒检测26份样品,分别为24批样品、阴性对照、阳性对照,每种检测项目配制27份体系,提取后的核酸根据说明书要求的程序进行扩增,观察曲线,并记录CT值。PCR仪可以同时检测96份样品,选取三种外源病毒进行同时扩增,FMDV、PCV2、CSFVW为1组,BCoV、BVDV、BPIV-3为1组,PCV1、MRV、JEV为一组,TGEV、PEDV、RV、PRRSV为1组, PPV、PRV、BHV-1为1组,共进行五次扩增,TGEV、PEDV、RV、PRRSV组样品数量为52个,其余每组样品数量为78个。根据说明书在软件上输入不同病毒核酸的扩增程序,经过连续检测直到所有外源病毒检测项目完毕后进行结果统计。
2 结果
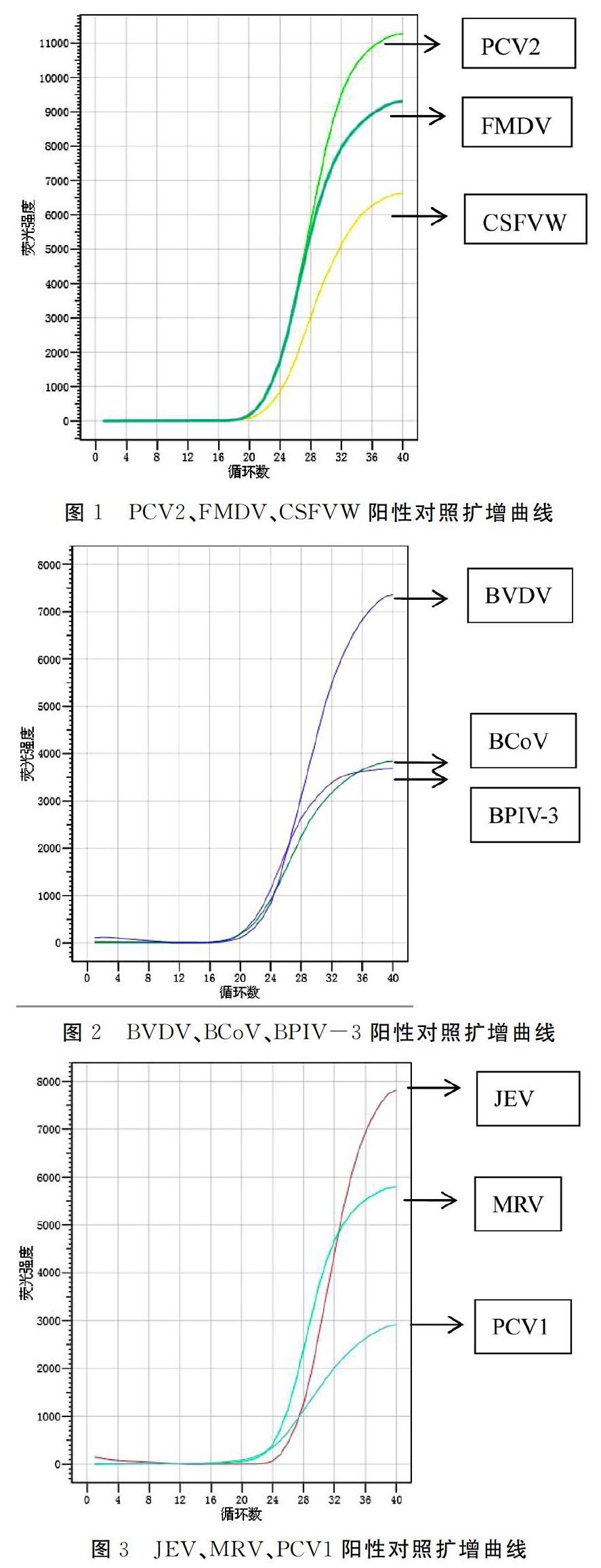
16种外源病毒阳性CT值符合结果判定要求,并出现特定的扩增曲线,阴阳性对照成立,24批猪瘟活疫苗(细胞源)结果为阴性。CT值参见表1,阳性对照扩增曲线参见图1~图5。
3 讨论
疫苗品质是优良产品的精髓,我们从原材料、硬件设施、生产流程三个层面严格控制产品质量,不断苛求纯净的产品品质。猪瘟活疫苗(细胞源)的制备选用的原材料为细胞、胰酶、牛血清等,根据原材料动物种属的不同,选取猪源及牛源相关的常见外源病毒作为检测项目(FMDV、PCV2、BCoV、BVDV、BPIV-3、TGEV、PEDV、RV、PCV1、MRV、JEV、PPV、PRV、BHV-1)。采用現代分子生物学先进检测技术,从细胞、血清、胰酶到半成品、成品依次进行检测,以加强外源病毒的监测及对外源病毒的来源进行追溯。同时为了保证抗原品系纯正,选取猪瘟病毒疫苗毒和野毒株荧光RT-PCR检测试剂盒分别进行疫苗毒和野毒的双向检测,保证疫苗无野毒污染的同时,确保疫苗品系“纯正”。在生产流程方面,为了避免产品间的交叉污染,增加高致病性猪繁殖与呼吸综合征活疫苗(JXA1-R株)分子生物学方法检测外源病毒项。
根据《中华人民共和国兽药典》2015年版第三部外源病毒检测法,针对猪瘟活疫苗(细胞源)用非禽源细胞来源及疫苗靶动物,选用的细胞为MDBK、Vero、PK-15[15],分别进行实验。如果在细胞培养法结果出现阳性时,我们可以用已建立的分子生物学方法检测细胞培养法所使用的原材料,包括MDBK、Vero、PK-15、牛血清、胰酶的检测,以排除实验过程中引入的外源病毒,保证细胞培养法实验结果的准确性。
细胞培养法和分子生物学检测法两者相比较,除去原材料及设备设施的不同,检验周期也有很大差别。分子生物学方法可以快速、灵敏的检出外源病毒阳性,如果分子检测方法检出阳性,在不能确定是否为假阳性的情况下,则需要对该样品进行基因测序[16],同时该样品接种相对应的细胞,继代两次后再进行PCR检测,进一步验证实验结果,避免误判。
虽然我国2015年版兽药典未收录分子生物学检测方法,但在国际贸易指定试验中PCR方法已经广泛使用。如OIE(世界动物卫生组织) 已将检测蓝舌病病毒(BTV)、非洲猪瘟病毒(ASFV)、牛传染性鼻气管炎病毒(IBRV) 等病毒的PCR方法列为国际贸易指定试验方法[17]。因此细胞培养法只能确定是否有外源病毒污染,而分子生物学方法可以确定被污染的外源病毒的种类,根据检测结果,生产过程中可以进行有针对性的控制[18],从而保证产品的安全性。荧光定量PCR和荧光定量RT-PCR方法操作便捷、快速、直观,可以作为细胞培养法检测外源病毒的有效补充,鉴定疫苗的纯净性并根据污染的外源病毒种类指导生产。
参考文献:
[1] 中华人民共和国兽药典[M].2015(第三部).北京:中国农业出版社,2015:附录16-18.
[2] 李永东,张常印,姜平,等.口蹄疫病毒实时RT-PCR检测方法的建立[J].中国人兽共患病学报,2006(03).
[3] 张福良,朱道中,宋长绪.猪圆环病毒I型荧光定量PCR检测方法的建立[J].中国兽医杂志,2008(01).
[4] 曹伟伟,郭抗抗,许信刚,等.猪圆环病毒Ⅱ型TaqMan实时荧光定量PCR检测方法的建立与应用[J].西北农林科技大学学报(自然科学版),2013(01):41(1)13-18.
[5] 赵丽,赵旭永,陈红英,等.PPV SYBRGreenⅠ实时荧光定量PCR检測方法的建立及应用[J].西北农林科技大学学报(自然科学版),2012(05).
[6] 李雪明,于红欣,杨红杰,等.伪狂犬病病毒gE基因荧光定量PCR检测方法的建立[J].北京农学院学报,2015(04).
[7] 许梦怡.猪传染性胃肠炎病毒、猪流行性腹泻病毒和猪轮状病毒多重荧光RT-PCR检测方法的建立[D].扬州大学,2016.
[8] 阳帆,刘建军,何建凡,等.TaqMan PCR检测乙型脑炎病毒方法的建立及应用[J].中国卫生检验杂志,2008(10).
[9] 季新成,牛国辉,员丽娟,等.牛传染性鼻气管炎病毒内标荧光定量PCR检测方法的建立与应用[J].中国兽医学报,2010(06).
[10] Mohit Baxi,Dorothy McRae,Shailja Baxi,et al. A one-step multiplex real-time RT-PCR for detection and typing of bovine viral diarrhea viruses[J] .Veterinary Microbiology,2006 (1) .
[11] Haitham M. Amer,Fahad N. Almajhdi,et al. Development of a SYBR Green I based real-time RT-PCR assay for detection and quantification of bovine coronavirus[J] . Molecular and Cellular Probes , 2011 (2) .
[12] Toussaint J F,Rziha H J,Bauer B,et al.Effects of hypervaccination with bovine herpesvirus type 1 gE-deleted marker vaccines on the serological response and virological status of calves challenged with wild-type virus.[J] .Veterinary Record ,2004 .
[13] 蒲静,赖平安,张鹤晓,等.高致病性猪蓝耳病病毒TaqMan荧光RT-PCR检测方法的建立与初步应用[A].中国畜牧兽医学会2008年学术年会暨第六届全国畜牧兽医青年科技工作者学术研讨会论文集[C].2008.
[14] 张兴娟.同时检测和区分猪瘟野毒株和兔化弱毒疫苗株及牛病毒性腹泻病毒1型的三重荧光定量RT-PCR方法的建立[D].扬州大学,2010.
[15] 吴华伟,郎洪武,陈晓春,等.《中华人民共和国兽药典》二〇一〇年版三部非禽源细胞及其制品外源病毒检验解读[J].中国兽药杂志,2013,47(1):48-52.
[16] 尚宏华,郭建平,谢秋梅.猪瘟活疫苗外源病毒BVDV细胞培养与PCR检测的比较[J].江西畜牧兽医杂志,2014(6):8-10.
[17] 世界动物卫生组织.陆生动物诊断试验和疫苗手册(哺乳动物、禽鸟与蜜蜂)第五版[S].
[18] 王彩霞.几种方法对非禽源生物制品中外源病毒检测的研究[D].新疆农业大学,2013.
