壳聚糖/氧化石墨/SiO2薄膜的制备及吸附性能
2019-07-18高奕红邓玲娟马占营
高奕红,王 珊,邓玲娟,马占营,范 广,来 鑫
(咸阳师范学院化学与化工学院,咸阳 712000)
1 引 言
随着人们生活水平的提高,对环境问题越来越重视,尤其是周边的生活环境,工业印染废水的排放虽说有一定的要求,但还是对周围环境有或多或少的影响[1-8]。有机无机复合材料是把有机物的优点和无机物的优点集于一体的材料,是目前研究的热点之一。壳聚糖因为有-OH和-NH2,可以和废水中的染料分子、重金属离子发生吸附,使得废水得到净化[9-13]。对壳聚糖/二氧化硅吸附研究的有报道[14-17],研究壳聚糖/氧化石墨的也有不少[18-20],但是把两者结合在一起的很少有报道。
前期制备过壳聚糖/SiO2凝胶,具有一定的吸附性,对甲基橙的吸附量为43.73 mg/g,为了提高壳聚糖/SiO2凝胶的吸附性能,在制备过程中加入氧化石墨,制备了两种壳聚糖/氧化石墨/SiO2,并考察了时间、甲基橙初始浓度、酸碱性、温度对吸附性能的影响。
2 实 验
2.1 试剂与仪器
试剂与仪器如表1,2所示。
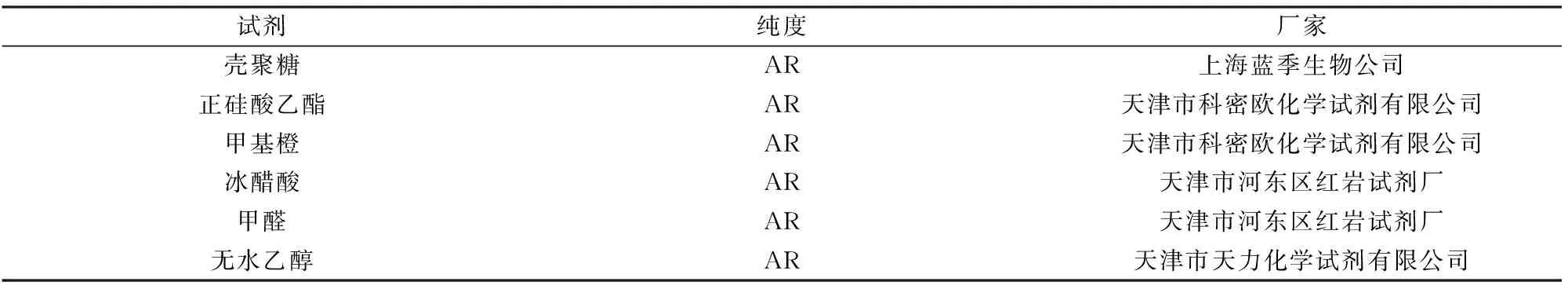
表1 试剂Table 1 Reagent

表2 仪器Table 2 Instrument
2.2 壳聚糖/氧化石墨/SiO2复合物的制备
氧化石墨(Graphite oxide,GO)采用改进的Hummers方法制备[21]。
称取13.3 mg的氧化石墨,加入50 mL的蒸馏水中,在超声清洗器中超声10 h后备用。在30 mL 2%的醋酸溶液中加入0.5046 g壳聚糖,搅拌40 min,把前述的石墨溶液加入其中,逐滴加入0.5030 g正硅酸乙酯(壳聚糖和正硅酸乙酯的质量比为1)和0.2 mL的甲醛溶液,在60 ℃搅拌3 h静置24 h,涂膜,晾干,脱膜。记为a样品。
在50 mL蒸馏水中加入13.3 mg氧化石墨超声10 h备用。0.2522 g壳聚糖中加入15 mL 2%的醋酸溶液,搅拌30 min后加入0.2924 g正硅酸乙酯(壳聚糖和正硅酸乙酯的质量比小于1)和8滴的甲醛溶液后加入超声过的氧化石墨溶液,常温下搅拌2 h后在60 ℃下搅拌1.5 h后,在一个大盘子上涂膜,晾干,脱膜。记为b样品。
2.3 凝胶的溶胀度、含水量、交联度的测定
将一块称好的凝胶薄膜W0放于50 mL蒸馏水中溶胀至质量不在发生变化,快速取出,用滤纸吸干表面多余的水分,称重,记为Wt,则凝胶的溶胀度(SD)的计算式见式(1)。
(1)
Wt(g)为溶胀后的质量;W0(g)为溶胀前的干重;l为溶剂的密度(g/mL)。
称取一定质量的凝胶薄膜,在水中溶胀后,快速取出,用滤纸快速吸干表面多余的水分,称重,记为G0,在105 ℃下干燥4 h,称重,记为Gt,则含水量的计算式见式(2)[22]
(2)
称取一定量的薄膜,称重,记为m0,在2%的乙酸溶液中浸泡12 h,取出后在105 ℃下干燥4 h,称重,记为mt,则交联度计算式见式(3)[22]
(3)
2.4 各种条件对吸附性能的影响
2.4.1 时间对吸附的影响
在一系列锥形瓶中称取几乎相同量的薄膜,分别加入一定浓度的甲基橙溶液,放在25 ℃的恒温振荡器中振荡,分别在不同的时间段取出,常压过滤,滤液用分光光度计测吸光度,计算溶液的浓度,进而计算吸附量。
吸附量的计算式见式(4)
q=V(C0-Ce)/m
(4)
其中q为壳聚糖/氧化石墨/SiO2对甲基橙的吸附量(mg/g),V为吸附时的甲基橙溶液体积(L),C0和Ce分别为吸附前和吸附后溶液的质量浓度(mg/L),m为所取壳聚糖/氧化石墨/SiO2的质量(g)。
2.4.2 初始浓度对吸附的影响
根据上面的时间,改变初始浓度,按照2.4.1的方法得出初始浓度与吸附量的关系。
2.4.3 酸碱性对吸附的影响
根据上面的时间,初始浓度,按照2.4.1的方法得出酸碱性与吸附量的关系。
2.4.4 温度对吸附的影响
根据上面的时间,初始浓度,酸碱性,按照2.4.1的方法得出温度与吸附量的关系。
2.4.5 不同温度下的a样品随浓度变化的吸附量
称取一定量的壳聚糖/氧化石墨/SiO2膜加入多份不同浓度的甲基橙溶液,在不同温度下在恒温振荡器中反应一定的时间,常压过滤,测定滤液的吸光度,计算滤液的浓度进而计算吸附量并作图。
2.5 吸附动力学和吸附等温线模型
为了了解吸附在动力学方面的行为,对制备的两种膜的吸附量随时间变化的数据利用经常用到的准一级动力学模型和准二级动力学模型进行拟合。
准一级动力学模型
(5)
准二级动力学模型
(6)
式中qt为t时刻的膜的吸附量(mg/g),qe为平衡时刻膜的吸附量(mg/g),t为吸附时间(min),k1为准一级反应速率常数(min-1),k2为准二级反应速率常数(g·mg-1·min-1)。
为了更好的了解吸附的过程,对平衡浓度和吸附量之间的关系用Langmuir模型方程和Freundlich模型方程进行拟合。
Langmuir模型方程
(7)
Freundlich模型方程
(8)
式中ce为平衡时刻的质量浓度(mg·L-1),qe为平衡时刻凝胶的吸附量(mg/g),qs为膜的最大吸附量(mg/g),KL为Langmuir吸附等温线常数,KF、n为Freundlich吸附等温式常数。
3 结果与讨论
3.1 壳聚糖/氧化石墨/SiO2凝胶的各种表征
3.1.1 红外光谱图
图1为两种壳聚糖/氧化石墨/SiO2膜的红外光谱图。都出现了3000~3500 cm-1宽的吸收峰,此处的峰变宽可能是因为壳聚糖的-OH通过氢键与二氧化硅中的-OH结合在一起。在1558 cm-1处强的吸收峰,是由N-H的弯曲振动与C-N的伸缩振动叠加而成的,说明正硅酸乙酯水解后已经接到壳聚糖上了,且交联反应主要发生在氨基上[23]。图谱在1417 cm-1和1412 cm-1处出现了新的吸收峰,表明GO的羧基和CS 的氨基通过共价键结合。两个图谱在1081 cm-1处的吸收峰是壳聚糖分子上C6-OH的一级羟基的特征吸收峰,加强且变宽,是因为GO 上环氧基C-O-C 和壳聚糖上脂肪伯胺C-NH2的重叠峰和二氧化硅中Si-O-Si的骨架振动的强吸收峰重叠在一起产生的,杂化膜中的此峰强度又因物质质量比例不同而有所变化。a、b曲线中1085 cm-1左右出现了Si-O-Si反对称伸缩振动峰,吸收峰加强且变宽,可能是因为正硅酸乙酯水解后的二氧化硅的Si-O-Si骨架振动的强吸收峰重叠在一起产生。经过对比,a出现的吸收峰尖锐而强,b出现的吸收峰相对较弱。

图1 两种壳聚糖/氧化石墨/SiO2的红外光谱图 Fig.1 FTIR spectra of two chitosan/graphite oxide/SiO2

图2 氧化石墨、壳聚糖和二氧化硅的XRD图谱 Fig.2 XRD patterns of graphite oxide, chitosan and SiO2
3.1.2 X-射线衍射图
图2图3为壳聚糖、二氧化硅、氧化石墨和所制备的两种壳聚糖/氧化石墨/SiO2膜的XRD图谱。在图2中,氧化石墨在衍射角2θ=11.7°出现特征峰,壳聚糖在衍射角2θ=20°和30°左右出现明显的衍射峰,二氧化硅在衍射角2θ=10°和25°出现特征峰[24]。在图3中a和b的衍射峰所在位置基本相同,2θ=10°、11.7°、20°、25°的衍射峰消失,而在2θ=18°、40°左右出现了新的衍射峰,说明有新的物质生成。

图3 两种壳聚糖/氧化石墨/SiO2的XRD图谱 Fig.3 XRD patterns of two chitosan/graphite oxide/SiO2
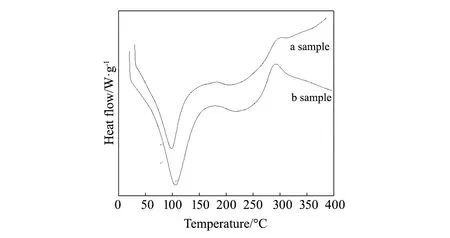
图4 样品的 DSC曲线 Fig.4 DSC curves of the sample
3.1.3 差示扫描量热图
图4是壳聚糖/氧化石墨/SiO2的差示扫描量热图。这一过程分两个阶段,0~200 ℃和200~400 ℃,在第一阶段主要是吸热阶段,a在99 ℃出现吸热峰,b在84 ℃出现吸热峰,且b的吸收的热量比a吸收的热量多。这一过程主要是样品的失水所致。在第二阶段,a的放热峰在296 ℃出现,b在287 ℃出现,且b放出的热量要远远多于a, a比b更稳定。经过对比,a比b的稳定性更好。
3.1.4 扫描电镜图
图5为两种壳聚糖/氧化石墨/SiO2的SEM照片,喷金制样,在五万倍的条件下得到图5。a 和b样品均可看到小颗粒堆积分布在壳聚糖高分子膜中,a表面均匀,b表面不太均匀。因此,a样品优于b样品。

图5 样品的SEM照片 Fig.5 SEM images of the sample
3.2 溶胀度、含水量、交联度的测定
称取a样品0.0208 g,浸入50 mL蒸馏水中至溶胀平衡,质量不再发生变化,快速取出,用滤纸快速吸干表面多余的水分称其质量为0.0756 g,溶胀度为3.6346。用同样的方法测定b样品的溶胀度为3.5996。两种凝胶的溶胀性能良好。
把上述已达溶胀平衡的0.0756 g的a样品,放在105 ℃的烘箱中烘干5 h后称取其质量为0.0169 g,计算其含水量为77.65%。同样的方法测定b样品的含水量为78.51%。两种凝胶的含水性能差不多。这主要是因为凝胶的表面致密多孔,在水中溶胀,水能够进入三维网络结构的内部,这也使得壳聚糖/氧化石墨/SiO2能应用于水体中重金属离子的吸附[22]。
称取0.0059 g样品a,浸于2%的醋酸溶液中12 h,然后在105 ℃的干燥箱中干燥5 h,称重为0.0057 g,计算交联度为3.39%。用同样的方法称取0.0489 g的b样品,浸泡在2%的醋酸溶液中12 h后在105 ℃的烘箱中烘5 h,称重为0.0484 g,计算交联度为1.02%。两种凝胶的交联度低,主要是因为加的交联剂甲醛特别少所致。
3.3 吸附的影响
3.3.1时间对吸附的影响
图6是两种壳聚糖/氧化石墨/SiO2和未加入氧化石墨的复合物的吸附量随时间的变化图。由图6可知,加入氧化石墨所制备的复合物对甲基橙的吸附量远远大于未加氧化石墨的壳聚糖/SiO2的吸附量。随着时间的延长,a的吸附量在90 min时达到最大68.96 mg/g,b的吸附量在90 min时达到最大55.98 mg/g。继续延长反应时间,吸附量不再随之增加,这是由于随着反应的进行,壳聚糖/氧化石墨/SiO2对甲基橙的吸附在起始阶段,壳聚糖凝胶上的吸附位点较多且溶液中甲基橙浓度大,吸附反应快速进行。随着反应的进行,壳聚糖凝胶上的吸附位点逐渐达到饱和状态,且溶液中甲基橙的浓度不断降低,与壳聚糖凝胶的接触机会降低,反应达到平衡状态。因此,壳聚糖/氧化石墨/SiO2对甲基橙的平衡吸附时间都为90 min,且a比b的吸附量更大。
3.3.2 初始浓度对吸附的影响
图7是两种壳聚糖/氧化石墨/SiO2和未加氧化石墨的吸附量随初始浓度的变化图。由图7可知,未加入氧化石墨所对应的凝胶的吸附量远远小于加入氧化石墨所生成的凝胶的吸附量。随着甲基橙初始浓度的增加,吸附量也增大。当a在20 mg/L时吸附量达到106.99 mg/g,随后趋于平衡。b样品随着甲基橙浓度的增大而增大,在25 mg/L时吸附量吸附量达到98.42 mg/g,随后趋于平衡。结果表明,在未达到壳聚糖/氧化石墨/SiO2的吸附平衡之前,随着甲基橙浓度的增大,可以提高壳聚糖/氧化石墨/SiO2吸附时的利用率,当达到最大吸附量后,继续增加甲基橙溶液的浓度会使吸附平衡中的解吸速率增大,不利于甲基橙在壳聚糖/氧化石墨/SiO2上的吸附。因此,反应的最佳初始浓度为20~25 mg/L,且在此条件下a的吸附量要大于b。
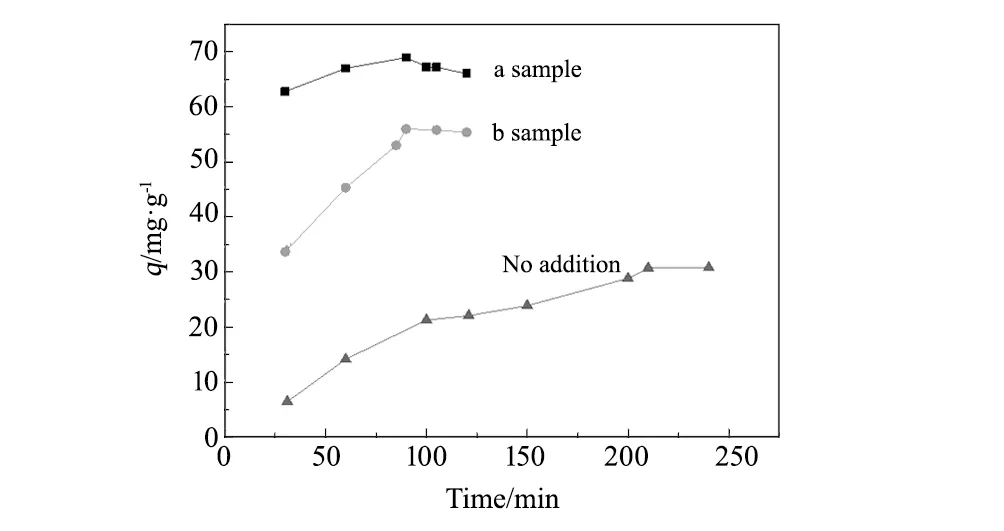
图6 吸附量随时间的变化曲线 Fig.6 Effect of time on adsorption

图7 初始浓度对吸附量的影响 Fig.7 Effect of initial concentration on adsorption
3.3.3 pH值对吸附的影响


图8 不同pH值与吸附量的关系 Fig.8 Effect of initial solution pH value on adsorption

图9 温度对吸附量的影响 Fig.9 Effect of temperature on adsorption
3.3.4 温度对吸附的影响
图9为温度对吸附量的影响图。由图9可知,a和b样品的吸附量远远大于没有加入氧化石墨所对应的凝胶的吸附量。随着温度的升高,壳聚糖/氧化石墨/SiO2对甲基橙的吸附量增大,在25 ℃时吸附量达到各自的最大值110.29 mg/g和105.91 mg/g,随后随着温度的升高,吸附量反而减小,25 ℃之后,无论在哪个温度下a的吸附量都大于b。这主要是因为在较低温度下,水的粘度大,分子运动的阻力大,布朗运动较弱,吸附量较少,随着温度的升高,由于该过程是吸热反应,有利于壳聚糖/氧化石墨/SiO2对甲基橙的吸附,当温度超过25 ℃时,随着温度的升高,溶液的溶解度增大,壳聚糖/氧化石墨/SiO2对甲基橙的吸附出现不稳定,不利于吸附[22]。因此,25 ℃是吸附的最佳温度,且在此温度下,a的吸附能力优于b。
3.3.5 不同温度下壳聚糖/氧化石墨/SiO2的吸附量随浓度的变化

图10 不同温度的壳聚糖/氧化石墨/SiO2吸附量随浓度的变化图 Fig.10 Effect of temperature and initial concentration of chitosan/graphite oxide/SiO2 on adsorption
图10为不同温度下壳聚糖/氧化石墨/SiO2(壳聚糖和正硅酸乙酯的质量比为1)的吸附量随浓度的变化图。由图10可知,无论在哪个温度下,吸附量开始阶段都是随着浓度的增大而增大。25 ℃下在20 mg/L趋于平衡,吸附量为是110.29 mg/g,20 ℃、35 ℃、45 ℃是在25 mg/L趋于平衡,并且达到各自的最大值分别为105.94 mg/g、83.33 mg/g、84.26 mg/g,随后趋于平衡。25 ℃比其他三个温度下在不同浓度条件下的吸附量都大,总体的情况是25 ℃大于20 ℃大于35 ℃大于45 ℃。这主要是因为开始阶段随着温度升高,分子运动的动能增大,易于接触吸附点位,吸附量增大,但随着温度升高,壳聚糖/氧化石墨/SiO2吸附甲基橙并不稳定,没有出现上升而趋于平衡。
3.4 吸附动力学和吸附等温线
利用准一级动力学和准二级动力学模型对实验数据进行拟合,在准一级动力学模型中以t为横坐标,lg(qe-qt)为纵坐标做图。并得出K1、qe和相关系数。在准二级动力学模型中以t为横坐标,t/qt为纵坐标做图得出K2、qe和相关系数。a样品、b样品的动力学模型参数见表3、表4。从表中可以得出,a、b样品的平衡吸附量的实验值和在拟二级的动力学模型中的理论值比较接近,且R2都在拟二级动力学模型的数值接近于1,a和b样品都和拟二级动力学模型拟合的比较好。

表3 a样品的动力学模型参数Table 3 Kinetic model parameters of a sample

表4 b样品的动力学模型参数Table 4 Kinetic model parameters of b sample
利用Langmuir模型方程和Freundlich模型方程对实验数据进行拟合,在Langmuir模型中以ce为横坐标,以ce/qe为纵坐标做图。得出qs、kL和相关系数。
在Freundlich模型中以Ince为横坐标,Inqe为纵坐标做图。得出kF、1/n和相关系数。从表5中可以得出a样品和Langmuir模型的拟合度较好,且有利于吸附的进行。a是均匀的单分子层吸附。从表6中可以得出b样品和Freundlich模型拟合的较好,b是不均匀的多分子层吸附。

表5 a样品的等温线模型参数Table 5 Isotherm model parameters of a sample

表6 b样品的等温线模型参数Table 6 Isotherm model parameters of b sample
4 结 论
两种壳聚糖/氧化石墨/SiO2(壳聚糖和正硅酸乙酯质量之比接近1的a样品和质量之比小于1的样品b)都具有溶胀性,且溶胀性能良好,含水量相近,两种交联度低主要是因为加入的交联剂甲醛特别少。
壳聚糖/SiO2具有一定的吸附性能,加入氧化石墨可以提高吸附性能,并且通过时间、甲基橙初始浓度、酸碱性、温度的变化对制备的两种壳聚糖/氧化石墨/SiO2的吸附性能进行了讨论。得出壳聚糖和正硅酸乙酯质量之比接近1的a样品的吸附性能优于质量之比小于1的样品b的,且在25 ℃,pH=3,a样品对20 mg/L的甲基橙吸附90 min时达到吸附平衡,且吸附量为110.29 mg/g。壳聚糖和正硅酸乙酯质量之比接近1的样品a和质量之比小于1的样品b均符合拟二级动力学模型。壳聚糖和正硅酸乙酯质量之比接近1的样品a符合Langmuir吸附模型,是均匀的单分子层吸附;壳聚糖和正硅酸乙酯质量之比小于1的样品b符合Freundlich吸附模型,是不均匀的多分子层吸附。
