硫氢化钠对糖尿病心肌病大鼠心脏保护作用及对JNK/FoxO1/Bcl-2信号通路的影响
2019-07-17易登良曾奇虎刘星王涛范忠才
易登良,曾奇虎,刘星,王涛,范忠才△
糖尿病心肌病(diabetic cardiomyopathy,DCM)是由长期慢性高血糖引起的心肌广泛代谢障碍性疾病,是糖尿病患者常见且严重的并发症之一。DCM主要病理特征为心肌肥厚及心肌间质纤维化,早期主要表现为无症状性心室舒张功能减退、顺应性下降,逐渐进展到心室收缩功能障碍,进而出现心力衰竭的症状,最终发展为难治性的心力衰竭。硫化氢(hydrogen sulfide,H2S)是一种内源性气体信号分子,在心肌细胞可通过胱硫醚-γ-裂解酶(CSE)影响L-半胱氨酸产生,对心血管具有保护作用[1]。研究发现,糖尿病大鼠模型血液循环中H2S 水平显著降低[2],且激活 CSE 蛋白可减轻 DCM 的心肌损伤[3]。此外,大量研究表明,外源性H2S可通过调控细胞凋亡、氧化应激、细胞自噬、炎症反应等通路来改善DCM大鼠心肌间质纤维化,保护心脏功能[4],然其具体机制仍不明确。故本实验通过建立DCM 大鼠模型,运用外源性H2S(以NaHS代替)干预来进一步探讨其对DCM的作用及相关机制。
1 资料与方法
1.1 一般资料 8 周龄SPF 级成年健康雄性SD 大鼠44 只,体质量(200±20)g,购自西南医科大学动物实验中心,所有操作均遵循西南医科大学实验动物操作规程,饲养期间自由进食及饮水;高糖高脂饲料(配方:10%猪油、20%蔗糖、6%蛋白粉、3%蛋黄粉、61%常规饲料)由成都达硕饲料公司提供,许可证编号:苏饲审(2009)05032;NaHS(13590)和链脲佐菌素(STZ,S0130)购自美国Sigma公司;BCA蛋白浓度测定试剂盒、RIPA 裂解液、苯甲基磺酰氟(PMSF)及Western blot 试剂盒购自上海碧云天生物技术有限公司;Bcl-2(ab692)兔抗大鼠单克隆抗体、p-FoxO1(ab47326)兔抗大鼠多克隆抗体、p-JNK(ab124956)兔抗大鼠单克隆抗体均购自Abcam 公司;本研究经医院伦理委员会批准,符合动物伦理相关规定。
1.2 造模及分组 实验采用析因设计方法,见表1。44 只实验动物均适应性喂养1周,随机数字表法抽取其中24只大鼠予以高糖高脂饮食喂养4 周,经禁食12 h 后一次性以STZ 40 mg/kg 腹腔注射,72 h 后使用罗氏卓越型快速血糖仪检测尾静脉血糖,以血糖值≥16.7 mmol/L为糖尿病造模成功,成功构建糖尿病大鼠模型19只,随后再以普通饮食喂养6周构建糖尿病心肌病模型。随机数字表法抽取16只DCM模型及16只正常大鼠,依干预方式不同分为4组:DCM+0.9%氯化钠组(DCM+Saline 组)、DCM+硫化氢组(DCM+NaHS 组)、正常大鼠+0.9%氯化钠组(Control+Saline 组)、正常大鼠+硫化氢组(Control+NaHS 组),每组8 只大鼠。随后DCM+NaHS 组和Control+NaHS 组大鼠腹腔注射NaHS 溶液100 μmol/(kg·d)(浓度12 mmol/L,体积8.3 mL/kg),DCM+Saline 组和Control+Saline组大鼠腹腔注射等量生理盐水,持续12周。
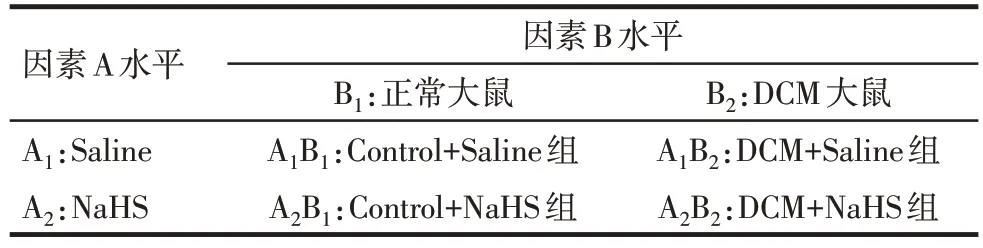
Tab.1 The experimental factors and levels and specific intervention programs of each treatment group表1 实验因素、水平及各处理组的具体干预方案
1.3 心脏超声检查 各组分别于实验干预结束后使用3%戊巴比妥钠50 mg/kg 麻醉,麻醉后行动物心脏超声检查,使用彩色多普勒超声显像仪(GE Vivid E9),探头频率3.5 MHz,主要记录的参数包括左室舒张末内径(LVIDd)、左室收缩末内径(LVIDs)、左室射血分数(LVEF)、左室缩短分数(LVFS)等。
1.4 心脏组织病理观察 各组大鼠在行心脏超声结束后随即处死,经胸骨正中逐层切开,取出心脏,用生理盐水清洗并分离心室肌,沿左室中线将心脏分为2部分,在心尖部取出厚度约2 mm 的心肌,于4%多聚甲醛溶液中固定并石蜡包埋,采用HE染色及Masson 染色制作成病理切片,普通光学显微镜(×200)下观察心脏组织病理学改变,使用Olympus cell Sens Standard 显微镜图像软件采集图像。余心脏组织冻存于-80 ℃。
1.5 使用 Western blot 法检测心脏组织Bcl-2、p-FOXO1、p-JNK蛋白表达 取心脏组织,每100 mg加入预冷组织裂解液1 mL,超声破碎仪中(冰浴)匀浆后离心取上清液,使用BCA法检测蛋白浓度。充分混合的上清加5×蛋白上样缓冲液后于100 ℃煮沸变性10 min,保存于-20 ℃冰箱。将变性好的组织样品冰上溶解后以20 μL 总蛋白样品上样,SDS-PAGE电泳后使用半干法转膜至PDVF 膜,用5%脱脂奶粉室温封闭1 h,洗去封闭液,洗膜3 次,每次8 min。分别加已稀释一抗兔抗大鼠 Bcl-2(1∶1 000)、p-FOXO1(1∶1 000)、p-JNK(1∶1 000)4 ℃孵育过夜,回收已稀释的一抗,用TBST(pH=7.6)洗膜3 次,每次8 min;运用HRP 标记的羊抗兔二抗(1∶3 000)37 ℃下孵育1 h,TBST洗膜3次,每次8 min,ECL显色、曝光,保存胶片。使用Quantity one软件分析目的条带光密度(OD)值,使用β-actin条带进行OD校正。
1.6 统计学方法 采用SPSS 18.0 统计软件进行数据分析。符合正态分布的计量资料以±s表示,采用2×2析因设计方差分析进行比较,以P<0.05为差异有统计学意义。
2 结果
实验干预过程中DCM+Saline组、DCM+NaHS组分别死亡1 只大鼠。DCM+Saline 组中的2 只大鼠、DCM+NaHS组中的1只大鼠未采集到合格的心脏超声图像。
2.1 各组心脏超声结果比较 糖尿病和硫氢化钠均对大鼠的心功能指标有影响,且存在交互作用(P<0.05);其中,与Control 组比较,DCM 组无论是否加用 NaHS 均可导致 LVEF、LVFS 下降,而 DCM+NaHS 组较 DCM+Saline 组的 LVEF、LVFS 明显升高(P<0.05),见图1,表2。

Fig.1 Comparison of ultrasonic cardiogram results between different rat heart groups图1 各组大鼠心脏超声结果比较
Tab.2 Comparison of ultrasonic cardiogram results between different rat heart groups表2 各组大鼠心脏超声结果比较 (±s)
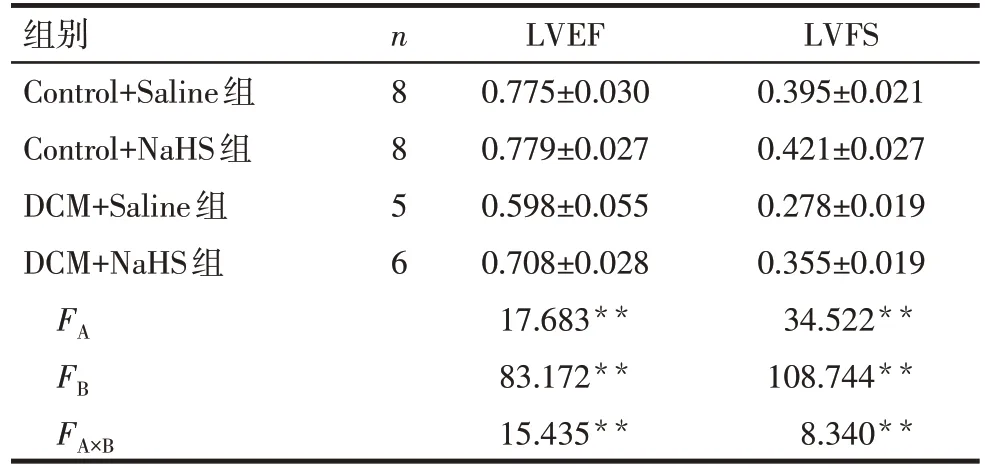
Tab.2 Comparison of ultrasonic cardiogram results between different rat heart groups表2 各组大鼠心脏超声结果比较 (±s)
**P<0.01;组间多重比较各指标差异均有统计学意义
组别Control+Saline组Control+NaHS组DCM+Saline组DCM+NaHS组n8856 FAFB FA×B LVEF 0.775±0.030 0.779±0.027 0.598±0.055 0.708±0.028 17.683**83.172**15.435**LVFS 0.395±0.021 0.421±0.027 0.278±0.019 0.355±0.019 34.522**108.744**8.340**
2.2 各组心脏组织病理改变 Control+Saline 组、Control+NaHS 组大鼠心肌细胞形态规则、胶原排列整齐;DCM+Saline 组大鼠心肌细胞明显肥大,胶原排列紊乱,心肌间蓝染的胶原纤维增加;而DCM+NaHS 组较DCM+Saline 组相比,心肌细胞肥大及胶原排列紊乱得到改善,见图2、3。
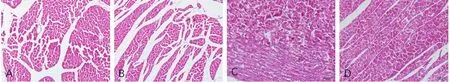
Fig.2 Comparison of pathological results between different rat heart groups(HE staining,×200)图2 各组心脏组织病理组织的改变情况(HE染色,×200)

Fig.3 Comparison of pathological results between different rat heart groups(Masson staining,×200)图3 各组心脏组织病理组织的改变情况(Masson染色,×200)
2.3 各组心脏组织p-JNK、p-FoxO1、Bcl-2 蛋白的表达水平比较 糖尿病和硫氢化钠对大鼠心脏组织p-JNK、p-FoxO1、Bcl-2 蛋白的表达均有影响,且对p-FoxO1、p-JNK 表达存在交互作用(P<0.05)。其中,与Control+Saline 组比较,DCM 组无论是否加用NaHS,均存在p-JNK表达明显增加,Bcl-2、p-FoxO1表达明显下降(P<0.05);而Control+NaHS 组对p-JNK蛋白表达无影响(P>0.05),但可使Bcl-2蛋白、p-FOXO1 蛋白表达增加(P<0.05);此外,DCM+NaHS 组 p-JNK 表达下降,Bcl-2、p-FOXO1 表达增加(P<0.05),见图4、表3。
3 讨论
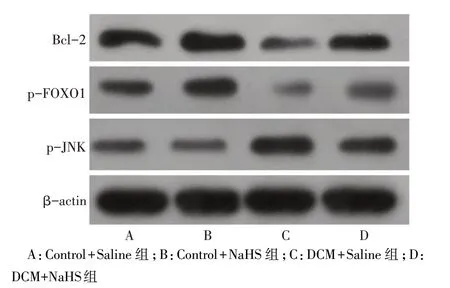
Fig.4 Expression of Bcl-2,p-JNK and p-FOXO1 in rat heart in four groups图4 各组大鼠心脏组织Bcl-2、p-JNK、p-FOXO1蛋白表达情况
Tab.3 Expression of Bcl-2,p-JNK and p-FOXO1 in rat heart in four groups表3 各组心脏组织Bcl-2、p-JNK、p-FOXO1表达情况比较 (±s)
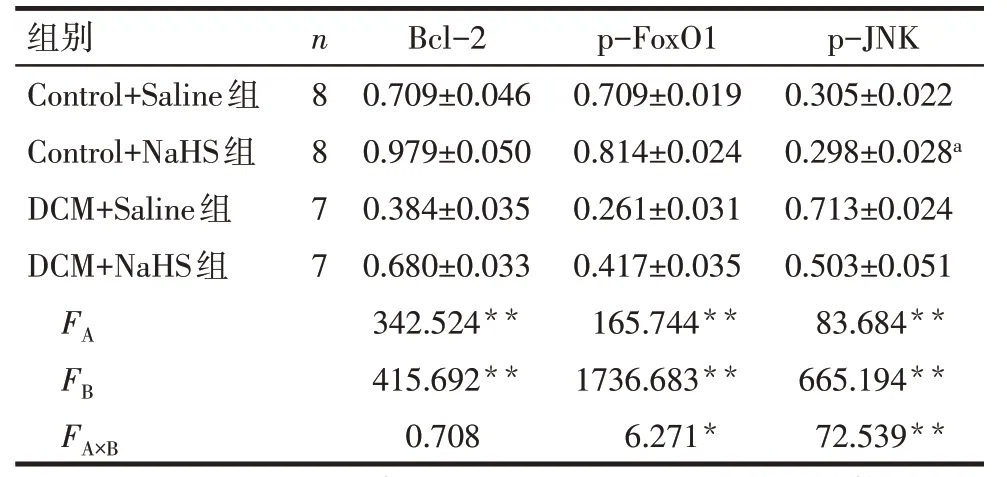
Tab.3 Expression of Bcl-2,p-JNK and p-FOXO1 in rat heart in four groups表3 各组心脏组织Bcl-2、p-JNK、p-FOXO1表达情况比较 (±s)
*P<0.05,**P<0.01;a与Control+Saline组p-JNK组间比较差异无统计学意义,其他各指标组间多重比较差异均有统计学意义
?
DCM 是糖尿病常见且严重的并发症,可导致患者心脏舒缩功能受损,出现心力衰竭、心律失常、甚至猝死[4]。现在越来越多的证据表明,外源性H2S可以改善 DCM 心脏功能[5]。本研究结果显示,与Control 组比较,DCM 组无论是否加用 NaHS 均可导致LVEF、LVFS下降、心肌组织肥大、胶原排列紊乱、心肌间蓝染的胶原纤维增加,表明糖尿病心肌病的确存在心脏病理组织及舒缩功能的受损;此外,DCM+NaHS 组的 LVEF、LVFS 较 DCM+Saline 组明显升高,心肌病理组织学变化得到明显改善,同样也表明了NaHS 对DCM 大鼠心脏的保护作用,但目前其具体机制仍不明确。
细胞凋亡是基因控制细胞的自主的有序的死亡过程,具有明显的形态学特征,包括细胞体积缩小、线粒体膜电位下降、染色体凝聚和DNA 片段化等,在机体内受到多种细胞内外因素调节,其在心血管疾病的发生发展中扮演着重要的角色[6]。Caspase家族是促进细胞发生凋亡的主要酶类,通过Caspase基因层层激活,最终导致细胞凋亡,是一切凋亡传导的共同信号通路,其中以Caspase-3最为关键[7]。研究发现,通过对DCM 心肌组织行TUNEL 法检测可见DNA 链普遍断裂,蛋白电泳可见Caspase-3 蛋白表达明显增加,均证实了凋亡与DCM 密切相关[8]。此外,研究显示在DCM大鼠模型中抗凋亡基因Bcl-2 mRNA 表达下降、促凋亡基因Bax mRNA 表达增加,而外源性H2S 干预可以上调Bcl-2 mRNA 表达、下调Bax mRNA表达保护心脏功能[9]。本实验显示,糖尿病和硫氢化钠对大鼠心脏组织Bcl-2 蛋白的表达均有影响,但两者不存在交互作用;其中,与Control+Saline 组比较,DCM+Saline 组的 Bcl-2 蛋白表达减少,与 DCM+Saline 组比较,DCM+NaHS 组Bcl-2蛋白表达增加,提示NaHS 可能通过激活Bcl-2,抑制细胞凋亡,保护心脏功能。
FoxO1 转录因子隶属于叉头转录因子(FOXO)亚家族,主要调控细胞增殖、分化、凋亡、DNA 损伤/修复、氧化应激、糖代谢等相关机制,在DCM的发生发展中扮演着重要的角色[10]。其中PI3K/AKT 信号通路可以使FoxO1 磷酸化及去磷酸化,磷酸化时FoxO1 由细胞质进入细胞核与靶基因相应区域结合,激活转录活性从而行使其转录功能[11]。研究发现,FoxO1 可以解除 PPAR-γ2 对 GluT-4 基因的阻遏,促进GluT-4 的表达,改善糖代谢[12];此外,在2型糖尿病中FoxO1 的去磷酸化增加,并可协同NF-κB 上调炎症因子IL-1β 的表达,进而损坏胰岛β 细胞的功能。本实验结果显示,糖尿病和硫氢化钠对大鼠心脏组织p-FoxO1 蛋白的表达均有影响,两者存在交互作用;其中,与Control+Saline 组比较,DCM+Saline 组的p-FoxO1 蛋白表达减少,与DCM+Saline 组比较,DCM+NaHS 组 p-FoxO1 蛋白表达增加,提示NaHS 对心脏的保护作用可能通过过表达FoxO1蛋白来发挥作用。
c-Jun 氨基末端激酶(JNK)是丝裂原活化蛋白激酶中的一个亚类,参与细胞增殖与分化、细胞形态维持、细胞凋亡与恶变等多种生物学反应,其中在心肌细胞中JNK 是细胞凋亡发生的一个关键因子[13]。Liu等[14]研究发现,糖尿病组大鼠心肌组织中的JNK表达水平较正常组明显增加,提示JNK 通路可能加速了糖尿病心肌纤维化的进展。此外也有研究提出高糖增加了AC16 人类心肌细胞内源性JNK 及Caspase-3 的表达,而使用 JNK 阻断剂 SP600125 则抑制了细胞凋亡及Caspase-3的活化,提示JNK通路可能是治疗DCM的新靶点[15]。本实验发现,糖尿病和硫氢化钠对大鼠心脏组织p-JNK蛋白的表达均有影响,两者存在交互作用,其中,与Control+Saline 组比较,DCM+Saline 组的p-JNK 蛋白表达增加,与DCM+Saline 组比较,DCM+NaHS 组p-JNK蛋白表达减少,提示NaHS 对心脏的保护作用可能通过下调JNK蛋白的表达来发挥作用。
综上所述,DCM 所致的心肌损伤与细胞凋亡密切相关,外源性H2S可以改善DCM的心肌损伤,保护心脏功能,其可能通过作用于JNK/FoxO1/Bcl-2信号通路实现。但本实验仅初步探讨了H2S在DCM中对相关分子的影响及作用,其具体机制及相关信号通路仍需要深入研究。
