内镜黏膜下剥离术治疗早期胃食管结合部癌的短期疗效分析
2019-07-17施信荣孙斌王亚雷
施信荣,孙斌,王亚雷△
近年来,胃食管结合部癌(adenocarcinomas of the esophagogastric junction,AEG)的发生率逐渐上升[1]。研究显示发生在胃食管结合部的腺癌占胃癌的一半以上[2]。随着内镜诊断和治疗技术的发展,越来越多的胃食管结合部癌在早期即可被发现,同时部分早期病变可以达到完整切除。但内镜治疗存在一定的局限性,即只能做局部切除,不能进行周围淋巴结的清扫,从而存在潜在的淋巴结转移(lymph node metastasis,LNM)风险。笔者回顾性分析了安徽医科大学第一附属医院近年接受内镜治疗的早期胃食管结合部癌患者的临床资料,旨在进一步了解内镜切除治疗AEG的短期安全性和有效性。
1 对象与方法
1.1 研究对象 收集安徽医科大学第一附属医院消化内科2016年4月—2018年10月期间收治的早期AEG患者180例,纳入标准:(1)符合伦理要求,术前进行大手术审批,患者自愿接受治疗,并签署知情同意书。(2)行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗。排除标准:(1)临床资料不完整,ESD治疗术后病理未报告切缘是否阴性或追加手术治疗资料无法收集。(2)术后随访拒绝复查胃镜、计算机断层扫描等,或随访期间失联。最终纳入AEG 患者166例。
1.2 相关判定标准
1.2.1 病变位置 根据Siewert分型[3-4]:AEGⅠ型,肿瘤中心位置在食管胃连接部上1~5 cm范围内;AEGⅡ型,肿瘤中心位置在食管胃连接部上1 cm和下2 cm之间;AEG Ⅲ型,肿瘤中心位置在食管胃连接部下2~5 cm范围内。
1.2.2 病变形态分型 按Paris 分型[5]将病变的肉眼类型分为浅表隆起型(Ⅰ型)、浅表平坦型[Ⅱ型,进一步分为Ⅱa(平坦隆起型),Ⅱb(平坦型),Ⅱc(平坦凹陷型)]、浅表凹陷型(Ⅲ型)。本研究将Ⅰ、Ⅱa和Ⅱa+Ⅱb归为隆起型,Ⅱc、Ⅱa+Ⅱc型归为凹陷型,Ⅱb型归为平坦型。
1.2.3 病变病理组织学分型 本研究分为分化型癌和未分化型癌。分化型癌包括高级别上皮内瘤变(high grade intraepithelial neoplasim,HGIN)、高分化管状腺癌、中分化管状腺癌、分化型为主的混合型癌。未分化型癌包括低分化腺癌、印戒细胞癌、黏液细胞癌、未分化型为主的混合型癌。
1.2.4 浸润深度 根据术后病理结果,分为黏膜层癌(mucosa,M)及黏膜下层癌(submucosa,SM)[6]。SM 又分为SM1(病变超过黏膜下层,深度<500 μm)和 SM2 及以上(病变超过黏膜下层,深度≥500 μm)。
1.3 手术方法 患者全麻下气管插管,奥林巴斯GIF-H260Z放大观察病灶,确定病灶边界后换GIF-Q260J 治疗胃镜,沿病灶边缘0.5 mm 处标记,黏膜下注射生理盐水+玻璃酸钠+靛胭脂混合液,病灶抬举良好,一次性黏膜切开刀沿标记点外做环周切开,行黏膜下剥离,直至病灶完整剥离,创面用热活检钳充分止血,随镜取出标本固定后送检。
1.4 手术效果评价 本研究按早期胃癌(early gastric cancer,EGC)内镜下切除适应证标准[7],将患者的内镜治疗结果分为完全切除、治愈性切除、相对治愈性切除和非治愈性切除。完全切除是指水平和垂直切缘均为阴性的整块切除。治愈性切除是指病灶整块切除,直径≤2 cm、垂直切缘与水平切缘阴性、无合并溃疡且无脉管浸润的分化型黏膜内癌。相对治愈性切除是指病灶整块切除,水平切缘和垂直切缘均为阴性,且满足以下条件:直径>2 cm,无溃疡的分化型黏膜内癌;直径≤3 cm,可伴溃疡的分化型黏膜内癌;直径≤2 cm,无溃疡的未分化型黏膜内癌;直径≤3cm,分化型浅层黏膜下癌(SM1 以内)。非治愈性切除是指治愈性切除和相对治愈性切除以外的早期胃癌的内镜下切除。
1.5 术后病理评分 按照日本eCrua 评分系统[8],对患者的ESD 术后病理结果进行评分。eCrua 评分系统包括:肿瘤大小>30 mm(1分),黏膜下浸润≥500 μm(1分),垂直边缘阳性(1 分),淋巴管阳性(3 分),静脉浸润(1 分)。积分累加后分为eCura A(0~1 分)、eCura B(2~4 分)、eCura C-1(0~4 分;符合eCura A 或B 的其他条件,但未实现完整切除或水平切缘为阳性)、eCura C-2(5~7分)。
1.6 随访 对治愈性切除的患者,于术后第3、6、12 个月进行内镜随访[7],此后每年复查1次胃镜,并进行肿瘤标志物和CT等相关影像学检查。对非治愈性切除的患者,建议行“全胃切除+淋巴结清扫术”。患者按个人意愿决定是否追加治疗。本次研究截至2018年12月对所有患者均进行了电话随访,随访周期3~33个月,平均随访时间15.7个月。
1.7 统计学方法 所有数据应用SPSS 21.0软件进行统计分析,符合正态分布的计量资料以均数±标准差表示,组间比较采用两独立样本t检验,计数资料以例(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料 166 例AEG 患者中男135 例,女31例,平均年龄(66.0±8.4)岁。病变位置:AEG Ⅱ型 123 例,AEG Ⅲ型 43 例。肿瘤大小(18.6±11.5)mm;病变形态:隆起型39 例,平坦型11 例,凹陷型116例。病理类型:分化型164例,未分化型2例;有16例合并溃疡。
2.2 手术疗效 166 例患者中完全切除162 例(97.6%),治愈性切除146例(88.0%),非治愈性切除20例。非治愈性切除患者中9例在ESD后1个月内追加手术治疗,手术病理结果显示1 例发现胃体大弯侧中度危险间质瘤,3 例局部有肿瘤残留,其中1例见1 枚淋巴结转移,余5 例无肿瘤残留,未见淋巴结转移。
2.3 治愈性切除组与非治愈性切除组临床资料比较 2 组患者性别、年龄、病变部位、病变形态差异无统计学意义(P>0.05),非治愈性切除组中病变直径>30 mm、合并溃疡、未分化型患者比例高于治愈性切除组(P<0.05),见表1。
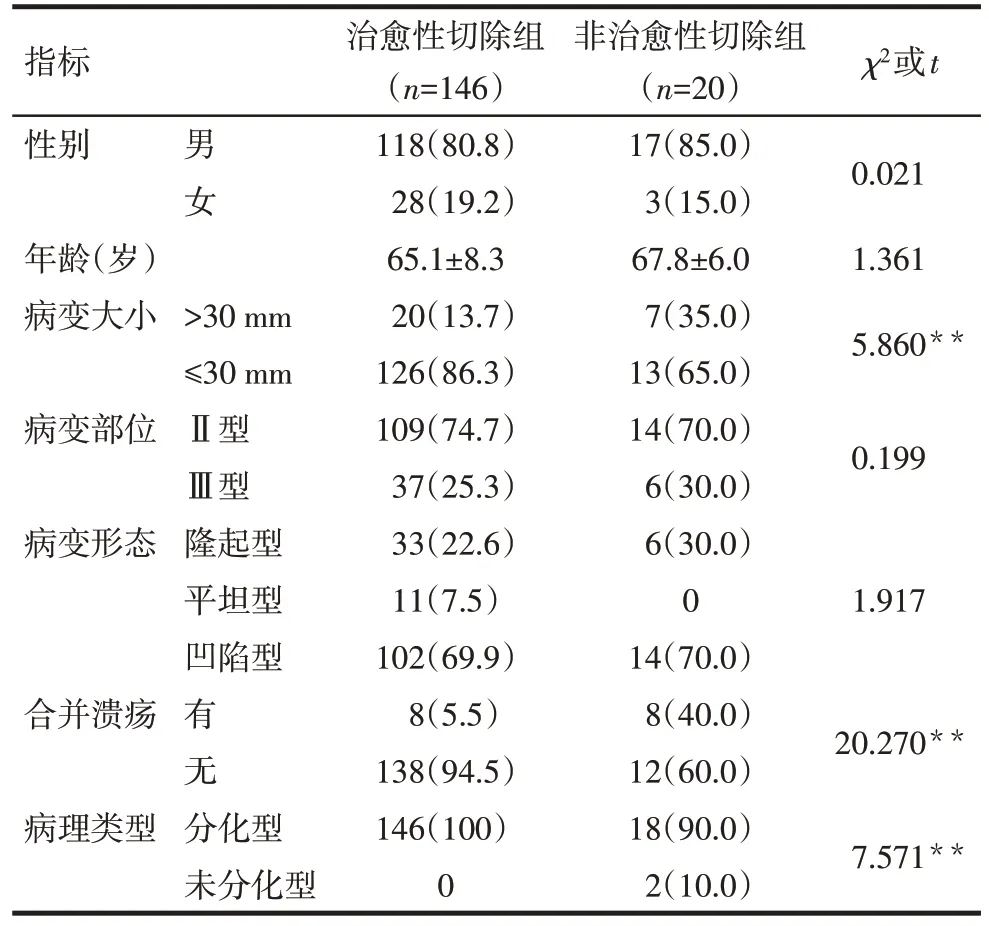
Tab.1 Comparison of the clinical characteristics between curative resection group and the non-curative resection group表1 治愈性切除组与非治愈性切除组临床特征比较例(%)
2.4 术后并发症 1例ESD 治疗后第3天出现感染性发热,经抗感染治疗后治愈;2 例ESD 治疗2 周出现迟发性出血,经内镜电凝、钛夹止血治疗后未再出血;1 例ESD 治疗后1 个月出现狭窄,经内镜下球囊扩张治疗好转;2例患者损伤肌层,予钛夹封闭。
2.5 随访情况 157例ESD治疗后未追加手术患者中随访3~6个月者11例,随访期间未发现肿瘤复发转移,无死亡病例;随访 7~12 个月者 55 例,1 例同时合并肝门部胆管癌,于ESD 治疗1 个月后行肝门部胆管癌根治术;随访 13~24 个月者 48 例,1 例非治愈性切除患者复查胃镜发现肿瘤局部复发(HIGN伴局部癌变),建议再次手术,患者因个人因素未同意;随访25~33 个月者43 例,随访期间未发现肿瘤复发转移,无死亡病例。9 例非治愈性切除患者追加手术后随访 3~6 个月者 3 例,7~12 个月者 3 例,13~24个月者2例,25~32个月者1例,随访期间未发现复发转移和死亡病例。
2.6 eCura 系统评分分层结果 按eCura 评分系统评分,eCura A组156例、eCura B组6例,2组共有6例接受追加“全胃切除术+淋巴结清扫”手术治疗,均未发现LNM,eCura B组有1例局部肿瘤残留,1例发现同时性癌(胃体间质瘤);eCura C共4例,3例接受追加手术治疗,术后病理证实2例有肿瘤残留,其中1例有淋巴结转移,另1例未追加手术的患者在随访期间局部肿瘤复发。
3 讨论
胃癌是我国发病率、死亡率都极高的恶性肿瘤。2013年,安徽省肿瘤登记地区胃癌的新发病例数为8 752 例,发病率为50.34/10 万,死亡率为33.57/10万;从发病部位来看,2011—2013年AEG 占胃癌的比例从48.6%上升到55.1%,发病率逐年上升[2]。而我院的资料显示,近两年经内镜治疗的早期胃癌病例中,AEG 所占比例也达到55.3%(结果待发表)。所以我们应高度重视早期胃癌,尤其是早期AEG的内镜诊断和治疗。
本研究结果显示,早期AEG患者接受ESD治疗后病变完整切除率达97.6%,治愈性切除率为88.0%,并发症发生率2.4%,肿瘤局部复发率0.6%。日本的研究显示,对位于胃食管结合部和贲门的浅表腺癌ESD 治疗,完整切除率为96%,治愈性切除率86.7%,并发症发生率为1.3%[9]。一项欧美的Meta 分析结果显示,早期胃癌接受ESD 治疗完整切除率为90.91%,治愈性切除率为86.36%,穿孔并发症发生率为 4.3%[10]。国内李宗先等[11]研究也显示早期胃癌ESD治疗在完整切除率90.91%,治愈性切除率86.36%,并发症的发生率为4.5%。本研究与国内外其他中心的治疗结果类似,提示对于早期AEG采用内镜下切除治疗安全性好,并发症少,短期疗效较好。
对早期胃癌内镜治疗的效果,目前主要根据内镜治疗的适应证将治疗结果分为治愈性切除、相对治愈性切除和非治愈性切除。对于“非治愈性切除”的患者,由于存在较高的淋巴结转移风险,故建议追加手术。本研究发现,非治愈性切除组中病变直径>30 mm、合并溃疡、未分化型较多见。这与国内外相关研究结果类似[8],提示对于这样的病变进行内镜下切除治疗需持慎重的态度。
本研究中非治愈性切除患者共20 例,仅9 例患者接受了手术治疗,3 例有局部癌残留,其中1 例有淋巴结转移,另有1例合并胃体间质瘤,未行手术治疗的患者至随访截止日期仅有1例发生肿瘤局部复发。日本的研究也显示,非治愈性切除追加手术的患者出现淋巴结转移的比例仅为 5%~10%[8,12-13]。所以对于非治愈性切除的患者,淋巴结转移的风险并不完全相同,简单“一刀切”行手术切除,可能并非最佳选择。
近期日本专家提出了eCura 评分系统对内镜切除术后 LNM 风险度进行分层分析[8,14-15]。该评分系统根据患者术后的病理结果,从病变大小、浸润深度、病理类型、垂直切缘阳性等因素,对早期胃癌ESD治疗后存在淋巴结转移的潜在风险进行量化评分分级,将LNM 的风险分为低(0~1 分)、中(2~4分)、高(5~7 分),每个风险类别的LNM 比例分别为2.5%、6.7%和22.7%[8]。按此评分系统将本研究中166例患者进行评分后,笔者发现,eCura A组、eCura B 组接受追加手术治疗的6 例患者术后病理均未发现 LNM,其中 eCura B 组 1 例癌残留,1 例同时性癌;eCura C 组中3 例接受追加手术治疗,术后病理证实1 例有LNM,2 例有癌残留,另1 例未追加手术的患者在6个月随访期间局部肿瘤复发。这说明ESD术后采用eCura 评分可以对患者淋巴结转移的风险进行较好的分层评估。对于低风险的患者,由于其淋巴结转移的风险相对较低,采用随访观察可能是一个可接受的选择;对于高风险的患者,则强烈建议追加手术。与简单地将治疗结果分为治愈性和非治愈性切除相比,eCura 评分能更好、更量化地预测非治愈性切除患者的LNM风险,为患者治疗方案的选择提供了较为充分的证据。
总之,对于符合治疗适应证的早期AEG 采用ESD 治疗是安全、有效的。术后结合病理结果对患者进行eCura 评分可以较好地评估其淋巴结转移的风险,从而对非治愈性切除患者进行分层管理,提供个体化治疗策略。
