硫酸右旋糖苷对人胃癌MGC-803细胞增殖和凋亡的影响
2019-07-17王文莙曹相玫马艳梅杨媛媛徐远义黄允宁
王文莙,曹相玫,马艳梅,杨媛媛,徐远义△,黄允宁
胃癌已成为癌症死亡的第三大病因,其5年生存率低于25%[1-2]。目前,临床上治疗胃癌以外科手术为主,但部分胃癌患者发现已是晚期,错失手术机会。因此,寻找低毒、高效的治疗胃癌的药物具有重要意义。研究表明硫酸右旋糖苷(DS)作为低毒药物能抑制黑色素瘤的转移[3]。本课题组前期体内外实验研究表明,DS 能减少胃癌血管生成,减少裸鼠胃癌腹腔种植转移瘤结节数量和体积[4]。但DS 对胃癌细胞增殖和凋亡的影响及其机制鲜有报道。本研究旨在观察DS对人胃癌MGC-803细胞增殖和凋亡的影响,从而为研发胃癌新的治疗策略提供参考。
1 材料与方法
1.1 材料 人胃癌细胞株(MGC-803)购自北京金紫晶生物医药技术有限公司;RPMI-1640 培养液购自美国Hyclone 公司;胎牛血清购自Fumeng Gene公司;0.25%胰蛋白酶-EDTA消化液、青霉素/链霉素均购自北京Solarbio 公司。DS 购自Sigma公司,将DS溶于磷酸盐缓冲液(PBS)用于细胞培养,用22 μm 的过滤器进行无菌过滤,最终使用质量分数为0.3%。总蛋白提取试剂盒购自Omega 公司;BCA 蛋白定量试剂盒、SDS-PAGE 凝胶配制试剂盒、EdU 试剂盒均购自凯基生物公司。AnnexinV-PI 凋亡试剂盒购自贝博公司;Zeste 增强子同源物2(enhancer zeste of homolog 2,EZH2)单克隆抗体(兔抗人)和Cleaved-caspase3 单克隆抗体(兔抗人)均购自Cell Signaling Technology 公司。β-Tublin单克隆抗体(鼠抗人)购自康为世纪公司;辣根过氧化物酶(HRP)标记山羊抗兔多克隆抗体和山羊抗鼠多克隆抗体购自北京中杉金桥生物技术有限公司。荧光显微镜购自Olympus 公司;CO2培养箱购自Formal Scientific 公司;高速低温离心机购自Thermo Fisher Scientific公司,流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 细胞培养 人胃癌MGC-803细胞培养于含10%胎牛血清和1%青霉素/链霉素的RPMI-1640完全培养基中,置于37 ℃、5%CO2饱和湿度的培养箱培养,每2~3 d 换液1 次,待细胞接近融合时用0.25%胰酶消化传代。收集对数生长期细胞并计数,传于60 mm培养皿中,待细胞贴壁稳定后,于对照组及实验组分别加入等体积PBS和DS(终浓度0.3%)放置于常氧培养箱,培养2、8、12、24 h收集细胞备检;24孔板进行爬片,药物浓度同上。
1.2.2 EdU实验 收集对数生长期胃癌MGC-803细胞,将细胞密度调整为8×105个/mL,以400 μL/孔接种于24 孔板置于培养箱中培养,进行细胞爬片。贴壁后实验组进行DS干预,对照组加入等体积的PBS。干预24 h 后按照EdU 试剂盒说明书进行操作,EdU 溶液孵育2 h 后用4%多聚甲醛固定,0.5%Triton X-100 作为促渗剂,Click-It 反应物进行染色,用Hoechst 进行DNA 复染;采用荧光显微镜避光采图。蓝色荧光标记细胞总数,红色荧光标记增殖的细胞,细胞增殖率=红色荧光细胞数/蓝色荧光细胞数×100%。
1.2.3 平板克隆形成实验 收集对数生长期胃癌MGC-803细胞,按每个培养皿800 个细胞接种于含培养基的60 mm 皿中,混匀后放入培养箱培养,过夜贴壁后实验组进行DS 干预,对照组加入等量的PBS。干预24 h 后更换为完全培养基,每3~4 d 更换培养基,培育12 d。PBS 冲洗,4%多聚甲醛固定、结晶紫染色、拍照后使用Image-Pro Plus计算每个皿中细胞克隆形成数目。
1.2.4 流式细胞仪检测 收集处于对数生长期的人胃癌MGC-803细胞,制备单细胞悬液,接种于25 cm2的培养瓶中,待过夜贴壁后弃去旧培养基,实验组加入含0.3%DS的培养基,对照组加入含有等体积PBS的培养基,置于37 ℃、5%CO2的培养箱中培养24 h,收集细胞上清液,用冷的PBS 洗3 遍,用不含EDTA 的胰蛋白酶消化并收集细胞,其余步骤按照AnnexinV-PI凋亡试剂盒说明书进行操作,于1 h内进行流式细胞仪检测并分析细胞凋亡情况。
1.2.5 蛋白免疫印迹 将人胃癌MGC-803 细胞接种到60 mm 的培养皿中,过夜贴壁后实验组加入含有药物浓度为0.3%DS的培养基,对照组加入含有等量PBS的培养基,收集干预不同的时间点(2、8、12、24 h)的各组细胞,提取细胞蛋白,应用BCA法测定蛋白含量。蛋白免疫印迹(Western blot)中各组上样60 μg(20 μL)蛋白进行8%SDS-PAGE电泳,80 V(20 min),120 V(40 min)恒压湿转PVDF膜,转膜后用10%脱脂牛奶封闭,兔抗人 EZH2(1∶1 000)、兔抗人 Cleavedcaspase3(1∶1 000)和鼠抗人β-Tublin(1∶2 000)一抗4 ℃孵育过夜,TBST震荡洗涤3次,以TBST稀释的HRP标记的山羊抗兔及山羊抗鼠IgG 二抗(1∶5 000)室温孵育1 h,TBST 震荡洗涤3次后ECL化学发光显影,曝光采图,用Photoshop CC 2017软件进行灰度值分析,用目的条带灰度值/内参灰度值进行蛋白定量。
1.3 统计学方法 采用IBM SPSS 21.0统计软件进行统计学分析,计量资料均以均数±标准差(±s)表示,各独立实验均重复3次,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 DS对MGC-803细胞增殖的抑制作用 EdU实验结果显示,实验组细胞增殖率较对照组明显降低,差异有统计学意义(P<0.01),见图1、表1。
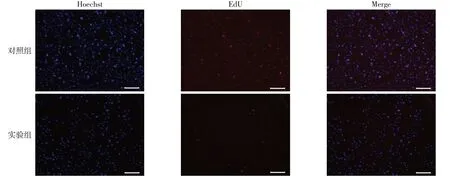
Fig.1 The effect of DS on the proliferation of MGC-803 cells(scale bar=100 μm)图1 DS对MGC-803细胞增殖的影响(比例尺为100 μm)
2.2 DS对MGC-803细胞集落形成的抑制作用 平板克隆形成实验结果显示,与对照组相比,实验组新克隆形成数量明显减少(P<0.01),克隆球形成较小且染色较浅,见图2、表1。
2.3 DS对胃癌MGC-803细胞凋亡的促进作用 流式细胞仪检测发现,实验组细胞凋亡率明显高于对照组(P<0.01),见图3、表1。
2.4 DS 对 EZH2、Cleaved-caspase3 蛋白表达的影响 Western blot 结果显示,与对照组相比,实验组EZH2蛋白水平在2 h无明显变化,8、12、24 h明显降低(P<0.05);Cleaved-caspase3蛋白水平在2、8、12、24 h较对照组明显增加(P<0.05),见图4、表2。
Tab.1 The effects of DS on proliferation,colony formation and apoptosis of MGC-803 cells表1 DS对MGC-803细胞增殖、克隆形成及凋亡的影响(n=3,±s)
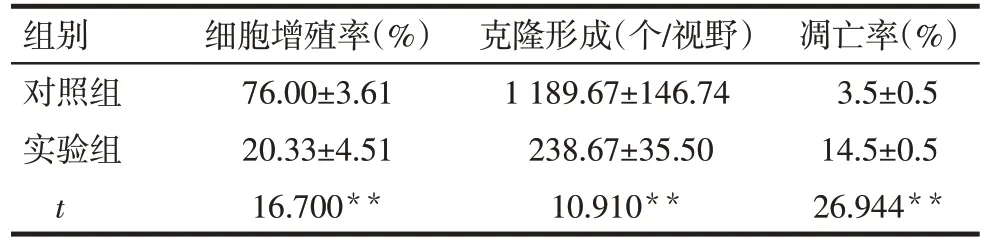
Tab.1 The effects of DS on proliferation,colony formation and apoptosis of MGC-803 cells表1 DS对MGC-803细胞增殖、克隆形成及凋亡的影响(n=3,±s)
**P<0.01
组别对照组实验组t细胞增殖率(%)76.00±3.61 20.33±4.51 16.700**克隆形成(个/视野)1 189.67±146.74 238.67±35.50 10.910**凋亡率(%)3.5±0.5 14.5±0.5 26.944**
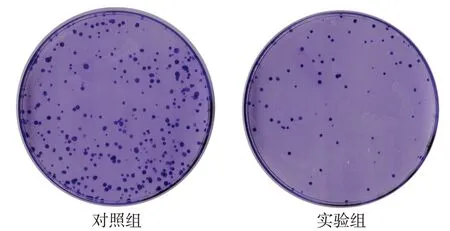
Fig.2 The effect of DS on colony forming ability of MGC-803 cells图2 DS对MGC-803细胞集落形成能力的影响

Fig.3 The effect of DS on cell apoptosis of MGC-803 cells图3 DS对MGC-803细胞凋亡的影响
3 讨论
胃癌是世界范围内常见的三大癌症死亡原因之一[5],如今,胃癌在亚洲具有较高的发病率和死亡率[6],由于大多数胃癌在明确诊断时已发展至中晚期,因此,化疗成为胃癌治疗的方法之一[7]。因传统的化疗药物易耐药且不良反应大,因此,寻找低毒、高效、不良反应小的药物具有重大意义。
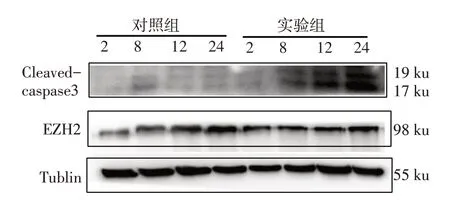
Fig.4 The protein expression levels of EZH2 and Cleaved-caspase3 detected by Western blot assay图4 Western blot检测EZH2、cleaved-caspase3蛋白的表达
Tab.2 The protein expression levels of EZH2 and Cleaved-caspase3 detected by Western blot assay表2 Western blot检测EZH2、Cleaved-caspase3蛋白的表达 (n=3,±s)

Tab.2 The protein expression levels of EZH2 and Cleaved-caspase3 detected by Western blot assay表2 Western blot检测EZH2、Cleaved-caspase3蛋白的表达 (n=3,±s)
*P<0.05,**P<0.01
组别对照组实验组t EZH2蛋白相对表达量2 h 0.82±0.08 0.72±0.17 0.983 8 h 1.05±0.15 0.72±0.10 3.143*12 h 1.07±0.11 0.52±0.12 5.910**24 h 0.95±0.18 0.35±0.27 3.581*组别对照组实验组t Cleaved-caspase3蛋白相对表达量2 h 0.31±0.06 0.58±0.12 3.584*8 h 0.53±0.05 0.76±0.01 7.271*12 h 0.38±0.01 0.92±0.01 77.534**24 h 0.46±0.01 0.97±0.02 36.524**
本课题组采用的抗癌药物DS 属于大分子硫酸右旋糖苷衍生物,相对分子质量为5×105,具有安全性高、不良反应小、腹腔吸收慢等优点[8]。本课题组前期体内外研究表明,DS 有抑制胃癌细胞血管生成,抑制裸鼠胃癌腹腔种植转移的作用[4]。前期研究发现DS 与LOX 抑制剂β-氨基丙腈(BAPN)联合应用后抑制胃癌细胞侵袭和转移的效果较单独使用DS 或BAPN 更明显,本研究在前期课题组研究的基础上选取最佳药物浓度0.3%DS作为干预剂量[9],结果表明DS 能明显抑制MGC-803 细胞的增殖,减弱细胞集落形成能力并诱导MGC-803 细胞凋亡。表观遗传在肿瘤的进展当中发挥重要作用,表观遗传学调控失调是恶性肿瘤的一大特点,包括DNA和组蛋白的甲基化[10]。表观遗传调控因子EZH2 是PRC2(polycomb repressor complex 2)基因沉默复合物的核心成员,具有甲基转移酶活性,可催化组蛋白H3K27三甲基化和异染色质形成从而介导抑癌基因表达沉默[11]。研究发现,EZH2 在膀胱癌[12]、结直肠癌[13]、卵巢癌[14-15]、肺癌等[16]实体肿瘤中高表达并与肿瘤的发生、发展、转移及预后密切相关。EZH2 通过调控增殖相关基因的转录,影响肿瘤的生长;在胶质瘤中,下调EZH2 可以抑制胶质瘤细胞的增殖[17-18],除此之外EZH2 还参与凋亡的相关调控,下调EZH2 可以激活凋亡相关蛋白表达[19]。研究发现,敲减EZH2可使胶质瘤细胞中caspase3的活性升高,细胞凋亡率明显增高[20]。Cleaved-caspase3是细胞凋亡相关的蛋白Caspases3的激活体,在细胞凋亡中起着决定性的作用[21]。当凋亡发生时,各个凋亡信号通路最终激活Caspase3从而诱导细胞凋亡。本研究结果表明,DS 可以抑制EZH2,促进Cleavedcaspase3的表达,发挥促凋亡作用。
综上所述,DS 可以体外抑制人胃癌MGC-803细胞的增殖并诱导凋亡,其机制可能与抑制EZH2表达有关,为临床药物治疗胃癌提供了新的思路。但DS如何抑制EZH2的表达发挥抗肿瘤作用还需进一步研究。
