孕期应激下调成年雄性子代大鼠海马HDAC2表达
2019-07-11廖礼彬袁振江姚雪萍高峰李甜孟晓彤白生宾
廖礼彬,袁振江,姚雪萍 ,高峰,李甜,孟晓彤,白生宾*
(新疆医科大学基础医学院1组织学与胚胎学教研室,2机能实验中心,乌鲁木齐 830011;新疆生产建设兵团第六师奇台医院3病理科,4检验科 ,奇台 831800)
孕期是塑形子代的关键时期,孕期环境的改变对子代有着深远的影响。随着社会竞争压力、工作压力的增大,孕期应激的发生率和严重程度逐年增加,孕期应激成为了公共卫生问题,据研究报道显示10%~35%的儿童经受过孕期应激[1]。大量的动物和人类实验研究表明,孕期应激会重编程子代大脑的发育,进而导致子代出生后神经认知功能障碍,如焦虑、抑郁症、注意力缺陷多动障碍、自闭症、成瘾及精神分裂症等[2-4]。母代下丘脑-垂体-肾上腺素轴(HPA轴)过度活化引发的糖皮质激素过高是公认的孕期应激损伤子代的主要机制[5],过度激活母代的HPA轴,产生过量的糖皮质激素从而影响子代脑的结构和功能。但是到目前为止,过量母代糖皮质激素如何影响子代大脑的潜在分子机制,我们知之甚少。
表观遗传调节是影响个体大脑与环境因素的重要机制。而组蛋白去乙酰化酶(histone deacetylases,HDACs)是一种重要的与学习、记忆及突触可塑性基因相关的表观遗传修饰酶。HDAC2被认为是参与学习与记忆认知过程中最重要的调控分子[6]。激活内源性HDAC2能够抑制突触可塑性及多种形式的学习和记忆。最近,有研究表明激活糖皮质激素受体可以结合糖皮质激素反应元件及HDAC2启动子,调节HDAC2的表达并诱导应激相关认知功能障碍[7]。据此,我们推测HDAC2在母代孕期应激损伤子代认知功能障碍中起重要作用。
材料与方法
1 动物分组与孕期应激模型建立
将16只SD孕鼠随机分成对照组和应激组,每组8只,其中对照组未做任何处理,应激组在孕16-21天期间进行限制性应激。限制性应激采用文献方法[8]在孕期16~21天进行:孕鼠被放置在透明塑料容器里面(直径8.6cm × 21.6cm长),每天进行3次应激( 9:00 am, 13:00 pm and 17:00 pm),每次45min。各组子代出生后,与母代单独饲养,在出生后的21d断奶,相同性别子代饲养于同一笼。
2 成年雄性子代行为学检测
2.1 旷场
旷场是一个新的环境的应激。实验大鼠被放置在一个开放的环境中,具体的方法参考文献[8]。旷场大小为宽100cm,长100cm,高40cm,分割成25个小方格。在开始实验之前,动物被放置测试房间适应30min。实验大鼠被放置在旷场中央格,每次放置的位置固定,允许动物在旷场内探索5min。测试结束后,实验动物放回饲养笼内。旷场用75%的酒精进行擦拭,晾干,放入下一只动物。全程进行录像,观察记录大鼠5min内跨过的总方格数及中间方格数、中央区所滞留时间、运动总距离。跨越方格总数以双后肢跨出(入)作为标准,时间也以后肢跨出(入)为准。
2.2 高架十字迷宫
高架十字迷宫实验方法参考文献[9]。实验前,将大鼠置于实验场所适应一段时间(保持环境的安静,减少对大鼠的刺激)。迷宫距离地面 750mm , 由两条开放臂和闭合臂构成 (100mm×500mm×400mm walls, W×L×H)。将实验大鼠放入迷宫中央区,头朝开放臂,此后每只实验动物均放在同一位置。开启摄像监控器记录5min内实验动物开放臂和闭合臂的进入次数及进入各臂的时间。实验过程中实验者离开实验场地,记录结束后将实验动物放回饲养笼具内,同时清理迷宫,并用75%的酒精擦拭迷宫,消除动物气味对后继实验动物的影响。如果实验中有实验动物从高架上跌落,将此动物剔除。
主要应用的实验数据包括开放臂进入次数、开放臂滞留时间和闭合臂进入次数、闭合臂滞留时间。
2.3 新物体识别
新物体识别方法参考文献[10]。所识别的物体选择:大鼠所选物体在直径 5cm左右,无味,物体为不规则形状,不易被动物移动或推倒。设置 A、B、C 三个物体,其中A、B 物体完全一样,C 物体与A、B 物体完全不同。实验前,将大鼠在测试房间适应一段时间,保持实验环境安静,减少刺激。整个实验分训练和测试两个阶段。训练阶段:将A、B 两个物体放在旷场的对角线,大鼠垂直于对角线放入场地内,保持大鼠鼻尖距离两物的长度一致。大鼠放入旷场内10min,放入后立即开启录像设备,实验者立即离开测试房间,记录大鼠与这两个物体接触的情况,包括鼻子或嘴巴触及物体的次数和距离物体2~3cm 范围内探究的时间(前爪搭在物体上、鼻子嗅物体、舔物体等均属探究物体,摆个架势或爬到物体上不动不能算是对新物体的探究)。10min后,将大鼠放回饲养笼内。测试阶段:第二天同一时间进行检测,将场地内的B 物体换作C 物体,放置方法同训练阶段,观察10min,同样用录像设备录像,观察者离开测试房间,观察指标同训练。主要观察指标:大鼠对两个物体接触的总时间、对C物体(新物体)的探索时间。
2.4 巴恩斯迷宫实验
Barnes 迷宫是用来检测动物空间学习记忆能力的行为学检测方法。我们采用的迷宫是一个白色的圆形盘装(直径122cm)有18个洞(盘边缘每 20°一个洞,每个洞直径为9.5cm ),圆盘距离地面140cm 高。整个实验测试时间为连续的4天,每天测试3次。训练阶段:第一天将大鼠放置于迷宫中央,用黑色盒子将大鼠盖住,盒子与目标洞的角度保持(90~120°),朝向测试者一侧盒子透明可见,15s后,轻轻敲击盒子,大鼠头部和身体朝向测试者;掀开盒子,同时开启迷宫上方的灯;轻轻引导大鼠进入到目标洞内,立即关灯,大鼠在目标洞内待90s。实验阶段:大鼠放置方法同训练阶段,准许动物在180s内找目标洞,如未找到,轻轻引导其进入目标洞内;实验动物的每次测试间隔为15min,每次测试结束后用75%的酒精擦拭整个迷宫。实验记录指标:实验动物找到目标洞的时间和实验动物寻找目标洞的犯错次数(以大鼠颈部探入非目标洞内记为犯错次数)。
3 ELISA检测血浆皮质酮
血浆皮质酮检测方法根据试剂盒(corticosterone ELISA kit ab108821,Abcam)说明书进行操作。将血浆稀释100倍使用,向每个孔中加入25μl皮质酮标准品或样品,并立即向每个孔中加入25μl生物素化皮质酮蛋白,孵育2h,Wash Buffer手动洗涤5次。向每个孔中加入50μl SP Conjugate孵育30分钟。清洗孔板。每孔加入50μl Chromogen Substrate孵育20min,向每个孔中加入50μl Stop Solution,可以见到颜色将从蓝色变为黄色。在450nm波长的酶标仪上的读取吸光度,根据所测吸光度计算出相对应的浓度。
4 免疫组织化学
将大鼠海马组织用4%的多聚甲醛后固定24h,后于15%蔗糖脱水24h,30%的蔗糖脱水48h,用O.C.T将组织进行包埋,冰冻切片机进行切片,切片厚度为20μm,PBS将切片漂洗3次后置于3%的H2O2溶液 10min;PBS漂洗3次,5%的小牛血清(BSA, Sigma, MO, USA)室温封闭1h;兔抗HDAC2(1:200; Proteintech Group, 武汉) 4°C 过夜;次日,PBS漂洗,生物素化羊抗兔IgG室温孵育1h (1:200;Vector Laboratories, USA);PBS漂洗,ABC(1:1:400,Vector Laboratories, USA)液室温孵育2h;PBS 漂洗3次,DAB显色后贴片、脱水、透明、封片,显微镜下拍照观察结果,Image J进行光密度分析。
5 Western blotting
成年子代海马组织加入蛋白裂解液NP40,电动匀浆机裂解组织,15000r/min,10min离心后取上清,用BCA 试剂盒(康为世纪生物科技有限公司,北京)进行蛋白定量(4μg/μl)。每个样品取等量蛋白,经SDS-PAGE 胶电泳分离、转膜后,按分子量剪取目的条带。TBST 漂洗3次15min,5%脱脂牛奶室温封闭1h,一抗孵育(兔抗HDAC2,1:800;Proteintech)4℃过夜。次日,用TBST 溶液漂洗膜,Gaussia荧光素标记的羊抗兔IgG(1:8000; 926-32211,Li-COR®, USA)室温孵育1h,漂洗后Odyssey® Fc Imaging System(LI-COR Biosciences,USA)红外显影观察条带,应用Image J对条带进行光密度定量分析。目标蛋白水平用靶蛋白的光密度值/同膜GAPDH 的光密度值表示。
6 实时定量PCR
使用TRIZOL法(Invitrogen, Camarillo, CA)提取海马组织总RNA,按逆转录试剂盒说明(Vazyme,China)转录为cDNA, 稀释10倍后使用,PCR反应体系为:qPCR Mix 10μl, 无核酶水 6μl,引物(上下游)2μl,模板(cDNA)2μl;GAPDH 作为内参基因。引物序列是根据以前的文献[11]设计:HDAC2上游 5’-3’GGAGGTCGTAGGAATGTCGC,下游 5’-3’ TTTGGCTCCTTTGGTGTCTG,156bp;GAPDH上 游 5’-3’CAATTCCATCCC AGA CCCCAT, 下 游5’-3’AGGGTGCAGCGAACTTTATTGA,88bp。反应体系配制好后,使用罗氏480荧光定量PCR仪进行反应。基因的相对表达量使用2-△△ct方法进行计算。
7 数据处理与统计分析
采用SPSS 19.0统计软件进行分析。数据以¯x±s表示,巴恩斯迷宫数据使用重复测量方差分析,其余数据组间比较采用非配对的t检验分析,检验水准α=0.05
结 果
1 孕期应激增加成年雄性子代外周血糖皮质激素水平
ELISA检测成年雄性子代外周血结果显示,孕期应激后其雄性子代外周血皮质酮水平显著升高,比对照组高出近2倍(图1)。
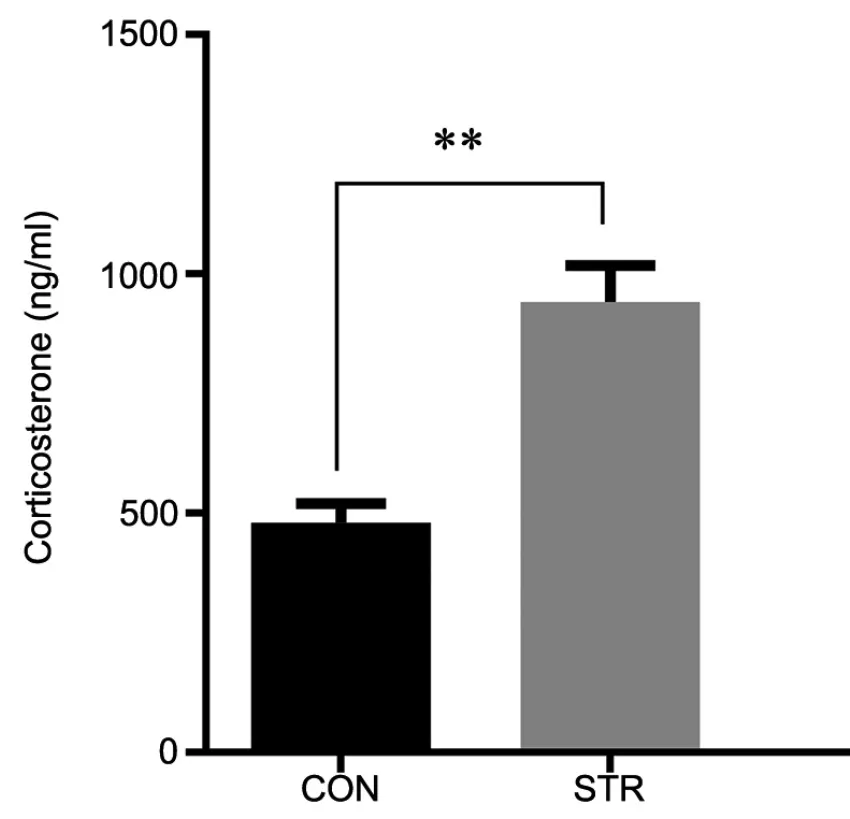
图1 成年雄性子代外周血皮质酮水平ELISA检测。CON,对照组;STR,应激组;**,P< 0.01(n=6)Fig. 1 ELISA detection for levels of corticosterone in peripheral blood of the adult male offspring . CON, control group; STR, stress group; **, P<0.01 (n=6)
2 孕期应激损伤成年雄性子代认知功能
成年雄性子代通过旷场、高架十字迷宫、新物体识别及巴恩斯迷宫4种行为学实验检测孕期应激对认知功能损害。旷场实验显示两组之间5min走行总距离无明显差别(图2A);与对照组子代相比,应激组子代在旷场中央区滞留时间显著少于对照组(图2B)。高架十字迷宫中,应激组子代与对照组子代相比,在开放臂滞留的时间明显减少(图2C),进入开放臂次数下降(图2D)。新物体识别结果显示,与对照组子代相比,应激组子代与对照组子代和两个物体接触的时间无显著差异(图2E),应激组雄性子代对新物体的识别指数明显降低(图2F)。巴恩斯迷宫中,应激组雄性子与对照组子代在寻找目标洞的时间上无显著差异(图1G),而犯错次数明显高于对照雄性子代(图2H)。以上实验结果表明孕期应激后对子代的焦虑水平、学习记忆、空间记忆有不同程度的损害。
3 孕期应激雄性成年子代海马内HDAC2表达下调
免疫组织化学检测显示,HDAC2在海马神经元广泛表达,在对照组中,HDAC2在神经元的胞体及细胞核上均有表达,各神经元表达较均一(图3A-C),而应激组中HDAC2在神经元中表达深浅不一,少数神经元表达较多,大部分神经元着色较浅(图3D-F)。对HDAC2在海马表达不同区域神经元内免疫反应性进行定量分析显示,与对照组子代相比,应激组子代海马齿状回(dentate gyms,DG)区和CA1区HDAC2免疫反应性明显下调,但CA3区无明显差异(图3G)。
Western blot检测显示,与对照组相比,孕期应激成年雄性子代海马中HDAC2蛋白表达明显低于对照组(图4)。实时定量PCR检测显示,与对照组相比,应激组子代海马HDAC2 mRNA 表达下降近40%(图5)
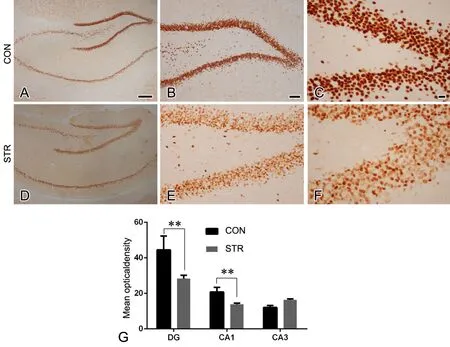
图3 成年雄性子代海马HDAC2表达的免疫组织化学检测。A-C,对照组;D-F,应激组;G, HDAC2免疫反应性统计学分析; CON,对照组; STR,应激组;比例尺:A,B,D和E,100μm;C和F,50μm;**,0.01<P<0.05;n=6Fig. 3 Immunohistochemical examination for HDAC2 expression in the hippocampus of the adult male offspring. A to C, control group; D to F stress group; G, statistical analysis for HDAC2 immunoreactivity; CON, control group; STR, stress group; scale bar: 100μm in A, B, D and E; 50μm in C and F; **, 0.01<P<0.05; n=6
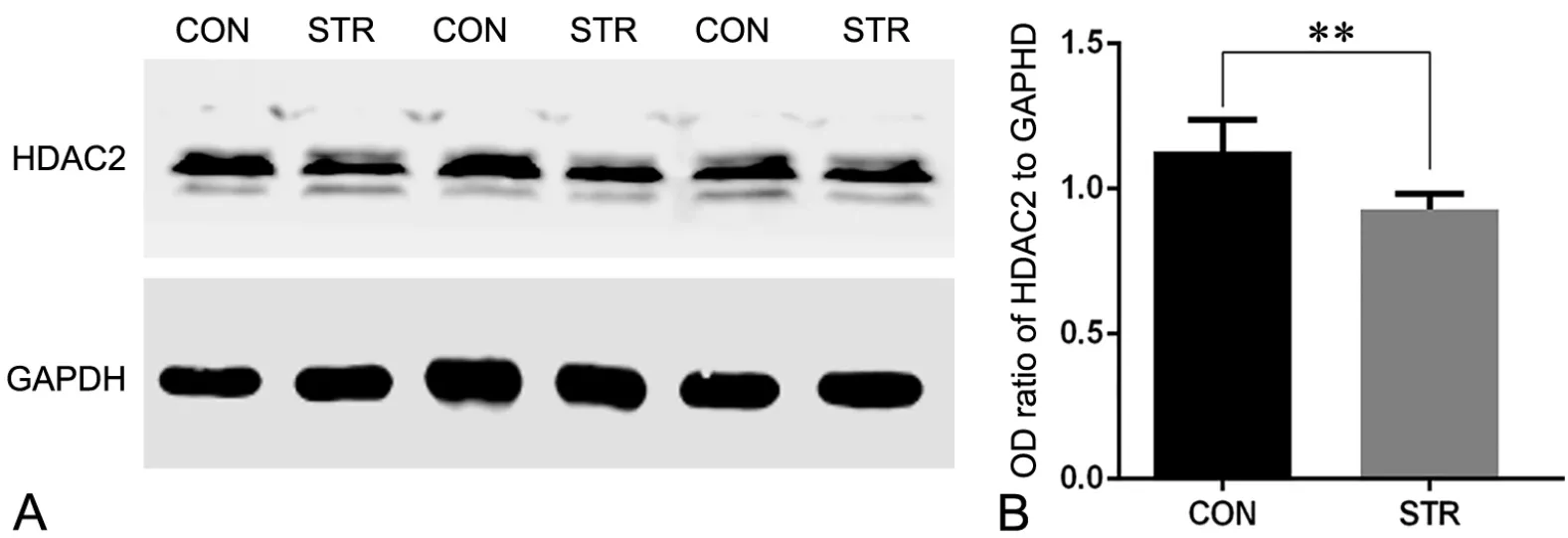
图4 雄性成年子代海马HDAC2蛋白表达的Western blot检测。A,代表性Western blot;B,HDAC2水平的统计学分析;CON,对照组;STR,应激组;**,0.01<P<0.05;n=6Fig. 4 Western blotting for HDAC2 protein expression in the hippocampus of the male adult offspring. A. representative Western blot; B. statistics analysis for HDAC2 level; CON, control group; STR, stress group; **, 0.01<P<0.05; n=6
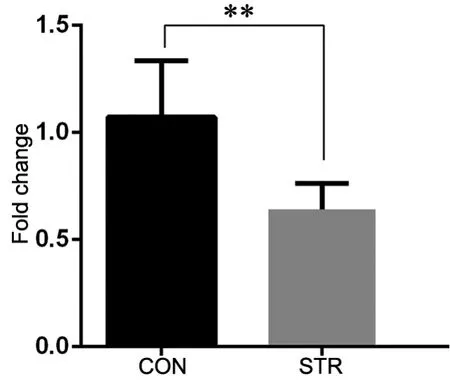
图5 雄性成年子代海马HDAC2 mRNA表达的实时定量PCR检测。CON,对照组; STR,应激组;**,0.01<P<0.05;n=6Fig. 5 Real-time quantitative PCR detection for HDAC2 mRNA expression in the hippocampus of the male adult offspring. CON, control group;STR, stress group; **, 0.01<P<0.05; n=6
讨 论
机体适应环境能力十分重要,生命是通过维持复杂内部环境的动态平衡,即“体内平衡”而存在。但这种平衡不断受到外部环境的刺激即应激反应。应激反应本身是机体对外部环境刺激的一种非特异性防御反应,但是同时也会对机体造成损伤[12]。孕期是子代发育的关键时期,孕期环境的改变对子代有着深远的影响。有研究显示孕期限制应激会损害子代学习和记忆,且与海马PKC beta1表达改变有关[13]。孕期非均一连续性应激(heterogeneous sequential stress, HSS)可导致子代在水迷宫测试中寻找平台潜伏期延长、路径长度增加,表明其空间学习记忆受到损害[14]。同时,伴随着成年雄性子代皮质酮的含量增高,慢性孕期应激对子代大鼠学习和记忆有损害[14]。
对孕期应激损伤子代的机制研究最多的是母代下丘脑-垂体-肾上腺轴(HPA轴)过度活化导致糖皮质激素水平的升高。有研究结果表明,给予外源性糖皮质激素能部分复制孕期应激诱导子代的损伤的结局[15],而切除肾上腺能部分消除孕期应激对子代和母代的影响[16]。这些都表明了糖皮质激素在孕期应激损伤子代中的重要作用。
我们实验通过旷场、高架十字迷宫、新物体识别及Barnes 迷宫发现应激组子代表现出焦虑水平升高,学习记忆力下降;通过ELISA检测发现孕期应激子代血浆皮质酮水平高于正常对照组。这些研究结果与前面报道的一致,说明糖皮质激素水平升高可通过胎盘进入胎儿体内影响胎儿的发育。母体通过糖皮质激素将孕期应激的效果传递给子代。
最近,有研究表明激活糖皮质激素受体可以结合糖皮质激素反应元件及HDAC2启动子,调节HDAC2的表达并诱导应激相关认知功能障碍,说明HDAC2在孕期应激损伤子代中起重要作用[17]。为此,我们通过免疫组织化学、Western blot、RT-PCR检测孕期应激后子代雄性海马HDAC2表达变化,发现孕期应激子代海马中HDAC2在mRNA及蛋白水平上均显著下调。
表观遗传调节是影响个体大脑与环境因素的重要机制。而HDACs是一种重要的与学习、记忆及突触可塑性基因相关的表观遗传修饰酶,HDAC2被认为是参与学习与记忆认知过程中最重要的调控分子。激活内源性HDAC2能够抑制突触可塑性及多种形式的学习和记忆,且HDAC2的含量及活性可以通过亚硝基化和磷酸化分别在转录水平和转录后水平上调控基因的表达[18]。过表达HDAC2会导致海马神经元树突棘及突触数量减少,损害记忆能力[19]。HDAC2敲除小鼠表现为学习记忆、突触可塑性增强[20]。以上研究表明HDAC2对学习记忆是负调控作用,而我们的研究发现孕期应激雄性成年HDAC2下降的同时伴随认知功能障碍。其原因可能是孕期应激的时间、方式不同造成的。孕期应激的时间和方式是影响及决定应激结果[21]的一个重要因素。另外,Hou[11]等研究发现HDAC2在大鼠海马的出生后发育有时空表达差异,他们的研究结果显示HDAC2的表达水平随海马神经元成熟逐渐降低,提示HDAC2的表达特征可能在后天学习记忆功能与发育中发挥重要作用。
有一些研究结果表明,慢性社会应激导致成年鼠伏隔核HDAC2降低。他们推测其原因可能是机体对外部环境应激的一种适应性神经元反应。组蛋白尾部去乙酰化是由组蛋白去乙酰化酶家族介导的,其酶活性增加导致染色质浓缩,转录抑制。这意味着当HDAC2表达上调时,基因表达受到抑制。相反,HDAC2表达下调可以激活基因转录[22],试图通过增加乙酰化来转录,如脑源性神经营养因子(BDNF)、海马中的mGluR1和mGluR5来抵抗应激[23]。
对于HDAC2如何影响到子代的行为机制不清楚。Jawerka 等在HDAC2条件性基因敲除鼠中有研究发现,HDAC2在调节神经元新生作用时,在发育期和成年两个阶段,其调节神经元新生的分子机制不同,同时HDAC2缺陷小鼠脑内神经元发育成熟障碍[24]。因此,我们推测母代孕期应激导致雄性子代海马HDAC2减少,可能影响海马神经元的成熟,损伤子代认知功能。
