原发性乳腺弥漫性大B细胞淋巴瘤5例并文献复习
2019-07-11柯晓康张清平袁静萍夏良兵何惠华
柯晓康,张清平,袁静萍,夏良兵,何惠华*
(1武汉大学人民医院病理科,武汉 430060;2华中科技大学同济基础医学院脑研究所/病理生理学系,武汉430030;3监利县人民医院病理科,荆州433300)
乳腺的淋巴瘤可分为原发性乳腺淋巴瘤(primary breast lymphoma,PBL)与继发性乳腺淋巴瘤[1]。PBL是一种罕见的起源于淋巴组织的恶性肿瘤,以女性多见,其发病率约占乳腺恶性肿瘤的0.04%~0.5%,占所有非霍奇金淋巴瘤的1%,约占结外非霍奇金淋巴瘤的2%[2]。在PBL中,以原发性乳腺弥漫性大B细胞淋巴瘤(primary breast diffuse large B-cell lymphoma,PB-DLBCL)最为常见[3],临床易误诊或漏诊,预后较差。本文收集5例PB-DLBCL,探讨其临床病理特征、诊断及鉴别诊断、治疗及预后,以加强病理及临床医师对PB-DLBCL的诊治认识。
材料与方法
1 材料
收集2013年~2017年武汉大学人民医院病理科5例确诊为PB-DLBCL的标本,均由2名高级职称病理医师(包括1名淋巴瘤亚专科的病理医师)复阅,根据Wiseman等提出的PBL的入选标准筛选病例:①乳腺是首发部位,可伴或不伴同侧腋窝淋巴结受累;②足够用于诊断的病理组织;③患者既往无淋巴瘤或白血病病史;④其它部位无淋巴瘤同时合并。并采用WHO(2008)造血与淋巴组织肿瘤分类和2016年修订版的分类标准重新分类[4],分期依据Ann Arbor的分期标准,同时参照Hans算法[5](CDl0、Bcl-6和MUM-1)将DLBCL分为GCB型和non-GCB型。5例标本均被归为PB-DLBCL,均为女性患者,发病年龄48~70岁,中位年龄59.2岁,均表现为单侧乳腺无痛性包块进行性增大,其中左乳3例,右乳2例。5例均伴有同侧腋窝淋巴结受累,为临床II E期。术前临床诊断均倾向为乳腺癌,其中3例行乳腺单纯切除术(病例1、2和3),1例行乳腺改良根治术(病例4),1例行乳腺病损切除术(病例5),术后患者均采用化疗联合放疗的治疗方案,大多有缓解,采用电话随访,随访截止日期为2018年6月,随访期内,有2例复发(病例3和4),分别于7和19个月后死亡;2例(病例2和5)健在,分别已存活12和72个月;另外一例(病例1)失访(表1)。
2 免疫组织化学染色
标本均经10%中性福尔马林固定,常规石蜡包埋,切片厚度3μm,切片后行HE染色,光镜下观察。免疫组织化学染色采用SP法,具体操作步骤严格按试剂盒说明书进行。一抗包括LCA、PCK、CD20 、CD79a、CD3、CD5 、CDl0、Bcl-2、Bcl-6、MUM-1和Ki-67,均购于Dako公司。
3 原位杂交
EBV编码的小RNA(EBER)采用原位杂交法在石蜡切片中进行EBER检测,探针购自北京中杉金桥公司,具体操作步骤严格按试剂盒说明书进行。反应均设相应的阳性及阴性对照。
结 果
1 肉眼观
病例1:乳腺单纯切除术标本1个,切开其内可见一最大径4.6cm的灰白肿块;病例2:乳腺单纯切除术标本1个,切开其内可见一最大径2.3cm的灰白肿块;病例3:乳腺单纯切除术标本1个,切开其内可见一最大径12.5cm的灰白肿块;病例4:乳腺改良根治术标本1个,切开其内可见一最大径3.6cm的灰白肿块;病例5:乳腺病损切除术标本1个,肿物最大径6.3cm(图1A,图1B)。5例肿块切面均灰白、灰黄色、质嫩、局部细腻可见坏死。
2 镜检
在5例PB-DLBCL中,镜下见乳腺正常结构被破坏,残存部分导管和小叶(图2A),成片的异型淋巴样细胞在乳腺小叶、导管周围、间质及周围脂肪组织中弥漫浸润性生长,瘤细胞中等偏大,核空泡状,可见一个或多个核仁,类似免疫母细胞样细胞或中心母细胞样细胞,核分裂象易见(图2B)。
3 免疫组织化学表型
在5例PB-DLBCL中,肿瘤细胞呈LCA、CD20(图2C)、CD79a和MUM-1(图2D)阳性, CD3和PCK阴性,其余指标因病例不同存在差异。病例1:肿瘤细胞CD5、CD10、BCL-6和BCL-2阴性,Ki67 LI约70%;病例2:肿瘤细胞BCL-6阳性,而CD5、CD10和BCL-2阴性,Ki67 LI约60%;病例3:肿瘤细胞CD5、BCL-2和BCL-6阳性,而CD10阴性,Ki67 LI约90%;病例:肿瘤细胞BCL-2和BCL-6阳性,而CD5和CD10阴性,Ki67 LI约80%;病例5:肿瘤细胞CD10(图2E)和BCL-2阳性,而CD5和BCL-6阴性,Ki67 LI约70%(图2F);在5例PB-DLBCL中,仅病例5为GCB型,其余4例均为non-GCB型。
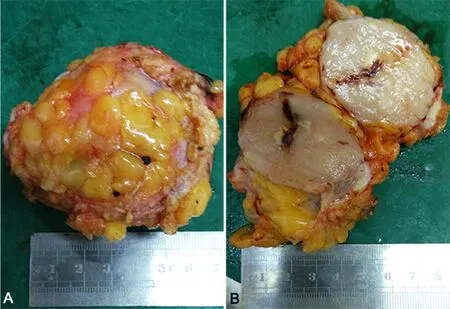
图1 乳腺病损的切除术标本。A,肿物的最大径为6.3cm;B,肿物的切面灰白、质嫩,可见坏死Fig. 1 Resection specimen of breast lesions. A, the maximum diameter of the mass is 6.3cm; B, the cut surface of the mass is gray, tender and necrotic
4 原位杂交
5例EBER原位杂交均阴性。
讨 论
PBL的发病率很低,在乳腺恶性肿瘤中所占的比例不足0.5%,虽然在乳腺组织中可以发生多种类型的淋巴瘤[6],但PB-DLBCL仍然是PBL中最常见的组织学亚型[3],尽管PB-DLBCL是PBL最常见的类型,但其发生率在国内外报道存在差异,国外报道占40%~70%[7],国内比例高于国外,约占82.2%~93.8%[8]。WHO分类中,PBL的诊断标准为:肿瘤局限于乳腺和/或仅累及同侧腋窝淋巴结,且无其它部位淋巴瘤病史[9]。 本研究中的5例PB-DLBCL均符合该诊断标准。
1 临床病理特征
PB-DLBCL是一种罕见的且临床预后差的恶性肿瘤,几乎均为女性,男性极其罕见。研究发现,患者的中位年龄为60岁[8]。本研究中5例均为女性,发病年龄48~70岁,中位年龄59.2岁,与国外报道较一致。PB-DLBCL患者常表现为无痛性单侧乳腺肿块进行增大,伴或不伴同侧腋窝淋巴结肿大,右侧受累多见,尤其是右乳外上象限。该临床表现与乳腺癌相似,极易误诊。PB-DLBCL患者很少出现皮肤水肿、收缩、红斑及乳头凹陷等症状[7],故当病理及临床医生初诊怀疑乳腺癌但不伴此临床特征时,要考虑PBL的可能。本研究中的5例PB-DLBCL,除发病部位外(左侧3例,右侧2例),其余均与文献较一致。由于PB-DLBCL缺乏特异性的临床表现及影像学诊断特点,术前和乳腺癌难以鉴别,故PB-DLBCL主要依靠病理活检及免疫表型确诊。故大多数患者首先通过选择肿块细针穿刺、肿块切除或乳腺切除术后,再行组织病理学检查和免疫组化染色方法,才最终能得到明确的诊断。乳腺癌的大体标本一般呈灰白、实性、质硬改变,而本研究中的5例患者标本切面均呈灰白、灰黄色、质嫩、局部细腻可见坏死。镜下见乳腺正常结构被破坏,残存部分导管和小叶,成片的异型淋巴样细胞在乳腺小叶、导管周围、间质及周围脂肪组织中弥漫浸润性生长,瘤细胞中等偏大,核空泡状,可见一个或多个核仁,类似免疫母细胞样细胞或中心母细胞样细胞,核分裂象易见。免疫表型上,肿瘤细胞上皮源性标记物(PCK、EMA)阴性,B细胞标记物(CD20、CD79α)阳性,部分病例可表达Bcl-2,少数病例表达CD5。对于MUM-1、CD10、BCL-6的表达水平因不同病例而异。本组5例PB-DLBCL中,基本均符合上述特征。根据Hans算法[5]的标准,将DLBCL分为GCB型和non-GCB型。PB-DLBCL以non-GCB型多见,占2/3以上[9]。本组5个病例中,1例为GCB型,4例为non-GCB型,与文献报道类似。
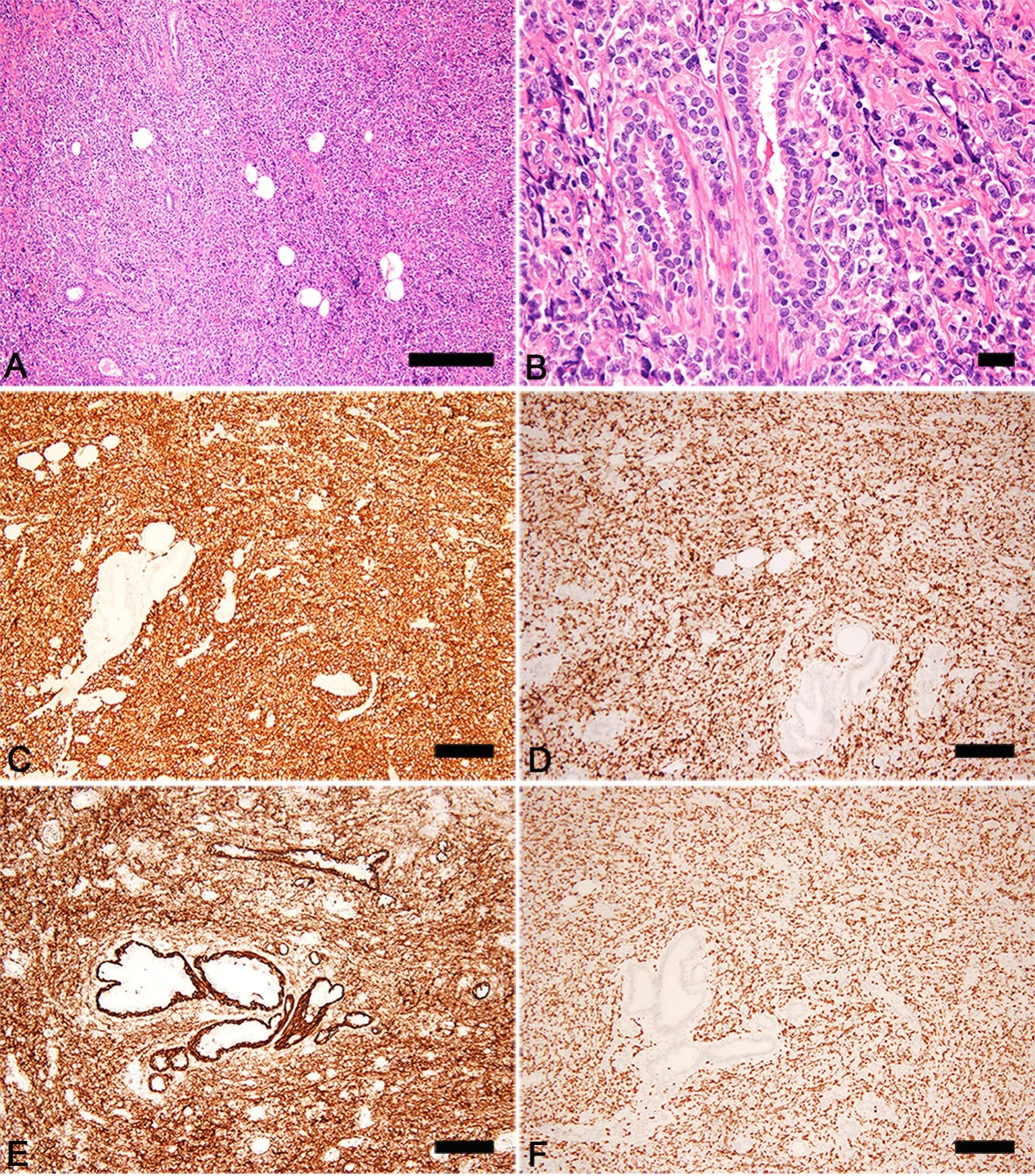
图2 乳腺肿瘤的组织病理学检查。A,乳腺正常结构被破坏,残存部分导管和小叶;B,中等偏大的瘤细胞在乳腺小叶、导管周围、间质及周围脂肪组织中弥漫浸润性生长;C,肿瘤细胞CD20呈弥漫胞膜阳性;D,肿瘤细胞MUM-1呈弥漫胞核阳性;E,肿瘤细胞CD10呈弥漫胞膜阳性;F,肿瘤细胞Ki67呈弥漫胞核阳性;比例尺,100μmFig. 2 Histopathological examination of the breast tumor. A, the normal structure of the mammary gland is destroyed, remaining only part of the gland ducts and lea flets; B, the medium-large size tumor cells in diffuse form in filtrated the lobules of mammary gland, the periductal, interstitial tissue and surrounding adipose tissue; C, CD20 shows diffusely positive membranous staining in the tumor cells; D, MUM-1 shows diffusely positive nuclear staining in the tumor cells; E, CD10 shows diffusely positive membranous staining in the tumor cells; F, Ki67 shows diffusely positive nuclear staining in the tumor cells; scale bar, 100μm
2 鉴别诊断
PB-DLBCL是一种罕见的起源于淋巴组织的恶性肿瘤,其临床及影像学的表现与乳腺癌类似,故患者就诊时大多以乳腺癌收治入院并进行手术。值得注意的是,在快速病理诊断时,镜下若见成片的肿瘤细胞在残余的乳腺小叶、导管周围、间质及周围脂肪组织中弥漫浸润性生长,且缺乏黏附性,未见原位癌结构时,应考虑PBL的可能性,并等待常规病理检测及免疫组化以明确分型。由于乳腺结构复杂,恶性肿瘤种类繁多,其诊断及鉴别诊断尤为重要,需与下列疾病相鉴别:
①乳腺浸润性小叶癌:表现为间质中单个细胞浸润或线状生长方式,癌细胞单一且弥漫,间质少,缺乏粘附性,极易误诊为DLBCL,但癌细胞胞浆偏红染、不少细胞的胞浆内可出现黏液和空泡,同时可伴有小叶原位癌;癌细胞CK、EMA和CK34βE12阳性,B细胞标记物阴性。
②硬化性淋巴细胞性乳腺炎:常表现为乳晕下可触及的界限清楚的包块,行组织穿刺时易误诊,镜下见小叶内、小叶、导管及血管周围致密的成熟性小淋巴细胞浸润,病变呈多结节分布而非DLBCL的弥漫性;间质呈纤维硬化性背景;免疫标记提示淋巴细胞以B细胞为主,多克隆性。
③粒细胞肉瘤:白血病累及乳腺,以粒细胞肉瘤相对常见,粒细胞可表现为不同的分化阶段,胞浆偏红,可出现分化的红染性颗粒;免疫表型MPO、CD43、CD117阳性,B细胞标记物阴性。
④髓样癌:癌细胞呈合体细胞生长方式,缺乏腺管及原位癌结构,细胞体积大,胞浆丰富,核仁明显,间质中可见淋巴细胞及浆细胞浸润;免疫表型为上皮性,可与其鉴别。
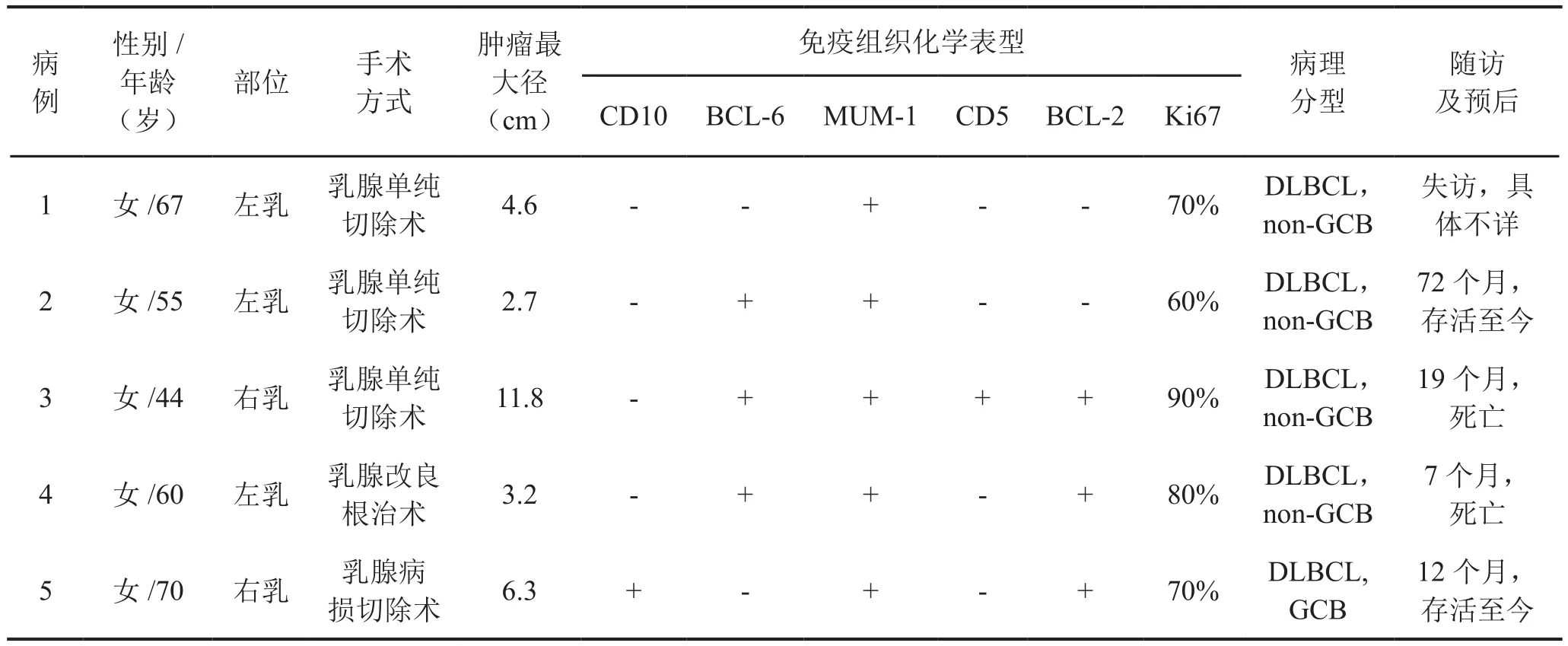
表1 5例PB-DLBCL的临床病理特点Tab. 1 Clinicopathological features of 5 cases of PB-DLBCL
3 治疗及预后
目前针对PB-DLBCL的治疗指南仍缺乏统一的治疗标准[10],对于PB-DLBCL患者来说,行乳腺切除术对治疗并无益处,既不能改善生存率也不能减少复发的风险。研究表明,外科手术仅为获取满足病理诊断的组织,微创手术是较好的选择,因为大范围手术可能会增加复发的风险,而且切除腋窝组织也不能增加治疗优势,反而会降低患者的生活质量,故化疗(CHOP或R-CHOP方案)联合放疗依然是目前最成功的治疗方案[11]。CHOP方案的药物由环磷酰胺、长春新碱、阿霉素以及泼尼松组成,而RCHOP方案则在CHOP方案的基础上加用利妥昔单抗(Rituximab)。化疗具体方案为首先使用CHOP或R-CHOP方案治疗,获得完全缓解后再化疗≥6个周期,以后在无瘤期间亦需每年定期化疗l -2周期,持续2~3年。PB-DLBCL患者的预后较差,5年无病生存率为40%~60%,5年总生存率(OS)为53%~63%。关于影响预后的因素,文献报道不一。在PB-DLBCL中,CD5阳性比CD5阴性者预后差,non-GCB型较GCB型的5年OS低,预后差,且在non-GCB-DLBCL中,BCL-2阳性的较BCL-2阴性者差,且non-GCB-DLBCL患者即使加用Rituximab化疗方案亦不能改善预后[12]。本研究中有2例复发可能与CD5或BCL-2表达及non-GCB型有关。本研究中共随访5例患者,1例已失访,2例已死亡,2例仍生存,生存期分别为12和72个月。
总之,PB-DLBCL是PBL最常见的组织学亚型,其细胞起源分型大部分为non-GCB型,小部分为GCB型,且主要见于女性,常表现为无痛性单侧乳腺肿块伴或不伴同侧腋窝淋巴结肿大,右侧受累多见。其临床表现与乳腺癌难以区别,主要依靠病理活检及免疫表型确诊。值得注意的是,在做快速冷冻病理诊断时,若镜下见肿瘤细胞弥漫性浸润且缺乏黏附性,未见原位癌结构,要考虑PB-DLBCL的可能。目前治疗方案尚未达成共识,推荐方案为化疗(CHOP/R-CHOP)联合放疗等综合治疗为主,乳腺切除及根治术对患者预后有害无益,故手术仅作为诊断用途,推荐空心针穿刺活检后行免疫组织化学确诊。
