左心室流出道及邻近结构室性心律失常体表心电图鉴别流程
2019-07-10虞虹艳林佳选李嘉李岳春李进季亢挺殷日鹏林加锋
虞虹艳 林佳选 李嘉 李岳春 李进 季亢挺 殷日鹏 林加锋
特发性室性心律失常(VAs),由特发性室性期前收缩(PVCs)和室性心动过速(VT)组成,绝大多数无器质性心脏病。近些年来,射频消融治疗VAs不断增加[1-2],这些VAs约70%起源于心室流出道(VOT),其中以右心室流出道(RVOT)的报道为多见,左心室流出道(LVOT)及其邻近结构较少见。本文报道经射频消融成功的272例起源于LVOT及其邻近结构的VAs,探讨LVOT及其邻近结构不同部位VAs的ECG特征,并提出鉴别流程。
1 对象和方法
1.1 对象 2006年10月至2016年6月,温州医科大学附属第二医院心内科导管射频消融治疗VAs 1 529例,男641 例,女888例,年龄7~86(48.35±17.31)岁。其中272例(17.79%)符合以下入选条件:(1)射频消融成功;(2)经X线或三维标测证实有效靶点在LVOT(主动脉窦及窦下)及其邻近结构[包括二尖瓣环前壁心内膜(Endo-MAA)、心大静脉远端(DGCV)及其移形区];(3)排除在上述区域标测到“最早”心室电位但消融无效者。其中男134 例,女 138 例,年龄 19~79(55.06±14.52)岁;病程 0.5~11(2.79±2.18)年。所有患者均有明显症状,且曾服用 2~3种抗心律失常药物(AAD)均无效。入选272例患者行血生化、胸部X线、超声心动图等检查,未发现器质性心脏病,但有39例(14.33%)存在左心室轻度增大,测量心室舒张末期内径在52~73mm,13例左心室射血分数<50%,经消融治疗成功后半年,复查均恢复正常范围;246例患者行24h动态心电图检测,观察24hVAs的数量和发作特点,其总数 11 079~48 972(22 412±9 436)次/24h。临床表现为单纯PVCs218例,PVCs伴短阵VT48例,伴持续性VT6例。
1.2 方法
1.2.1 ECG检查及测量 ECG记录为纸速25mm/s的日本光电12导联同步心电描记仪。电生理检查仪为美国GE公司的Prucka,纸速100mm/s。VAs的QRS波群测量方法:以窦性心律的T-P段为等电位线,每个导联连续测量3个PVCs或IVT的q、R、s波群振幅,计算QRS波群的算术平均值,比较各组ECG VAs的形态学特征;当胸前导联R/S=1时,定义为胸前导联移行区(包括PVCs或IVT及窦性心律),将其进行数字化转换,如胸前导联移行区在V2以2来表示,在V2~V3之间以2.5来表示,依次类推;根据Yoshida等[3]方法计算胸导联移行指数,即VAs胸导联移行-窦律胸导联移行的差值。按图1的方法测量下列ECG指标[4]:(1)假性δ波时间:QRS波起始至其升支第一个挫折的最大时间;(2)R波类本位曲折偏移时间(IDT):QRS波起始至 V2导联 R 波顶峰时间;(3)QRS时间:12导联中QRS波起始至终末的最大时间;(4)最大偏移指数(MDI):为 IDT 与 QRS时间的比值。Q、R、S指相对高振幅(>0.5mV)的波,q、r、s指相对低振幅(≤0.5mV)的波。

图1 ECG指标的测量方法
1.2.2 心内电生理检查及消融治疗 所有患者术前停用至少5个半衰期AAD。穿刺右侧股动脉置入7F动脉鞘,以术前体表ECG的初步定位为依据,直接经鞘管送入四极消融导管依次至LVOT(半月瓣上或瓣下)或Endo-MAA进行标测和消融;若LVOT未能标测到理想靶点,可穿刺股静脉至RVOT进行标测与消融;如无效,则经冠状静脉窦至DGCV移形区进行标测与消融;如消融仍失败,最后穿刺房间隔在Aglilis NxT鞘支撑下将消融导管以反S形调整至左冠窦下再次进行标测与消融直至消融术成功。常规选择温控消融导管,预设温度52~55℃,预置能量30~50 W,阻抗80~140Ω;经DGCV放置消融导管者,选择盐水灌注消融导管,预设温度43℃,预置能量30W,盐水灌注速度应调至30~60ml/min,温度达50℃(盐水灌注导管37℃)后试放电10 s;10 s内PVCs消失或VT终止,或在放电过程中出现与自发PVCs心电图形相同的频发PVCs及短阵VT且很快消失,即认定为有效靶点。在有效靶点巩固放电60~180 s,连续观察30min。消融终点以VAs消失,电生理刺激及静脉滴注异丙肾上腺素等原先可诱发VAs的方法不能诱发为标准。
1.3 随访方法 (1)术后心电监护不<48 h;(2)一律停用AAD;(3)术后3个月复查动态心电图(DCG)和超声心动图,以判断远期效果;(4)门诊随访,建立档案。
1.4 成功标准[5]即刻成功标准:术后PVCs消失,或偶发PVCs(≤1次/min)或VT不能被诱发,或术后密切观察30 min,与术前单形性PVCs形态完全相似的PVCs总数<10个;远期成功标准:射频消融术后3个月常规行DCG检查,PVCs完全消失,VT未再复发,或PVCs总数较术前明显减少(>75%以上),不适症状获明显改善。
1.5 统计学处理 采用SPSS 20.0统计软件。计量资料以表示,多组间比较采用方差分析,两两比较采用q检验。计数资料组间比较采用χ2检验或Fisher精确概率法。分析心电图鉴别指标的灵敏度、特异度、阳性预测值、阴性预测值。P<0.05为差异有统计学意义。
2 结果
2.1 LVOT及邻近结构不同起源VAs的标测与消融结果272例消融成功者,其中采用三维标测系统Carto 3或Ensite-NavX及冷盐水灌注消融导管进行标测与消融139例,采用普通温控消融导管进行标测与消融133例。根据有效靶点X线影像及三维标测定位,分为以下6组:(1)左冠窦(LCC)组 110例;(2)右冠窦(RCC)组 35例;(3)左右冠窦交界处(L-RCC)组16例;(4)左冠窦下(ILCC)组 42例;(5)二尖瓣环前壁心内膜(endo-MAA)组 18例;(6)DGCV移形区组51例。6组患者一般临床资料及标测与消融结果的比较见表1~2。

表1 6组一般临床资料的比较[例(%)]

表2 6组标测与消融结果的比较
由表1可见,除DGCV组年龄低于RCC组及ILCC组外,其他各组一般临床资料无统计学差异(均P>0.05);由表2可见,LCC组仅10.0%可完成起搏标测,明显低于其他5组(均P<0.01);DGCV组放电时间明显少于而X线曝光及手术时间明显长于其他5组(均P<0.01)。
2.2 主动脉瓣上、瓣下及Endo-MAA起源VAs ECG特征的比较 以上部位分为5组,其共同ECG特征是:(1)下壁导联均呈单向R波;(2)aVR、aVL导联均呈QS型;(3)除Endo-MAA组在V4~V6导联有s波呈Rs型外,其他各组均呈单向R波。5组ECG的比较见图2及表3。
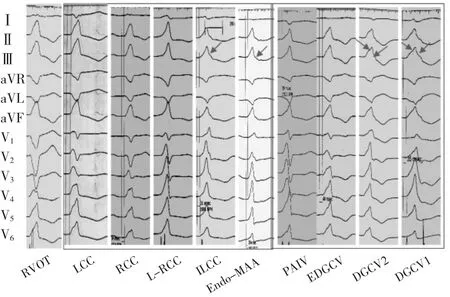
图2 LVOT及邻近结构不同起源VAs ECG特征的比较
由表3可见,(1)RCC组及L-RCC组Ⅰ导联以正向波为主,呈R、r或Rs型,分别占91.43%及93.75%,明显多于LCC组的19.09%及ILCC组26.19%和Endo-MAA组的 0(均P<0.01);(2)5组下壁导联均呈 R 型,aVR、aVL导联均呈QS型,RCC组(94.29%)及L-RCC组(93.75%)表现为 RⅡ>RⅢ、QSaVR>QSaVL,明显高于 LCC组的20.00%及ILCC组30.95%和Endo-MAA组的0(均P<0.01);(3)5 组胸前导联 QRS 波群形态亦有区别,ILCC组及Endo-MAA组在V1导联以正相波为主呈R型(73.81%及88.89%),胸前导联移行在V1导联之前(分别为92.86%及100.00%),而RCC组及LCC组多数呈rS型(分别占80.00%及55.45%),胸前导联移行多数在V2~V3,L-RCC组在V1导联100.00%呈qrS或QS型为其特征;(4)ILCC组及Endo-MAA组多数患者下壁导联R波降支有切迹(78.57%及100.00%),而另3组下壁导联R波降支很少有切迹(均P<0.01);(5)ILCC组90.48%在V4~V6导联无s波呈R型,而Endo-MAA组仅5.56%在V4~V6呈 R 型(χ2=39.94,P<0.01)。
若以Ⅰ导联呈R、r或Rs型作为诊断RCC及LRCC起源的指标;以V1及V4~V6导联呈单向R型作为诊断ILCC起源的指标;以V1呈R型、V4~V6导联呈Rs型作为诊断Endo-MAA起源的指标;V1呈qrS或QS诊断L-RCC起源;则其灵敏度、特异度、阳性及阴性预测值见表4。
2.3 DGCV移形区VAs的ECG特征 51例DGCV消融成功者,按图3以前室间静脉开口为界,将其分为DGCV1组(心大静脉远端1)、DGCV2组(心大静脉远端2)、EDGCV组(心大静脉远端延伸支)及PAIV(前室间静脉开口近端)组,其共同的ECG特征是下壁导联均呈单向R波,aVR、aVL均呈QS型。仔细分析DGCV移形区的心电图特征发现,其与LCC、RCC、ILCC及end-MAA的心电图特征有类似之处:(1)EDGCV组与RCC组类似,表现为RⅡ>RⅢ、QSaVR>QSaVL,Ⅰ导联以正向波为主呈R或r型,其他3组则相反;(2)DGCV2组与ILCC组相似,在 V1及 V4~V6导联多数呈单向 R波为其特征;(3)DGCV1组与end-MAA组类似,在V1导联呈R型无S(s)波,V5~V6导联呈 RS 或 Rs型(有 S 波);(4)PAIV 组与LCC 组相似,V1导联呈 rS或RS型(有 S波),V5~V6导联呈R型(无S波)。此外,胸前导联移行区DGCV1及DGCV2组常在V1导联之前,EDGCV组在V1或V2导联,而PAIV组常在V2或V2~V3导联之间。DGCV不同部位PVC/VT心电图特征的比较见图3及表5。

表3 5组体表ECGQRS波群特征的比较[例(%)]
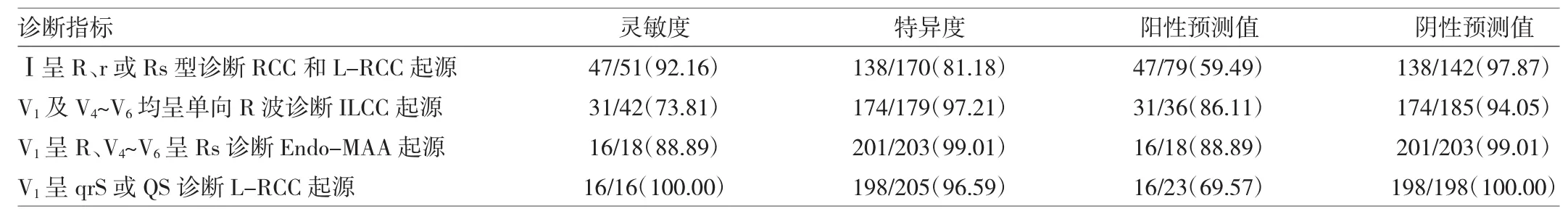
表4 不同指标对主动脉瓣上、瓣下及Endo-MAA不同起源VAs的诊断价值[例(%)]
若以下壁导联存在升降支双挫折作为诊断DGCV1、DGCV2起源VAs的指标,Ⅰ呈R或r型作为诊断EDGCV起源的指标,V1及V4~V6均呈R波作为DGCV2起源的指标,V1呈R型V4~V6呈Rs波作为DGCV1起源的指标,则其灵敏度、特异度、阳性及阴性预测值见表6。
上述各组以下 ECG 指标[4]:(1)假性 δ 波时间;(2)R波类本位曲折偏移时间(IDT);(3)QRS 时间;(4)最大偏移指数(MDI)。结果见表7。
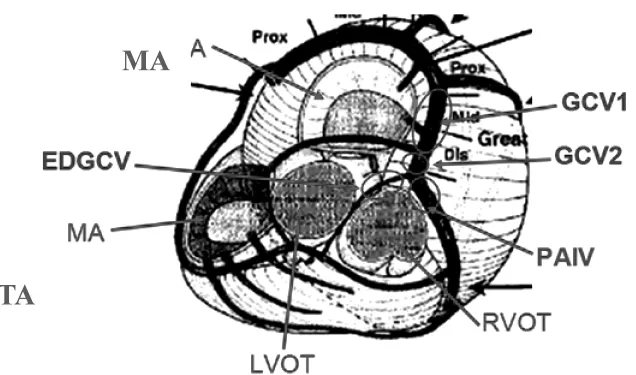
图3 将DGCV分为4个区域,DGCV1=心大静脉远端1,DGCV2=心大静脉远端2,PAIV=前室间静脉近端,EDGCV=心大静脉远端延伸支,RVOT=右心室流出道,LVOT=左心室流出道(图片参考自林加锋《室性心律失常消融学》,浙江大学出版社2013年版)
如果以假性 δ 波时间≥54ms、IDT≥70ms、MDI≥0.54作为鉴别DGCV组与ASOV组(即LCC组、RCC组及L-RCC组)、ILCC和Endo-MAA的指标,则其灵敏度、特异度、阳性及阴性预测值见表8。

表5DGCV不同部位VAsECG特征的比较
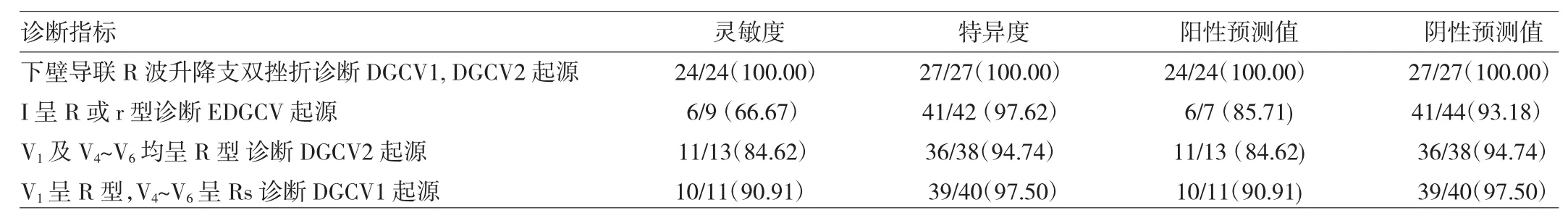
表6 不同指标对DGCV不同起源VAs的鉴别价值[例(%)]

表7DGCV与Endo-MAA、ASOV、ILCC起源VAsECG指标的比较

表8 假性δ波、IDT、MDI在DGCV与ASOV、ILCC及Endo-MAA起源VAs中的鉴别价值[例(%)]
由表8可见,假性δ波时间≥54ms对鉴别DGCV组与LCC、RCC、L-RCC、ILCC和Endo-MAA具有更高的灵敏度与特异度。
3 讨论
特发性室性心律失常中,起源于RVOT为最常见的类型,其次为LVOT及其邻近结构,还有少部分起源于三尖瓣环、二尖瓣环、主动脉瓣和二尖瓣联合区、肺动脉干甚至心外膜[6-8]。尽管起源点及临床表现形式不同,但其机制均为环腺苷酸介导的触发活动,依赖于细胞内的钙负荷和延迟后除极,可为增加心率的方式、程序刺激及正性变时性药物所诱发[9]。
起源于VOT部位的VAs,其ECG在下壁导联均呈高R波,但在其他导联上则不同。一般而言,V1~V3导联QRS波群主波向下呈rS型,胸前导联移行区在V3或之后,起源于RVOT;反之,则起源于LVOT,V1导联QRS波群主波向下或向上呈rS、RS或Rs型,V2导联QRS波群主波向上呈rs或Rs(r/s>1)型,胸前导联移行区在V2导联或之前[7],但部分患者可表现为rV1>rV2,胸前导联移行区在V2~V3,此时应根据V1、V2导联R波时限比值及R波振幅比值进行判断,若R波时限比值≥50%、R波振幅比值≥30%,则起源于 LVOT,反之起源于 RVOT[10]。Betensky等[11]认为若胸前导联移行窦律下早于VAs下的胸前导联移行,可以100%排除VAs起源LVOT,而两者相等或前者稍晚,则计算V2导联的移行比,该比值≥0.6对于预测LVOT起源的VAs有95%的灵敏度和100%的特异度。Yoshida等[3]注意到现行的判定标准在心脏转位患者中的预测价值有限,提出了移行指数,移行指数>0对起源于LVOT的VAs预测灵敏度及特异度分别达88%和82%。
本研究对272例消融成功的LVOT及其邻近结构VAs,根据有效靶点的起源,分为LCC、RCC、L-RCC、ILCC、Endo-MAA及DGCV移行区6组,先对前5组进行ECG特征分析,结果发现:(1)RCC组(91.43%)及 LRCC组(93.75%)在Ⅰ导联呈R、r或Rs型明显高于LCC组的19.09%及ILCC组26.19%和Endo-MAA组的0(均P<0.01);(2)虽然这些起源VAs在下壁导联均呈R型,在aVR、aVL导联均呈QS型,但其R波高度及QS波深度的分布特征有所不同,RCC组(94.29%)及L-RCC组(93.75%)表现为RⅡ>RⅢ、QSaVR>QSaVL,而另3组则相反,多数表现为RⅢ>RⅡ、QSaVL>QSaVR(均P<0.01);(3)ILCC 组(73.81%)及 Endo-MAA 组(88.89%)在V1导联呈R型,胸前导联移行在V1之前(分别为92.86%及100.00%),而RCC组及LCC组呈rS型(分别占 80.00%及 55.45%),胸前导联移行多数在 V2~V3,V1导联呈qrS或QS型为L-RCC组(100.00%);(4)ILCC组(78.57%)及Endo-MAA组(100.00%)在下壁导联R波降支有切迹,而另3组很少有切迹;(5)ILCC组与Endo-MAA组的主要区别是后者在V4~V6导联呈Rs型,前者呈单向R型。若以Ⅰ导联呈R、r或Rs型作为诊断RCC及LRCC起源VAs的指标;以V1及V4~V6导联呈单向R型作为诊断ILCC起源VAs的指标;以V1呈R型、V4~V6导联呈Rs型作为诊断Endo-MAA起源VAs的指标;以V1导联呈qrS型作为诊断VAs起源于L-RCC的指标,V1呈qrS或QS诊断L-RCC起源;则其灵敏度、特异度、阳性及阴性预测值分别为92.16%、81.18%、59.47%、97.87%;73.81%、97.21%、86.11%、94.05%;88.89%、99.01%、88.89%、99.01%;100.00%、96.59%、69.57%、100.00%。
此外,本研究对第6组即51例DGCV不同起源VAs的ECG特征分析显示,若以下壁导联存在升降支双挫折作为诊断DGCV1、DGCV2起源VAs的指标;以Ⅰ呈R、Rs或r型作为诊断EDGCV起源的指标;以V1及V4~V6均呈R波作为DGCV2起源的指标;以V1呈R型V4~V6呈Rs波作为DGCV1起源的指标,则其灵敏度、特异度、阳性及阴性预测值分别为100.00%、100.00%、100.00%、100.00%;66.67%、97.62%、85.71%、93.18%;84.62%、94.74%、84.62%、94.74%;90.91%、97.50%、90.91%、97.50%。另发现,DGCV不同亚组具有更长的假性δ波时间,若以假性δ波时间≥54ms作为鉴别DGCV组与LCC、RCC、ILCC和Endo-MAA的指标,则其灵敏度为86.27%、特异度为90.95%、阳性预测值为68.75%、阴性预测值为96.63%。
据此我们提出LVOT及其邻近结构不同起源VAs的鉴别流程见图4。

图4 LVOT及其邻近结构不同起源VAs的ECG鉴别流程(参考自中华心血管病杂志2017第45卷第4期第312页,本流程与其略有不同)
本研究的不足之处是:(1)未能对所有(仅入选消融成功)的LVOT及其邻近结构的VAs的ECG特征进行比较与分析,可能存在抽样偏倚;(2)仅为回顾性分析,未能对鉴别流程作进一步前瞻性的验证。今后我们将收集更多的病例,对本鉴别流程作进一步前瞻性研究。
