Bcl-2/Beclin1复合物对细胞凋亡与自噬的调节作用*
2019-07-09高维娟
张 怡,高维娟
(河北中医学院/河北省中医药防治心脑血管病基础研究重点实验室,河北石家庄 050091)
细胞凋亡(apoptosis)和细胞自噬(autophagy)是细胞自我销毁的两种主要机制。凋亡,又称为I型程序性细胞死亡,表现为细胞皱缩、染色质浓缩、DNA降解和片段化,细胞分裂成凋亡小体,随后被吞噬细胞吞噬、降解[1]。自噬,又称为II型程序性死亡,是一个高度保守的细胞内进化过程。具有双层膜结构的自噬体包裹长寿蛋白和受损细胞器,并与溶酶体融合,通过溶酶体途径移除,在溶解长寿蛋白和受损细胞器的过程中释放能量,从而为细胞供能[2-3]。大量研究发现,细胞凋亡和细胞自噬之间存在着错综复杂的关系。多种刺激因素,如电离辐射、内质网应激、缺氧缺血、化疗药物等均可导致凋亡和自噬的发生,但由于刺激的程度和刺激时间的不同,凋亡和自噬的强弱也有所差别。如在脑缺血早期阶段,细胞自噬被迅速激活,并抑制细胞凋亡的发生,凋亡和自噬以相互排斥的形式发展;但随着缺血时间的延长,自噬被过度激活,导致细胞受损,进而引发细胞凋亡的发生,并最终通过凋亡依赖途径诱导细胞死亡[4]。细胞凋亡和自噬之间可能存在着某种“切换开关”,确定二者的“切换开关”对于某些疾病,如肿瘤、脑缺血、神经退行性病变的治疗及药物研发等具有重要意义。Bcl-2是重要的凋亡调控蛋白,具有抗凋亡的作用,大量研究证实,Bcl-2还可通过结合Beclin1对细胞自噬起到调控作用[5]。Beclin1是细胞自噬的关键调控因子,主要参与自噬体的形成[6]。研究证实,Beclin1与细胞凋亡亦有密切关系,可通过调节Bcl-2的功能调控细胞凋亡。因此,Bcl-2/Beclin1复合物被认为是细胞凋亡和自噬的“活性开关”。根据近年来国内外相关报道,本文对Bcl-2/Beclin1复合物在细胞凋亡和自噬中的调控作用进行综述。
1 Bcl-2
Bcl-2(B-cell lymphoma 2)家族对细胞凋亡具有重要的调控作用。根据Bcl-2家族的结构和作用,可以将其分为3大类:①含4个结构域BH1-4,并含有1个疏水的BH3(Bcl-2-homology-3)结合沟的抗凋亡蛋白:Bcl-2、Bcl-XL、Bcl-W、Mcl-1、CED9等,具有抗凋亡作用;②含有3个结构域BH1-3的促凋亡蛋白Bax、Bak、Bok等,发挥促凋亡作用;③仅含有BH3的促凋亡蛋白,如Bik、Bid、Bim等[7],可通过与Bcl-2蛋白结合,从而释放促凋亡蛋白,或直接激活促凋亡蛋白,从而促进凋亡的发生(图1[10])。Bcl-2家族被认为是三方凋亡开关,它通过家族内部成员的相互作用实现对细胞凋亡的调控,抗凋亡蛋白和促凋亡蛋白之间的平衡决定细胞的存活或死亡[8]。其中,抗凋亡蛋白Bcl-2因具有拮抗细胞凋亡的功能而被医学界广泛熟知。近年来,抗凋亡蛋白Bcl-2在抑制自噬方面的作用受到越来越多的关注,它可通过与自噬相关蛋白Beclin1结合,抑制细胞自噬的发生[9]。Bcl-2的这种抗自噬功能对细胞发挥保护作用,可通过抑制Beclin1突变体诱导的过度自噬维持细胞的存活。
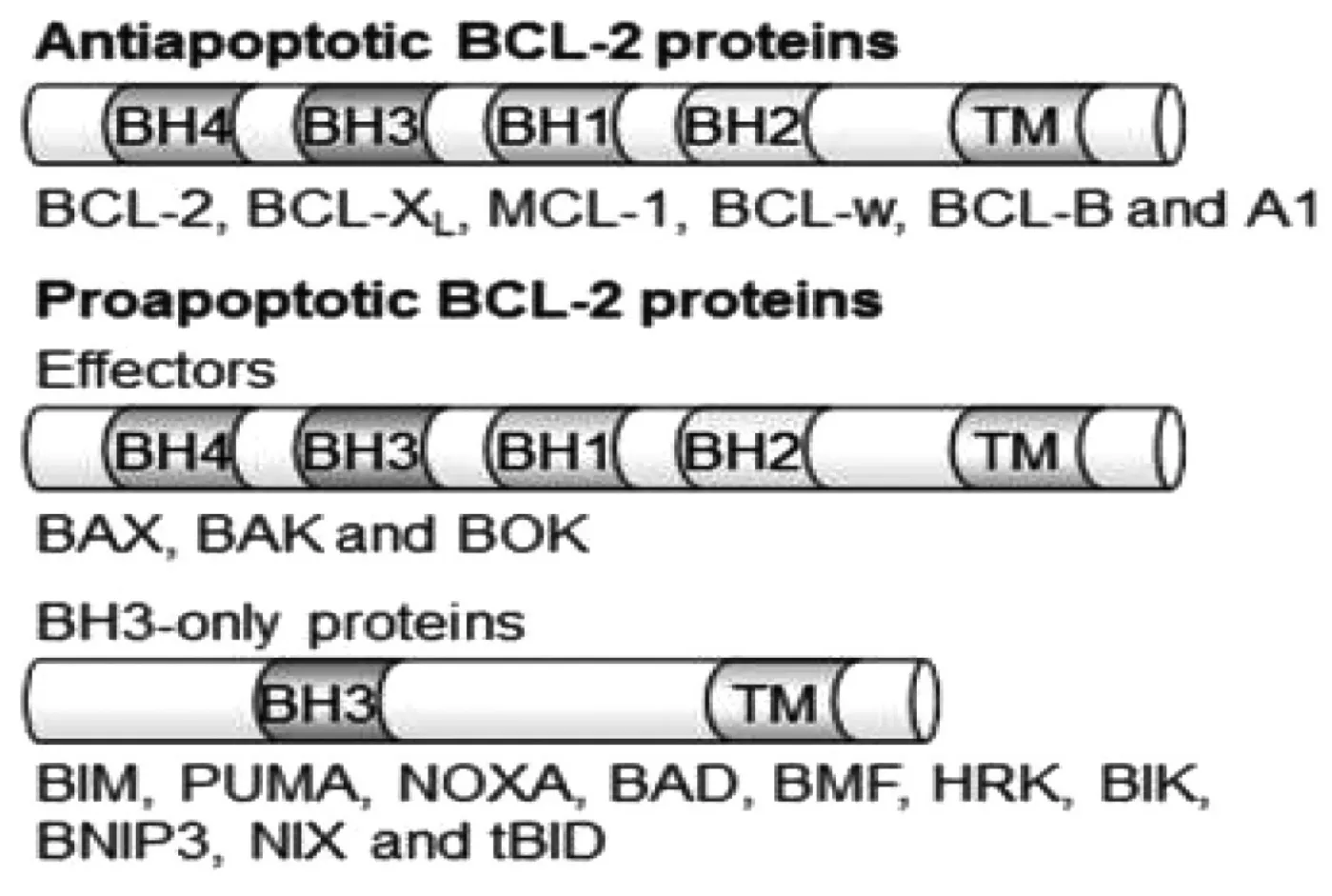
图1 Bcl-2家族分类及结构图
2 Beclin1
Beclin1,也称BECN1基因,是酵母自噬相关基因Atg6/Vps30的哺乳动物同源基因,位于人类染色体17q21位点,蛋白分子质量约为60kD,主要定位于细胞质结构,如内质网(ER)和线粒体内。Beclin1是首个被鉴定的介导哺乳动物自噬的基因,是细胞自噬的一个关键调控因子,它可招募自噬关键蛋白到自噬体前体,与Vps34和ps15形成复合物[11],调节细胞内自噬的活性。Beclin1含有450个氨基酸,形成3个结构域:Bcl-2结合部位、螺旋-螺旋结构域(coiled-coil domain,CCD)及进化保守结构域(evolutionarily conserved domain,ECD)。此外,Beclin1还含有富含亮氨酸的氨基酸序列,负责有效地核输出信号(NES)[12](图2)。许多自噬调控蛋白通过与Beclin1不同结构域相结合,形成蛋白复合体调控自噬水平。凋亡抑制因子Bcl-2同样可以通过BH3结构域与Beclin1结合,阻止Beclin1依赖的细胞自噬的发生,导致细胞凋亡。因此,Beclin1通过与自噬相关蛋白结合或与凋亡相关蛋白结合决定细胞发生自噬或凋亡[13]。
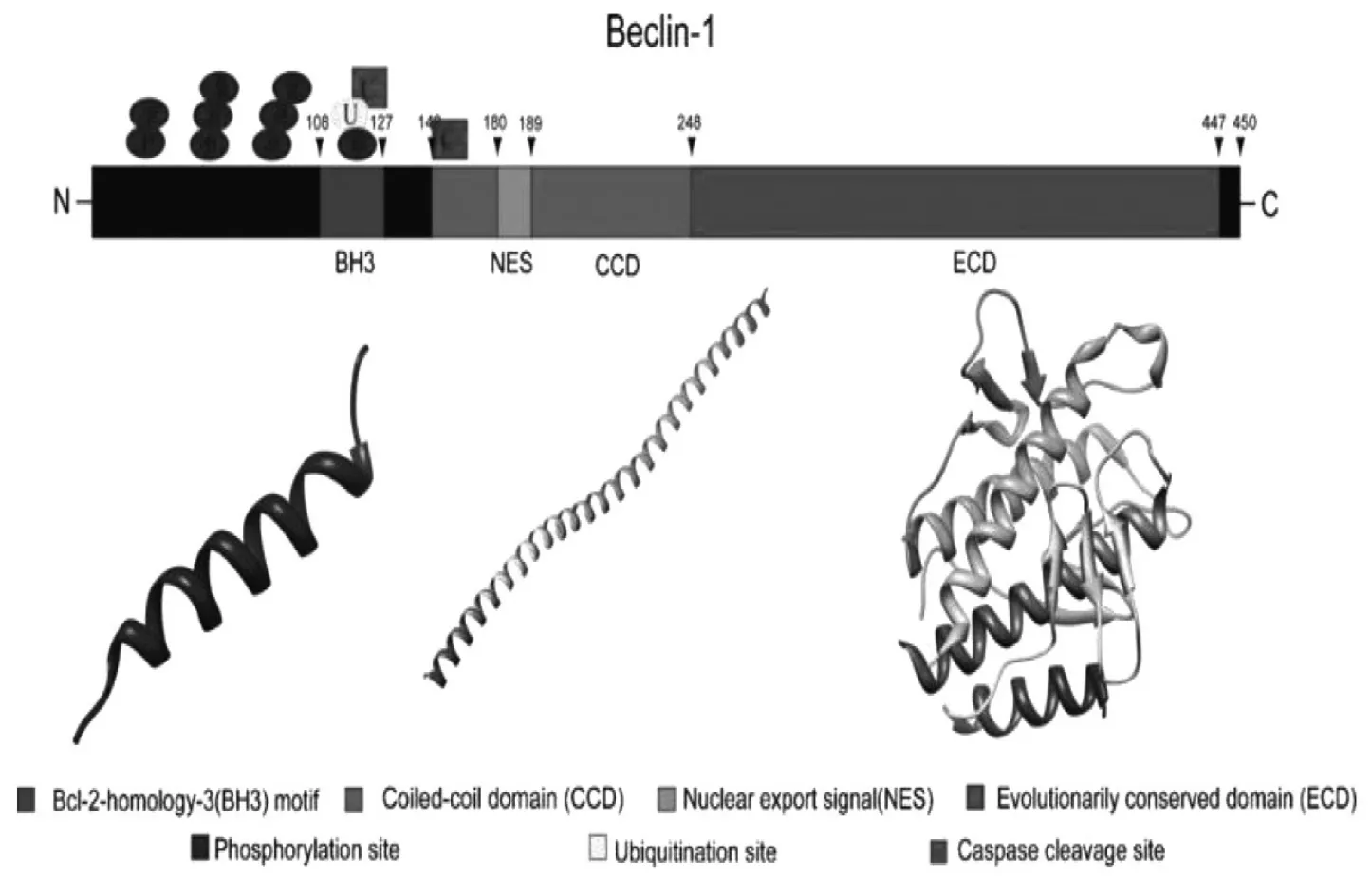
图2 Beclin1结构图
3 Bcl-2/Beclin1复合物对细胞调亡和自噬的调控作用
凋亡和自噬在维持细胞自稳态中发挥着重要作用,二者之间存在着错综复杂的关系[14]。目前认为,在介导细胞死亡的过程中,凋亡和自噬可能存在以下几种关系[13]:①两种程序同时或者先后启动,协同促进细胞的死亡;②自噬抑制凋亡的发生,自噬通过清除受损细胞器或蛋白,为细胞重新供能,使细胞免于凋亡;③自噬促进凋亡相关特征的显现,但并不作为诱发细胞死亡的直接原因。多种调控元件(如鞘脂、神经酰胺、MAPk、DRP-1等)及信号通路(如PI3K/Akt信号通路)参与了对细胞凋亡和自噬的调控[15],而Bcl-2/Beclin1复合物在凋亡和自噬的发生发展中起到了“切换开关”的作用[16],它决定着细胞是进入凋亡程序还是启动自噬程序。Beclin1可以通过其BH3结构域与Bcl-2蛋白结合,使Bcl-2与促凋亡蛋白Bax解离,从而激活细胞凋亡;而Beclin1与Bcl-2的结合同时阻断了Beclin1对自噬前体的作用,从而抑制了自噬的发生[17]。
3.1 Beclin1和Bcl-2的表达水平对凋亡和自噬的影响 目前,关于Beclin1和Bcl-2的表达水平对凋亡和自噬的影响,主要集中在肿瘤的发生机制和肿瘤耐药性的研究。研究发现,在许多肿瘤疾病中Beclin1的表达水平显著降低,而Bcl-2的表达水平则明显上调[18-19]。Beclin1低表达导致自噬清除受损细胞器的能力下降,产生大量活性氧及基因毒性应激,从而导致细胞转化。临床研究表明,40%~75%的乳腺癌和卵巢癌中存在Beclin1蛋白的丢失,Beclin1蛋白的丢失可能使肿瘤细胞逃避自噬性死亡,从而促进肿瘤细胞的存活[20]。但在直肠癌中,Beclin1却呈现高表达,采用RNAi技术抑制直肠癌细胞Beclin1的表达后,可有效抑制直肠癌细胞的自噬及增殖,促进直肠癌细胞凋亡[21]。这些研究结果表明,Beclin1可通过影响细胞自噬与凋亡,从而影响肿瘤的发生与预后,但Beclin1调控肿瘤细胞凋亡和自噬的具体机制尚未明确。Bcl-2不仅具有抗凋亡作用,同时还可通过与Beclin1相互作用,发挥抑制自噬的作用。在MCF-7细胞中,LIMA等[22]通过RNA干扰技术下调Bcl-2表达诱导的细胞死亡较对照组升高了50%,而其中凋亡仅占该细胞死亡的11%,因此,该研究认为,自噬性细胞死亡可能是造成额外细胞死亡的原因之一。Beclin1的基础表达可使机体在应对应激刺激做时首先做出自噬反应,从而抑制细胞凋亡的出现;但当Beclin1的表达下调或缺失时,可导致细胞自噬功能异常,从而诱导细胞凋亡性死亡的发生[23]。与在MCF-7人乳腺癌细胞系和U87人胶质瘤细胞系的研究中得出的结果相似,在肥厚性瘢痕成纤维细胞的研究中证实,过表达的Bcl-2会抑制Beclin1表达的升高及自噬体的形成,而下调Bcl-2的表达则有助于Beclin1的激活和自噬的发生[24]。在HEPG2肝癌细胞系中,采用ABT737抑制Bcl-2的表达导致促凋亡相关基因及自噬相关基因(如Beclin1、LC3等)表达升高,诱导细胞自噬的激活以及细胞的死亡[25]。
3.2 Bcl-2/Beclin1复合物的细胞定位及其所结合的因子对凋亡和自噬的影响 Bcl-2/Beclin1的相互作用对凋亡和自噬的影响,除了受Bcl-2和Beclin1表达水平的影响外,同时还受细胞定位的影响。研究表明,Bcl-2和Beclin1的相互作用存在于内质网和线粒体之中[26],但只有定位于内质网的Beclin1和Bcl-2相互作用对自噬具有调节作用,而定位于线粒体的Bcl-2则主要发挥对细胞凋亡的调节作用,无调控自噬的功能[27]。
除受细胞定位的影响外,与Bcl-2和Beclin1相结合的因子对Bcl-2/Beclin1的切换开关作用也有重要影响。Beclin1和Bcl-2可与其它的自噬调节蛋白在不同的细胞位置形成复合物,从而影响凋亡和自噬的进程。研究证实,自噬相关蛋白AMBRA1(activating molecule in Beclin1-regulated autophagy)作为一个自噬的关键调节因子,与Beclin1和Bcl-2均能相互作用。当受到自噬刺激时,磷酸化自噬相关基因Ulk1(unc-51 like kinase 1)磷酸化AMBRA1,从而使AMBRA1从动力蛋白复合体(dynein motor complex)中分离,分离后的AMBRA1易位到内质网,与自噬启动复合体中的Beclin1结合,从而导致细胞自噬的发生[28]。高迁移率族蛋白1(high mobility group box-1 protein,HMGB1)是一种Beclin1结合蛋白,对维持自噬起着重要作用,它能够和Bcl-2竞争与Beclin1的相互作用,并将Beclin1定位于自噬体。Bcl-2/E1B-19kDa相互作用蛋白3(BCL2/adenovirus E1B 19kDa interacting protein 3,BNIP3),是另一种通过与Bcl-2结合,从而抑制Bcl-2与Beclin1形成复合物的蛋白质,它通过其BH3结构域与Bcl-2结合,从而使Bcl-2/Beclin1解离,激活细胞自噬[29]。
3.3 Bcl-2/Beclin1通过Ser/Thr蛋白激酶调控凋亡和自噬 除受细胞定位和结合因子的影响外,Ser/Thr激酶,包括死亡相关蛋白激酶(death-associated protein kinase,DAPK)、JUN N-末端激酶1(c-Jun N-terminal protein kinase 1,JNK1)和AKT(也称为PKB),均参与了对Bcl-2/Beclin1复合物的调控[30]。DAPK在BH3结构域(Thr119)对Beclin1进行磷酸化,从而诱导Bcl-2/Beclin1复合物的解离,最终促进自噬的发生;还有研究还发现,DAPK能够通过调节Bcl-2/Bax的表达水平,从而诱导内皮细胞凋亡的发生[31]。凋亡和自噬进程还受JNK1介导的Bcl-2磷酸化的调节[32]。WEI等[33]研究发现,在营养缺乏的情况下,JNK1蛋白被激活,并导致Bcl-2位于BH4和BH3结构域之间的包括Thr69、Ser70、Ser87在内的多个残基磷酸化。但根据营养缺乏持续时间的不同,JNK1介导的Bcl-2磷酸化对凋亡和自噬的影响也不同。JNK1介导的Bcl-2的快速磷酸化可以通过解离Bcl-2/Beclin1复合物激活自噬,从而促进细胞存活;但当营养缺乏16h后,JNK1介导的Bcl-2磷酸化就转变为解离Bcl-2/Bax复合物,从而激活Caspase-3凋亡信号通路,促进细胞凋亡的发生[34]。另有研究表明,促凋亡蛋白激酶Mst1能够通过磷酸化Beclin1协调自噬和凋亡的关系,同时调节Bcl-2、Beclin1和Bax三者间的相互作用[35]。
4 小结
细胞凋亡和自噬作为机体的两种进化保守机制,在维持组织内稳态、机体发育和疾病发生发展过程中发挥着核心作用,二者之间关系密切。受所受到的刺激因素及所处疾病阶段的影响,凋亡与自噬相互排斥,又协同发生、同步增强。细胞凋亡和自噬之间存在错综复杂的关系,Bcl-2/Beclin1复合物在二者的切换中起着至关重要的作用。Bcl-2/Beclin1复合物可以作为“变阻器”发挥对凋亡和自噬的调节作用,确保凋亡及自噬水平均保持在稳态范围内,其对凋亡和自噬的调控作用受Bcl-2和Beclin1的表达水平、细胞定位、所结合的因子及Ser/Thr蛋白激酶等多种因素的调控。但是,凋亡和自噬的相互关系十分复杂,不仅受Bcl-2/Beclin1复合物的调节,还受到一些其它信号通路和信号因子的调控。因此,对于凋亡和自噬的关系仍需要进一步深入探讨,明确凋亡和自噬间的相互作用,无论是对正常的生长发育过程或是疾病的发生及进展过程都具有重要的意义。
