天府肉鹅母系不同阶段颗粒细胞内参基因的选择
2019-07-08莫远亮王郁石王继文
莫远亮,王郁石,王继文
(四川农业大学动物科技学院/畜禽遗传资源发掘与创新利用四川省重点实验室,成都 611130)
实时荧光定量聚合酶链式反应(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)是基于荧光信号的变化实时监测PCR扩增反应中每一个循环扩增产物量的变化,通过Cq值和标准曲线的关系对起始模板进行定量分析[1]的方法,该方法具有快速、灵敏性高、特异性强、通量大等特点,在当今生物学研究中被广泛应用。在RT-qPCR应用中,由于不同样品间RNA的产量、质量、反转录效率及PCR反应扩增效率等存在差别,从而影响定量分析的准确性,因此需要引入稳定表达的内参基因予以校正[2]。理想的内参基因应该是在所研究的组织、细胞和各种实验条件下均能够恒定表达的基因[3]。但是,由于内参基因的表达具有物种、组织及阶段特异性,不存在通用于多种细胞、组织和实验条件的内参基因。如若使用未经筛选验证的内参基因进行校正,则目标基因表达水平的定量分析可能出现较大的偏差[4]。因此,需要根据细胞和组织类型、细胞增殖和器官发育的阶段、实验条件的不同,筛选出相对合适的内参基因及确定其数目,对数据进行校正和标准化,以获得准确可靠的基因表达分析[5]。
KHAN等[6]在对牛的优势卵泡颗粒细胞的内参基因表达分析时发现,UBE2D2和EIF2B2在分娩期和卵泡成熟期表达较为稳定。BADDELA等[7]对牛的颗粒细胞在不同氧浓度和不同密度培养条件下做了内参基因的选择,发现TBP和B2M在2种条件下均能稳定表达。Lü等[8]为筛选在正常和多囊卵巢综合征患者的颗粒细胞中稳定表达的内参基因,从15个常用内参基因中筛选出了HPRT1、PRLP0、HMBS3个稳定表达的内参基因。目前有关颗粒细胞内参基因选择的研究报道相对较少。颗粒细胞对禽类卵泡的生长发育至关重要,而禽类的卵泡发育遵循严格的等级发育制度[9-10],因此,研究颗粒细胞在不同阶段各基因的表达水平对探究禽类卵泡的选择募集机制具有重要意义。本课题组前期研究发现,部分常用内参基因GAPDH、TUB、B2M在不同阶段颗粒细胞中表达不稳定。因此,本文以天府肉鹅母系卵泡颗粒细胞层为材料,选取常用的10个内参基因作为候选内参基因,利用RT-qPCR技术获取内参基因 的Cq值 ,采用 ΔCT法[11]、qbase+[12]、NormFinder[13]、BestKeeper[14]4种方法评价内参基因的稳定性,以期获得在不同阶段颗粒细胞中稳定表达的内参基因,为后续相关研究中内参基因的选择提供参考。
1 材料与方法
1.1 试验材料
试验所用的天府肉鹅母系来自四川农业大学家禽育种场。本试验选用3只健康的、开产时间和体质量基本一致,处于产蛋高峰期的天府肉鹅母系母鹅。放血处死后,迅速取出整个卵巢,分离出不同直径大小的卵泡,用游标卡尺测量不同卵泡横轴直径后,参照GILBERT等[15]所述方法分离不同阶段(2~4 mm、4~6 mm、6~8 mm、8~10 mm、F5、F4、F3、F2、F1)卵泡颗粒细胞,用磷酸盐缓冲溶液(phosphate buffer saline,PBS)漂洗3~4次,剪碎后置于-80℃冰箱中冻存,备用。
1.2 总RNA的提取及cDNA的合成
采用RNAiso Plus(TaKaRa公司,日本)提取鹅卵泡颗粒层组织总RNA,利用NanoDrop 2000紫外分光光度计检测总RNA的浓度和纯度。采用1.0%琼脂糖凝胶电泳检测RNA完整性。按照RR047A型PrimeScriptTM(TaKaRa公司,日本)说明书反转录合成cDNA,于-20℃冰箱内保存,备用。
1.3 引物设计及标准曲线的构建
根据文献[16-22]报道,选择GAPDH、ACTB、TUB、HMBS、HPRT1、UBC、TBP、SDH、18S、28S等10个常用内参基因作为候选内参基因,进行表达稳定性分析。引物由北京擎科新业生物技术有限公司合成,候选内参基因的引物信息见表1。构建标准曲线时,将cDNA模板按10倍浓度梯度稀释为7个浓度后,进行RT-qPCR扩增,以获取10个内参基因引物的扩增效率。

表1 候选内参基因引物信息Table 1 Primer information of candidate reference genes
1.4 实时荧光定量PCR
RT-qPCR在Bio-Rad CFX96荧光定量PCR仪上采用两步法进行。RT-qPCR使用25 μL反应体系:SYBR®Premix ExTaqⅡ 12.5 μL,ddH2O 8.5 μL,上下游引物各1.0 μL(10 μmol/L),cDNA模板 2.0 μL。RT-qPCR扩增条件为:95℃预变性30 s;95℃变性5 s,60℃退火、延伸30 s,40个循环;熔解曲线为55~95℃,每5 s增加0.5℃,以检测引物特异性。
1.5 数据分析
通过CFX-Manager 3.1软件获得各个样本的Cq值。根据公式Q=EΔCT,其中,ΔCT=CTmin-CT样品,E为基因扩增效率,利用Excel 2013计算出每个扩增样品的表达量Q。采用 ΔCT、qbase+(geNorm)、NormFinder、BestKeeper等方法综合评价候选内参基因的稳定性。由于每种方法基于不同的算法,使得所得到的结果可能会有差异,为了避免使用单一评价方法的片面性,因此可综合使用多种评价方法[23]。本研究对4种分析方法所得到的评价排名取几何均数,以最终的综合排名指数来判定内参基因的稳定性,该指数越小,则内参基因表达越稳定。
2 结果与分析
2.1 内参基因引物特异性检测
RT-qPCR熔解曲线分析结果如图1所示,普通PCR扩增结果如图2所示。可以看出,引物扩增片段单一,熔解曲线除主峰外没有其他杂峰,说明无引物二聚体和非特异性条带产生,所用内参基因引物均为特异性扩增。
2.2 标准曲线的构建
以拷贝数的对数值为横坐标,Cq值为纵坐标作标准曲线。通过计算得知,10个内参基因的扩增效率范围为82.10%~108.68%,决定系数R2变化范围为0.981~0.999(表2),表明各内参基因在系列稀释的浓度梯度内具有良好的线性关系。
2.3 内参基因在颗粒细胞中的表达丰度分析
Cq值与基因的表达量呈反比,Cq值越大,基因的表达量越低;反之,Cq值越小,基因的表达量越高。图3显示,10个候选内参基因在不同阶段颗粒细胞中表达的Cq值在10~29之间,其中SDH和TBP的表达量较低,而18S、28S的表达量均较高。

图1 候选内参基因的RT-qPCR熔解曲线Fig.1 RT-qPCR melting curves of candidate reference genes
2.4 内参基因的稳定性分析
利用ΔCT法和qbase+、NormFinder、BestKeeper 3个软件对候选内参基因在9个不同阶段颗粒细胞中的表达稳定性进行分析,结果如图4所示。ΔCT法是通过计算各基因的平均标准偏差(s)来确定内参基因的稳定性,平均标准偏差越小,基因稳定性越高,故最稳定的内参基因为HMBS。qbase+(geNorm)可计算各候选内参基因的表达稳定值(M),M越小,基因稳定性越高。NormFinder与geNorm程序相似,也是根据内参基因表达稳定值(M)大小来判断内参基因的稳定性。根据M值越小,表达越稳定的原则,qbase+和NormFinder 2种方法得到的最稳定内参基因均为SDH。BestKeeper通过计算每个基因之间产生配对的相关系数(r),以标准偏差(s)和变异系数(CV)来判断基因表达的稳定性,相关系数越大,s和CV的值越小,表明基因表达越稳定,当s>1时,则该内参基因表达不稳定,故最稳定的内参基因为18S。用4种方法对内参基因稳定性进行分析所得到的结果不尽相同,因此需要对4种方法得到的结果进行综合排序。对每一个内参基因采用4种方法所得到的排名取几何均数,得到最终的排名,结果见表3。在不同阶段颗粒细胞中,最稳定的3个内参基因依次为SDH、HMBS、18S,而稳定性最差的3个内参基因为UBC、GAPDH、TUB。

图2 内参基因的PCR扩增Fig.2 PCR amplification of reference genes

表2 候选内参基因的标准曲线Table 2 Standard curves of candidate reference genes
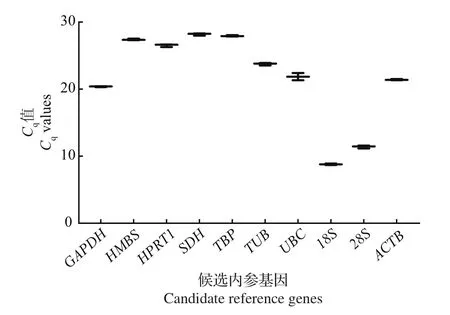
图3 候选内参基因在颗粒细胞中的Cq值Fig.3 Cqvalues for candidate reference genes in granulosa cell

图4 基于不同方法的内参基因稳定性分析结果Fig.4 Reference gene expression stability analysis by ΔCT(A),qbase+(B),NormFinder(C),BestKeeper(D)

表3 内参基因表达稳定性综合排序Table 3 Comprehensive ranking of reference gene expression stability
2.5 最佳内参基因数目的确定
在qbase+中的geNorm程序还可利用标准化因子进行配对差异分析来评定所需内参基因的最佳数目。V值为引入1个新的内参基因后标准化因子的配对变异值(pairwise variation),当Vn/Vn+1<0.15时,不再需要引入下一个内参基因进行校正,则最佳内参基因数为n个;而当Vn/Vn+1>0.15时,需要引入下一个内参基因进行校正,则最佳内参基因数为n+1个。由图5可以看出,V2/V3<0.15,不需要引入第3个内参基因,因此在不同阶段颗粒细胞中的最佳内参基因数为2个,结合以上内参基因稳定性分析的结果,在不同阶段颗粒细胞中,可使用HMBS和SDH作为内参基因,同时可根据二者的校正因子的几何均数算出最适的校正因子。
2.6 内参基因稳定性的验证

图5 最佳内参基因数目的确定Fig.5 Determination of the optimal number of reference genes
为了进一步验证筛选得到的内参基因的稳定性,选取最稳定的2个内参基因(SDH和HMBS)来分析FSHR基因在不同阶段颗粒细胞中的表达规律,同时选取表达最不稳定的内参基因(UBC和GAPDH)作为对照。FSHR在禽类等级前卵泡活性维持及等级卵泡的选择中起决定作用,FSHR在直径为1~2 mm的卵泡颗粒层就已开始表达,在卵泡直径为6~12 mm时表达量最高,而在等级卵泡颗粒层中逐渐降低[24-25]。图6显示,FSHR在鹅的颗粒细胞中表达也呈现出类似的规律,与使用GAPDH-UBC进行校正相比,使用SDH-HMBS进行校正得到的结果更符合FSHR的表达规律。在使用GAPDH-UBC进行校正后,FSHR在8~10 mm的卵泡颗粒层中表达量显著降低,而在F3、F1阶段则显著高于SDHHMBS的校正结果。
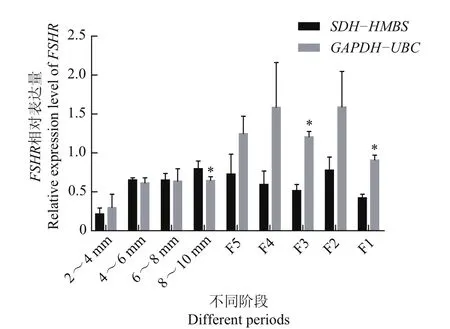
图6 FSHR在不同阶段颗粒细胞中的表达分析Fig.6 Relative expression of FSHR in different periods of granulosa cells
3 讨论
内参基因是指其表达水平不受研究条件的影响,且可以在多种组织和细胞中稳定表达的基因。但内参基因的稳定表达是相对的,内参基因的表达因物种、组织、细胞、阶段和研究条件的不同而变化[26]。目前,内参基因的稳定性评价主要通过geNorm、NormFinder、BestKeeper等系列软件计算出相关参数来进行,并根据稳定性高低进行排序。VANDESOMPELE等[12]于2002年编写出一款基于Excel的geNorm程序,这是一款专门用于RT-qPCR分析内参基因稳定性的软件,作为第一个内参基因稳定性评价软件,在内参基因的评价和筛选方面起到了重要作用,是目前使用较广的内参基因稳定性的评价软件[27]。鉴于内参基因稳定性对RT-qPCR结果的重要性,后续又开发出了NormFinder、BestKeeper、ΔCT等多种方法,而这些评价方法均是通过不同的统计学方法来评定内参基因的稳定性的,由于每种软件的算法不同,可能导致用不同方法得到的内参基因稳定性结果不尽相同[23]。为了避免使用单一方法评价造成的片面性,因此可综合使用多种评价方法,对多种分析方法得到的评价排名取几何均数,以最终的综合排名指数来评定内参基因的稳定性,该指数越小,则该内参基因越稳定[28]。本研究采用4种方法分析了10个内参基因在9个不同阶段颗粒细胞中的稳定性,结果表明在不同阶段颗粒细胞中,最稳定的3个内参基因依次为SDH、HMBS、18S,而稳定性最差的3个内参基因依次为UBC、GAPDH、TUB。在获得内参基因的稳定性之后,进一步利用geNorm程序计算出在不同阶段颗粒细胞中最佳内参基因数为2个,并确定SDH和HMBS为最佳内参基因组合。
GAPDH作为在多个物种和组织中被广泛使用的内参基因之一,其稳定性相对较好,然而在禽类不同组织和阶段中的表达具有较大差异性。JI等[29]对籽鹅5个组织在5个生长发育时期做了内参基因的选择,发现28S、ACTB、HPRT1分别在心、肾、肌肉中表达最稳定,而GAPDH在肝和卵巢中表达最稳定。袁振杰等[30]对济宁百日鸡性腺轴在生长阶段中6个不同时间点的内参基因选择进行了研究,发现下丘脑中表达最为稳定的是GAPDH,而在卵巢中表达最为稳定的是ACTB。计红等[31]研究了籽鹅产蛋前期和产蛋期组织内参基因的稳定性,发现GAPDH在产蛋前期和产蛋期均较为稳定,而18S在产蛋期较为稳定,在产蛋前期稳定性较差。前期研究发现,GAPDH在不同阶段颗粒细胞中表达不稳定,GAPDH在等级前卵泡颗粒细胞中表达高于等级卵泡颗粒细胞,而GAPDH是糖异生、糖酵解中的关键基因,可能是由等级前卵泡颗粒细胞处在快速增殖过程中,细胞消耗的能量增加,GAPDH表达水平上调所致。SDH为琥珀酸脱氢酶控制基因,是三羧酸循环的关键酶。HMBS为羟甲基胆素合成酶控制基因,主要参与血红素合成、卟啉代谢、转移酶激活等过程。NASCIMENTO等[20]研究发现,HMBS和HPRT1在鸡的胸肌中表达最稳定,而TRFC和B2M的稳定性最差。SAMIULLAH等[32]研究了产蛋母鸡蛋壳形成过程中不同时间点内参基因的选择,发现HMBS和HPRT1在蛋壳形成不同时间点中表达最稳定。ZHANG等[33]对黄羽肉鸡的内参基因进行筛选,发现RPL13、GAPDH分别为肝和空肠中最佳内参基因,HMBS为所有组织中表达较为稳定的内参基因。本研究以筛选出来的SDH和HMBS为内参基因,所计算出的FSHR的表达量更为准确,由此可见,在鹅卵泡不同阶段颗粒细胞中,以SDH和HMBS为内参基因是合适的,而筛选出来的SDH和HMBS在不同阶段颗粒细胞中稳定表达也是相对的,还与鹅的生长日龄、产蛋状况、生理状态密切相关。
4 结论
本研究综合4种内参稳定性评价方法,成功从10个候选内参基因中筛选出了在不同阶段颗粒细胞中稳定表达的2个内参基因SDH、HMBS,以最稳定的2个内参基因的几何平均数作为标准化校正因子可得到更加准确的结果。
