CCR5第2胞外环特异性拮抗短肽对哮喘小鼠肺组织自噬相关基因的表达和自噬泡形成的影响
2019-07-06刘娟梁蓉蓉张颖丽谢艾岑黄花荣
刘娟 梁蓉蓉 张颖丽 谢艾岑 黄花荣


【摘要】目的研究CC趋化因子受体5 (CCR5)第2胞外环特异性拮抗短肽对哮喘小鼠肺组织自噬相关基因Beclinl、ATG5、LC3的表达和自噬泡形成的影响。方法将40只BALB/c小鼠随机分为5组,每组各8只,空白对照组小鼠予生理盐水腹腔注射致敏、生理盐水滴鼻激发,致敏组小鼠予鸡卵白蛋白(OVA)致敏、生理盐水激发,哮喘模型组小鼠予OVA致敏、OVA激发,地塞米松磷酸钠(Dex)组小鼠予OVA致敏、激發后予Dex尾静脉注射,拮抗短肽组予OVA致敏、激发后予拮抗短肽尾静脉注射。分别采用实时荧光定量PCR、蛋白免疫印迹法和透射电镜评估哮喘小鼠肺组织中自噬水平的变化。结果哮喘模型组的Beclinl、ATG5和LC3 mRNA表达水平及LC3蛋白表达水平均低于空白对照组(P均<0.05),拮抗短肽组的Beclinl、ATG5、LC3mRNA和蛋白表达水平均高于哮喘模型组(P均<0.05)。透射电镜显示,哮喘模型组小鼠肺组织中自噬泡数量较空白对照组稍减少,自噬泡主要位于具有免疫功能的2型肺泡上皮细胞。拮抗短肽组、Dex组中自噬泡数量较模型组增多,但多为未成熟的自噬泡,且自噬泡同样主要位于2型肺泡上皮细胞中。结论哮喘小鼠存在自噬功能障碍,CCR5第2胞外环的特异性拮抗短肽能升高哮喘小鼠肺组织中自噬相关蛋白Beclinl、ATG5和LC3的表达水平。
【关键词】哮喘;自噬;CC趋化因子受体5;拮抗短肽
哮喘是一种以气道高反应性和支气管周围多种炎症细胞浸润为主要特征的慢性炎症性疾病[1]。近年研究显示,自噬作为一种广泛存在于真核细胞中高度保守的分解代谢途径,其功能受损可能与支气管哮喘的发展进程相关[2]。趋化因子及其受体是研究哮喘发病机制和治疗的重要靶点,在募集与激活炎症细胞上发挥至关重要的作用[3]。CC趋化因子受体5(CCR5)为一种跨膜的信号转导蛋白,课题组先前的研究表明CCR5第2胞外环的特异性拮抗短肽对核因子-κB(NF-κB)有明显的调控作用[4]。NF-κB对多种基因的表达有直接的调控作用。有关哮喘小鼠肺组织中CCR5第2胞外环的特异性拮抗短肽对细胞自噬基因的影响,笔者尚未见相关报道。为此,本研究拟探讨CCR5第2胞外环的特异性拮抗短肽对哮喘小鼠肺组织自噬相关基因Beclin1、ATG5、LC3表达和自噬泡形成的影响,为哮喘的精准治疗提供新的方向,现报告如下。
材料与方法
一、材料与仪器
1.实验动物
BALB/c小鼠40只,雌性,6~8周龄,体质量20~229、由广州中医药大学实验动物中心提供,饲养于中山大学东校园实验动物中心的SPF级环境中,本研究方案经中山大学动物实验伦理委员会批准(IACUC-DD-17-1207)。
2.主要试剂与仪器
CCR5第2胞外环的特异性拮抗短肽序列由中山大学孙逸仙纪念医院消化内科钟英强教授惠赠,经上海吉尔生化公司纯化合成。地塞米松磷酸钠购自中山大学孙逸仙纪念医院。用生理盐水分别将拮抗短肽和地塞米松磷酸钠(Dex)注射液稀释成浓度为2.5、3.0mg/kg备用[4]。鸡卵白蛋白(OVA、V级)购自美国Sigmao Trizol试剂盒、实时荧光定量PCR试剂盒购自日本Takara。引物由上海生工生物工程技术服务有限公司设计合成。Beclin 1抗体购自美国Santa Cruzeo ATG5和LC3抗体购自美国Sigmao电镜固定液购自谷歌生物公司。主要仪器包括荧光定量PCR仪(Light Cycler 480,瑞士)和透射电镜(Tecnai Spirit Biotwin,FEI公司)。
二、方法
1.分组及干预
哮喘小鼠模型的构建参照本课题组前期的建立方法[4]。将40只小鼠随机分为5组,每组各8只。空白对照组小鼠予0.1ml的生理盐水腹腔注射致敏、50μl的生理盐水滴鼻激发,致敏组小鼠予0.1ml(含50μg的OVA)相同部位致敏、50μl的生理盐水滴鼻激发,哮喘模型组小鼠予0.1ml含50μg的OVA)相同部位致敏、50μl(含 100μg的OVA)滴鼻激发,Dex组小鼠予模型组等体积、等浓度、同部位的OVA致敏、激发后连续7d予Dex 0.2ml尾静脉注射,拮抗短肽组予模型组等体积、等浓度、同部位的OVA致敏、激发后连续7d予拮抗短肽注射液0.2ml尾静脉注射给药。
2.标本采集
于实验第22日将各组小鼠行断颈处死,予生理盐水经右心室灌注后,待双肺发白后分离肺组织,右肺用于苏木素一伊红(HE)染色,左肺收集后置-80℃冻存备用。
3.哮喘小鼠肺组织中自噬泡的透射电镜观察
处死小鼠后,即取约米粒大小的肺组织投入电镜固定液中,置于4℃C冰箱2h。用磷酸盐缓冲液(PBS)冲洗4次,每次15min、后再用1%饿酸4℃固定2h。经过PBS漂洗和乙醇、丙酮脱水后,进行过夜包埋,制成厚度约50~80nm的切片,用醋酸双氧铀、拘橼酸铅双染后置于透射电镜下观察。
4.Beclinl、ATG5、LC3 mRNA表达水平的检测
采用实时荧光定量PCR检测。先利用Trizol法提取肺组织中的总RNA,根据Takara的逆转录法将RNA逆转录为模板DNA,并进一步参照其反应条件,采用二步法扩增:95℃30s预变性,95℃ 5s持续40个循环,60℃32s退火和延伸。以价actin为内参。引物序列分别为:Beclinl上游5'-GGGTCACCATCCAGGAAC-3、下游5'-CACCATCCTGGCGAG-3',ATG5上游5=GCGGTTGAGGCTCAC-3、下游5,- GGATATTCCATGAGT-3,LO上游5,- GC GCTTGCAGCT-3、下游5'=GTACACTTCGGAGA-3,β-actin上游5'=CCACCATGTACCCAGGCATT-3、下游5'-AGGGTGTAAAACGCAGCTCA-3。结果分析采用△△CT法计算各基因的相对表达水平。
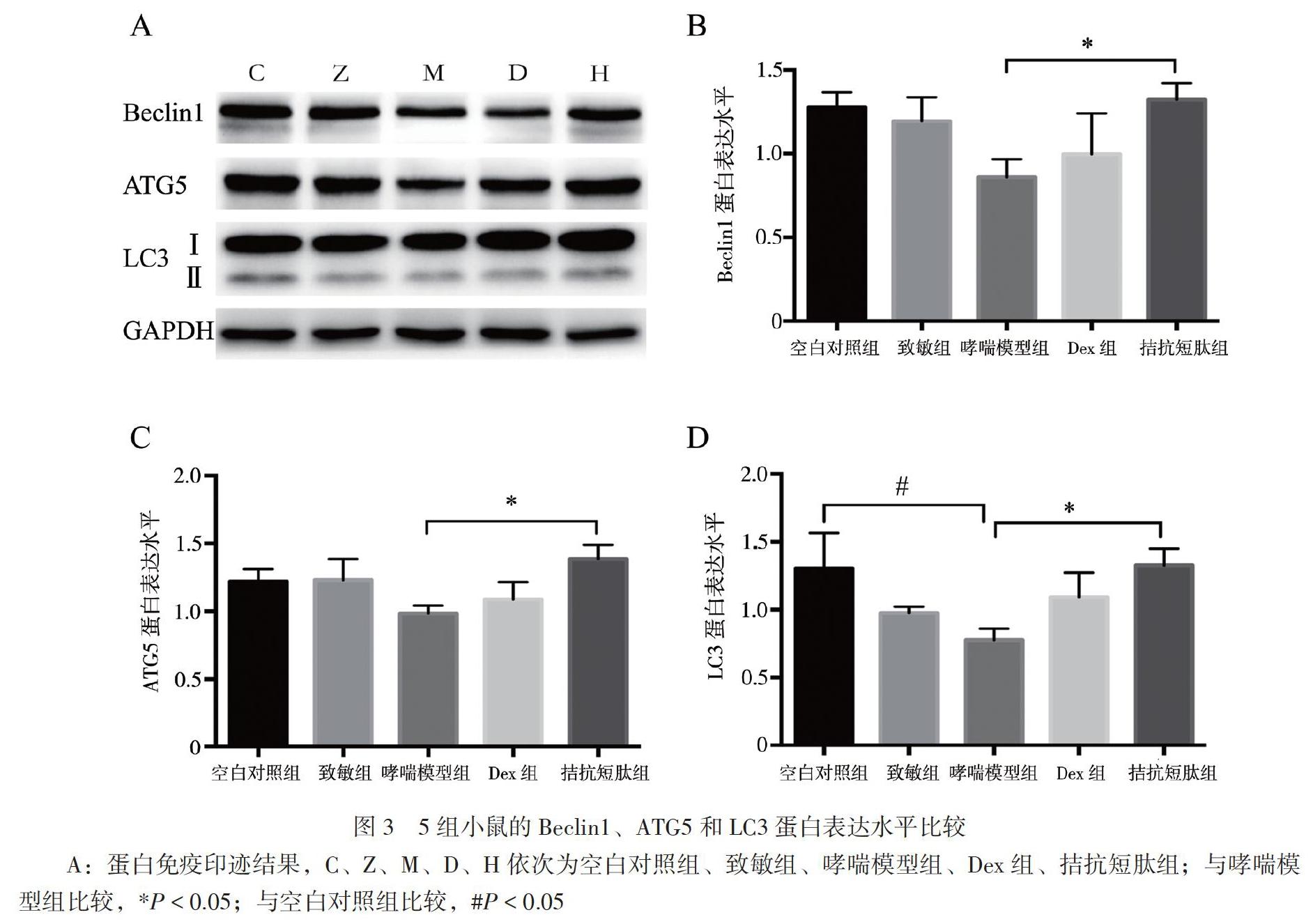
5.Beclin1、ATG5、LC3蛋白表达水平的检测 采用蛋白免疫印迹法检测。先用PIRA裂解液和蛋白酶抑制剂提取肺组织中的总蛋白,用BCA法测相应的蛋白浓度,95℃加热10min使蛋白变性。利用12%分离胶进行十二烷基硫酸钠一聚丙烯酞胺(SDS-PAGE)电泳,然后恒定110V转至聚偏氟乙烯(PVDF)膜上,5%的脱脂奶粉室温下封闭1.5h后,分别敷上一抗Beclinl、ATG5、LC3、GAPDH(抗體稀释比例均为1:1000),4℃过夜。将条带用TBST缓冲液洗4次,每次7min,室温下孵育相应的二抗(1:5000)持续1h、继续用TBST缓冲液洗脱4次,每次7min、用高灵敏度化学发光检测试剂盒进行化学发光反应,显影、定影,用Image J行灰度值分析、Prism 6.0行图像分析。
三、统计学处理
采用SPSS 22.0进行数据分析。符合正态分布的计量资料以x±s表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
结果
一、成功构建由OVA诱导的小鼠哮喘模型
相对于空白对照组和致敏组而言,哮喘模型组中的支气管及伴行的血管周围有大量炎症细胞浸润,以嗜酸性粒细胞和淋巴细胞为主,且支气管的管壁增厚、上皮细胞损伤,表明该小鼠哮喘模型建立成功,见图1。
二、5组小鼠的肺组织自噬相关基因相对表达水平比较
5组小鼠的肺组织Bechnl、ATG5和LC3 mRNA相对表达水平比较差异均有统计学意义(F分别为38.347、19.315、15.143,P均< 0.001)o其中哮喘模型组的Beclinl、ATG5和LC3 mRNA相对表达水平低于空白对照组(P均<0.05),分别约为空白对照组的19%、17%、28%0在利用拮抗短肽和Dex注射液干预之后,Beclinl、ATGS和LC3的mRNA相对表达水平较模型组均有所升高,其中拮抗短肽组的Beclinl、ATG5和LO mRNA相对表达水平分别约为哮喘模型组的2.53、3.41、1.96倍,组间比较差异均有统计学意义(P均<0.05),但Dex组的Beclinl、ATG5和LC3 mRNA相对表达水平与哮喘模型组比较差异均无统计学意义(P均>0.05),见图2。
三、5组小鼠的肺组织自噬相关蛋白表达水平比较
5组小鼠的肺组织Beclinl、ATG5和LO蛋白表达水平比较差异均有统计学意义(F分别为6.260、8.800、11.921,P均<0.001)。哮喘模型组LO的蛋白表达水平低于空白对照组(P<0.05),其Beclinl、ATG5的蛋白表达水平分别约为空白对照组的67%、80%;LO作为自噬形成的标志性蛋白,哮喘模型组蛋白表达水平约为空白对照组的60%。相对于哮喘模型组,自噬相关蛋白Beclinl 、ATG5和LC3的蛋白表达水平在拮抗短肽组均升高,分别为哮喘模型组的1.53、1.42、1.71倍,2组比较差异均有统计学意义(P均<0.05),见图3。
四、5组小鼠的肺组织自噬泡比较
透射电镜显示,哮喘小鼠肺组织中自噬泡数量较空白对照组稍减少,自噬泡主要位于具有免疫功能的2型肺泡上皮细胞。拮抗短肽组、Dex组中自噬泡数量较模型组增多,但多为未成熟的自噬泡,且自噬泡同样主要位于2型肺泡上皮细胞中,见图4。
讨论
哮喘是一种复杂的、多基因作用的气道慢性炎症性疾病,目前的治疗仍以糖皮质激素和β2受体激动剂为主,但随着全球难治性哮喘的发生率逐年升高,寻求新的治疗靶点成为研究的热点之一。
近年国内外的研究以自噬为突破点,寻求其在哮喘中的治疗作用。Puleston等[5]认为,自噬功能缺陷的T、B细胞表现出分化和调节受损。敲除小鼠胸腺中的ATG5基因不仅会减少T细胞在外周血中的数量,还会减弱其受到抗原刺激后的增殖作用,出现严重的免疫耐受障碍[6]。此外,抑制自噬功能将引起活性氧簇的聚集和损伤性线粒体DNA的释放增多[7]。Gu等[8]利用辛伐他汀作用于哮喘小鼠,结果显示哮喘小鼠肺组织中自噬水平低于健康小鼠。上述研究均提示自噬功能低下可能导致支气管哮喘等疾病的发生。本研究也显示,哮喘模型组小鼠的肺组织中自噬相关基因Beclinl、ATG5和LC3 mRNA与蛋白表达水平和自噬泡的数量均低于空白对照组,且自噬泡主要位于同样具有免疫功能的2型肺泡上皮细胞中,进一步阐明在哮喘小鼠的肺组织中,自噬功能存在障碍。
CCR5作为一种调控T细胞和炎症细胞迁移、增殖和活化的趋化因子受体,不仅在炎症性肠病、银屑病、中枢神经系统疾病等发挥作用,还可能促进哮喘的发生与发展[9-10]。本课题组前期已经证实,利用CCR5第2胞外环的特异性拮抗短肽干预哮喘模型小鼠,能有效减轻小鼠肺组织的气道炎症反应[4]。Venuti等叫利用CCR5的抗体与其胞外环1结合,结果显示其可以引起T细胞表面CCR5的阴性表达,可能是因为激活了细胞内的信号通路,形成以CCR5为中心的复合体。上述研究说明,CCR5一方面能直接参与炎症细胞的调控,另一方面可能通过激活下游信号分子或蛋白间接对炎症反应进行调节。自噬作为一种在应激状态下能够调节细胞分解代谢的途径,运用CCR5第2胞外环的特异性拮抗短肽能否对其功能造成影响,并调控自噬相关基因的表达,笔者尚未见相关报道。本研究利用Dex干预,并在减轻支气管周围炎症反应的基础上,采用CCR5第2胞外环的特异性拮抗短肽作用于哮喘小鼠,首次探讨该拮抗短肽对自噬相关基因Beclinl、ATG5、LC3表达和自噬泡形成的影响,结果显示,拮抗短肽组的自噬相关基因Beclinl、ATG5和LC3的mRNA表达水平均高于哮喘模型组,透射电镜观察同样显示该2组肺组织中的自噬泡数量多于哮喘模型组,提示该拮抗短肽能调控自噬相关基因的表达。
宋杨达等[12]对炎症性肠病的研究显示,CCR5第2胞外环的特异性拮抗短肽可抑制TNF/NF-κB信号通路,减轻大鼠结肠炎的组织损伤。本课题组前期研究也显示,哮喘小鼠中的拮抗短肽能同样抑制TNF-α的表达。国外对Beclin 1的研究表明,Beclinl可能通过激活NF-κB通路对炎症因子进行调控[13]。另有研究显示,TNF-α作为上游因子,在激活下游的NF-κB通路时,可能通过抑制TSC1-TSC2的活性激活mTOR通路,实现对细胞的自噬功能进行调节[14]。上述研究提示,CCR5第2膜外环的特异性拮抗短肽可能是通过TNF/NF-κB信号通路对支气管哮喘中细胞自噬功能进行调控的。
综上所述,本研究首次探讨CCR5第2胞外环的特异性拮抗短肽对哮喘小鼠自噬相关基因表达与自噬泡形成的影响,证实在哮喘小鼠中存在自噬功能障碍,而拮抗短肽能提高其自噬水平,且这一机制可能与TNF/NF-κB信号通路有关,这为哮喘的精准治疗研究提供了新方向。
参考文献
[1]Berair R,Brightling CE.Asthma therapy and its effect on airwayremodelling.Drugs,2014,74(12):1345-1369.
[2]Zeki AA,Yeganeh B,Kenyon NJ,Post M,Ghavami S.Autophagy in airwa,diseases:a new frontier in human asthma?Allergy,2016,71(1):5-14.
[3]Scurci I,Martins E,Hartley O.CCR5:established paradigmsand new frontiers for a‘celebritychemokine receptor.Cytok-ine,2018,109:81-93.
[4]梁蓉蓉,李雯静,刘娟,沈溪明,黄花荣.CCR5第二胞外环的拮抗短肽对哮喘小鼠炎症细胞浸润和TNF-。表达的影响.中国病理生理杂志,2017,33(4):596-602.
[5]Puleston DJ,Simon AK.Autophagy in the immune system.Imm-unology,2014,141(1):1-8.
[6]Parzych KR,Klionsky DJ.An overview of autophagy:morpho-logy,mechanism,and regulation.Antioxid Redox Signal,2014,20(3):460-473.
[7]Farooq MB,Walsh GM.Autophagy and asthma.Clin ExpAllergy,2016,46(1):7-9.
[8]Go W,Cui R,Ding T,Li X,Peng J,Xu W,Han F,Goo X.Simvastatin alleviates airway inflammation and remodellingthrough up-regulation of autophagy in mouse models of asthma.Respirology,2017,22(3):533-541.
[9]Jiao X,Velasco-Velazquez MA,Wang M,Li Z,Rui H,PeckAR,Korkola JE,Chen X,XU S,DuHadaway JB,Guerrero-Rodriguez S,Addya S,Sicoli D,Mu Z,Zhang G,Zhang X,Cristofanilli M,Fatatis A,Gray JW,Zhong JF,PrendergastGC,Pestell RG.CCR5 governs DNA damage repair and breastcancer stem cell expansion.Cancer Res,2018,78(7):1657-1671.
[10]Ye X,Liu S,HU M,Song Y,Huang H,Zhong Y.CCR5expression in inflammatory bowel disease and its correlationwith inflammatory cells and β-arresting expression.Scand JGastroenterol,2017,52(5):551-557.
[11]Venuti A,Pastori C,Pennisi R,Riva A,Sciortino MT,LopalcoL.Class B β-arresting-dependent CCR5 signalosome retentionwith natural antibodies to CCR5.Sci Rep,2016,6:39382.
[12]宋楊达,刘思雪,宋铱航,沈溪明,黄花荣,钟英强.CCR5第一和第二胞外环特异性拮抗短肽对大鼠结肠炎的炎症细胞浸润及NF-KB/TNF-α信号通路的影响.新医学,2018,49(5):309-314.
[13]Cadwell K.Crosstalk between autophagy and inflammatorysignalling pathways:balancing defence and homeostasis.NatRev Immunol,2016,16(11):661-675.
[14]Pan H,Zhang Y,Luo Z,Li P,Liu L,Wang C,Wang H,Li H,Ma Y.Autophagy mediates avian influenza H5N1 pseudotypedparticle-induced lung inflammation through NF-κB and p38MAPK signaling pathways.Am J Physiol Lung Cell Mol Physiol,2014,306(2):L183-L195.
(收稿日期:2018-12-26)
(本文编辑:林燕薇)
DOI:10.3969/j.issn.0253-9802.2019.05.008
基金项目:广东省自然科学基金(2015A030313027,2016A03031343);广州市科技计划项目(20180301004)
作者单位 510120 广州,中山大学孙逸仙纪念医院儿科广东省恶性肿瘤表观遗传和基因调控重点实验室
通信作者,黄花荣,E-mail:hhrvivi@126.com
