电流-时间曲线法测定鱼露中的苯乙胺
2019-07-05赵晓娟周婵媛陈海光白卫东
赵晓娟,周婵媛,张 敏,陈海光,白卫东
(1.仲恺农业工程学院轻工食品学院,广东 广州 510225;2.广州市广式传统食品加工与安全控制重点实验室,广东 广州 510225)
苯乙胺又称β-苯乙胺,是一种芳香族生物胺,广泛存在于巧克力、牛奶、肉和葡萄酒中[1-2]。在人体内,苯乙胺是一种生物碱与单胺类神经递质,能够提升细胞外液中多巴胺的水平,同时抑制多巴胺神经活化,用于治疗抑郁症。苯乙胺作为重要的医药中间体,主要用于合成兴奋药、抗抑郁药、迷幻剂、神入感激发剂、降食欲剂、支气管扩张药等。但人体若摄入过量的苯乙胺,则可能出现恶心、失眠、头晕和头痛等不良反应。因此,必须控制从食品中摄入的苯乙胺量,建立苯乙胺的快速、简便、灵敏的检测方法具有重要的现实意义。
目前食品中苯乙胺及其他生物胺的检测方法主要有[3]:色谱法[4-12]、毛细管电泳法[13-16]和生物传感器法[17-22]等。其中,色谱法由于具有分离效率高、选择性好、准确可靠等优点而应用最为广泛,但色谱法的样品前处理操作繁琐而耗时,尤其高效液相色谱法在测定生物胺时通常需要进行衍生化反应[4,23],大量化学试剂的使用可能会给环境和人体造成一定的危害。
本研究通过优化电极修饰方法、电化学测试方法和测试条件,建立一种苯乙胺的电化学检测方法,并利用干扰性、重复性和加标回收实验等对检测方法进行评价,旨在建立一种成本低、简便快速测定苯乙胺含量的方法,为鱼露等食品中生物胺的快速检测及质量控制提供依据。
1 材料与方法
1.1 材料与试剂
鱼露 市购;苯乙胺、酪胺、组胺、精胺、亚精胺、腐胺、尸胺、色胺 美国Sigma-Aldrich公司;L-半胱氨酸(L-cysteine,Cys)、氯金酸、壳聚糖 国药集团化学试剂有限公司;氢氧化钠、硼氢化钠 天津福晨化学试剂厂;所用试剂均为分析纯;实验用水均为超纯水(电阻率18.2 MΩ·cm)。
1.2 仪器与设备
CHI660E电化学工作站 北京华科普天仪器有限公司;三电极系统:工作电极为金电极(AuE,Φ=2 mm)或修饰的AuE,参比电极为Ag/AgCl电极(饱和KCl溶液),辅助电极为铂丝电极 上海辰华仪器有限公司;金薄膜微电极(gold thin-film microelectrode,AuME)(由工作(Φ=1 mm)、参比和辅助电极组成) 西班牙Micrux公司;BSA124S电子天平 赛多利斯科学仪器(北京)有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂。
1.3 方法
1.3.1 纳米金(AuNPs)的制备
AuNPs的制备参照文献[24-26]方法。所用的玻璃器皿均用HNO3-HCl(1∶3,V/V)混合酸洗涤干净。称取适量壳聚糖,溶解在1.0%乙酸溶液中,配成2 mg/mL的溶液30 mL,在电磁搅拌下加入15 mL 10 mmol/L的氯金酸溶液,搅拌30 min,然后在搅拌下逐滴加入6 mL新配制的0.1 mol/L硼氢化钠溶液,继续搅拌,直至溶液变为透明的酒红色,并置于4 ℃冰箱中保存备用。
1.3.2 电极处理
1.3.2.1 AuE的处理
将AuE依次用粒径为1.0、0.3 µm和0.05 µm的α-Al2O3粉在专用抛光绒毛垫上抛光,每一步均用超纯水洗净,然后依次在HNO3(1+1)、无水乙醇和水中超声清洗。将预处理后的电极置于0.5 mol/L硫酸溶液中,在-0.3~1.5 V电位区间内,以50 mV/s 的扫描速率进行循环伏安电化学处理,直到获得稳定的循环伏安响应为止。
1.3.2.2 AuME的处理
将3 μL的0.1 mol/L硫酸溶液滴加在AuME表面,-1.5~1.5 V电位区间内,以0.1 V/s的扫描速率循环伏安处理10 圈,用水淋洗后室温晾干备用。
1.3.3 修饰电极的制备
分别利用AuNPs和Cys对AuE进行修饰。将3 μL的AuNPs溶胶滴涂在AuE表面,室温晾干后,即得到纳米金修饰金电极(AuNPs/AuE)。将AuE浸入0.1 mol/L Cys的HCl溶液(0.05 mol/L)中,于4 ℃自组装12 h,取出电极用水淋洗后得到Cys修饰电极(Cys/AuE)。
1.3.4 样品处理
鱼露样品的处理参照GB 5009.208—2016《食品中生物胺的测定》[27]中的萃取方法。取约15 mL鱼露于干净的小烧杯中,用0.22 μm醋酸纤维滤膜过滤于50 mL烧杯中,在所得滤液中加入氯化钠使溶液饱和。量取10.0 mL饱和溶液于50 mL离心管中,用1.0 mol/L NaOH溶液调节pH值至12,再加入5 mL正丁醇-三氯甲烷(1∶1,V/V)混合液,旋涡振荡5 min,于3 600 r/min离心10 min,取上层有机相,且需重复2 次,合并2 次溶液。将混合液置于60 ℃水浴蒸至近干,然后用氮气吹干。最后加入1 mL pH 12.7的NaOH溶液使残留物溶解,所得溶液即待测溶液。
1.3.5 测试方法
基于AuE的测试体系是将三电极系统置于pH 12.7的NaOH空白溶液中,在磁力搅拌器均匀快速搅拌下,用积分脉冲安培(integrated pulsed amperometric detection,IPA)法[28](E2电位0.5 V)和电流-时间(I-t)曲线法(初始电位0.1 V)分别进行扫描,待基线稳定后,用微量注射器注入一定量的苯乙胺溶液,再扫描至稳定,测量出响应的电流差(各浓度苯乙胺溶液的响应电流值与NaOH空白溶液的响应电流值之差)。
基于AuME的测试体系是将NaOH空白溶液和不同浓度的苯乙胺溶液依次滴加在电极表面进行扫描。
2 结果与分析
2.1 IPA法测定条件优化
2.1.1 工作电极的选择
工作电极的形状和尺寸对其测试性能有重要影响。利用IPA法考察不同浓度的苯乙胺溶液在AuE和AuME上的电化学响应。结果发现,用AuE进行测定时操作简单方便,基线稳定,1.66×10-6mol/L苯乙胺具有明显响应,测试灵敏度较高,且响应电流随着苯乙胺浓度的增加而增加。当用AuME进行测定时,1.0×10-6mol/L和1.0×10-5mol/L苯乙胺溶液与NaOH空白溶液的响应曲线几乎重叠,说明AuME对低浓度苯乙胺溶液无响应,虽然1.0×10-3mol/L苯乙胺在AuME上具有明显响应,但基线一直下降,不稳定。因此,选用AuE作为IPA法测定的工作电极。
2.1.2 电极修饰方法的选择
Cys分子能通过巯基定向自组装在AuE的表面,其分子中的氨基和羧基两种活性官能团能增加修饰电极的电催化活性。AuNPs具有大的比表面积和良好的导电性,能增加电极表面的氧化还原反应位点,提高修饰电极的灵敏度,是目前应用最为广泛的一种金属纳米材料。本研究分别采用Cys和AuNPs对AuE进行修饰,比较AuE和制备的Cys/AuE和AuNPs/AuE对不同浓度苯乙胺溶液的测试效果。由图1A可知,3 种电极测定苯乙胺的响应电流差由大到小依次为:AuE、Cys/AuE、AuNPs/AuE。由图1B可知,AuNPs/AuE在NaOH空白溶液中扫描时基线达到稳定所需的时间较长,主要是由于利用IPA法扫描过程中,电位的变化引起电极表面AuNPs的稳定性发生改变;而Cys/AuE与AuE测定苯乙胺的安培响应曲线变化趋势近乎相同,稳定性均良好,说明与AuE相比,利用Cys修饰AuE对苯乙胺的测试效果没有显著影响和改善。因此,选择AuE进行测试。
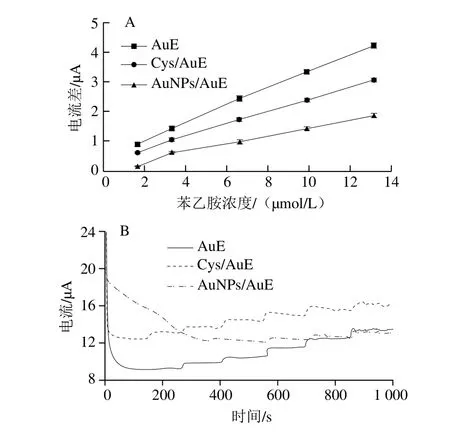
图1 不同电极测定苯乙胺的电流差比较图(A)和IPA图(B)Fig. 1 Comparison of current difference (A) and integrated pulsed amperometric responses (B) of phenethylamine on different electrodes
2.1.3 氧化峰电位和E2电位的确定
将AuE先后置于pH 12.7的NaOH和1.0×10-3mol/L苯乙胺溶液中,用流体力学调制伏安法[29-31]在0~0.9 V进行扫描,通过比较两者的伏安曲线,确定苯乙胺的氧化峰电位在0.3~0.65 V之间。根据氧化峰电位,将IPA法的E2电位分别设置为0.3、0.4、0.45、0.5、0.55、0.6 V和0.65 V,运用IPA法测试8.32×10-7mol/L和1.66×10-6mol/L苯乙胺溶液,比较不同电位参数下AuE对于低浓度苯乙胺的响应情况,确定最优电位。如图2所示,当E2电位为0.3~0.5 V时,测得的电流差值逐渐增大,在0.5 V时苯乙胺的电流响应达到最大值,然后电流差值随着E2电位的增加而减小。因此,最优E2电位确定为0.5 V。

图2 E2电位对苯乙胺电化学响应的影响Fig. 2 Effects of E2 potential on the electrochemical response of phenethylamine
2.1.4 IPA法标准曲线的建立
按照2.1.3节优化的E2电位,使用IPA法考察不同浓度苯乙胺在AuE上电流响应的变化。结果发现,随着苯乙胺浓度的增加,IPA响应曲线呈阶梯式上升。电流差ΔI与苯乙胺溶液浓度c在8.32×10-7~1.40×10-5mol/L范围内呈良好的线性关系,线性回归方程为:ΔI = 0.279 8c+0.389 3(r = 0.997),基于3 倍的信噪比,得到该法测定苯乙胺的检出限为2.8×10-7mol/L。
2.1.5 干扰性实验结果

图3 IPA法测定3 种生物胺的电流差比较图Fig. 3 Comparison of current difference of three kinds of biogenic amines on AuE by IPA
以1.66×10-6、3.32×10-6mol/L和6.62×10-6mol/L苯乙胺溶液为对照,采用IPA法考察相同浓度的酪胺、组胺对苯乙胺测定的干扰情况,结果如图3所示。利用该法测试苯乙胺时,酪胺和组胺均有明显响应,会对苯乙胺的测试结果产生干扰,食品中其他几种常见的生物胺很可能也有干扰。因此,采用IPA法可以对食品中的组胺、酪胺和苯乙胺等生物胺的总量进行测定,但是该法不能对苯乙胺含量进行准确测定。
2.2 I-t曲线法
2.2.1 工作电极的选择
运用I-t曲线法考察不同浓度苯乙胺溶液在AuE和AuME表面的电化学响应。结果发现,用I-t曲线法测定时,苯乙胺在两种电极上的响应灵敏度均明显高于IPA法。此外,与IPA法相似,AuE的响应基线稳定,能够测定8.26×10-8mol/L苯乙胺溶液,测试灵敏度高于AuME,且响应电流差值随着苯乙胺浓度的增加而增加。因此,选用AuE作为I-t曲线法测定的工作电极。
2.2.2 修饰方法的选择
采用AuNPs对AuE进行修饰,比较AuE和AuNPs/AuE对8.26×10-8、2.49×10-7、5.8×10-7、9.08×10-7mol/L和1.23×10-6mol/L苯乙胺溶液的测试效果。结果发现,苯乙胺在AuE和AuNPs/AuE上I-t响应曲线的变化趋势大致相同,稳定性良好,但是响应电流差的大小有明显区别。相同浓度苯乙胺在AuNPs/AuE上的响应电流差明显比AuE的大,随着苯乙胺浓度的增加,电流差增大的幅度越明显,说明AuNPs/AuE对苯乙胺具有良好的测试效果,AuNPs的修饰增加了AuE的响应灵敏度。因此,选择AuNPs作为AuE的修饰材料。
2.2.3 初始电位的优化
I-t曲线法对苯乙胺的响应电位与IPA法不同,因此,首先需要测出苯乙胺溶液的开路电位,然后以开路电位为基础,对I-t曲线法的初始电位进行优化。实验测得1.0×10-6mol/L苯乙胺溶液的开路电位为0.083 V。根据开路电位,将I-t曲线法的初始电位分别设置为0.06、0.08、0.1、0.2 V和0.3 V,考察不同浓度苯乙胺在AuNPs/AuE上的响应情况,结果如图4所示。初始电位的改变对苯乙胺的电流响应值具有显著影响,与其他电位相比,当初始电位为0.1 V时,不同浓度苯乙胺在AuNPs/AuE上的响应电流值均最大。而当初始电位为0.3 V时,苯乙胺在电极表面没有响应,随着苯乙胺浓度的增加,扫描曲线无明显变化。因此,选择0.1 V作为I-t曲线法的最佳初始电位。
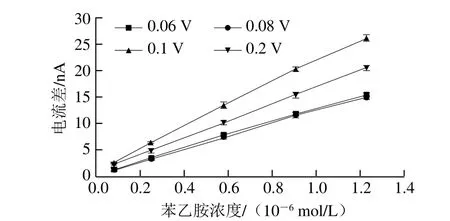
图4 不同初始电位时苯乙胺在AuNPs/AuE上的电流差比较图Fig. 4 Comparison of current difference of phenethylamine at different initial potentials on AuNPs/AuE
2.2.4 I-t曲线法标准曲线的建立
使用I-t曲线法考察不同浓度苯乙胺在AuNPs/AuE上电流响应的变化情况。结果显示,随着苯乙胺溶液浓度的增加,I-t曲线呈阶梯式下降。苯乙胺在电极上的响应电流差-ΔI与浓度c在4.13×10-8~4.72×10-6mol/L范围内呈良好的线性关系,线性回归方程为:-ΔI= 7.783c+1.181(r = 0.997),该法对苯乙胺的检出限为1.4×10-8mol/L(RSN= 3),虽然高于超高效液相色谱-串联质谱法[32]的2.5×10-10mol/L,但明显低于2.1节IPA法和文献[4,15-16,28]报道的检出限水平。该电化学检测方法试剂用量少、灵敏度较高、成本低、简便快速,可以与色谱法形成优势互补,在苯乙胺的快速检测领域发挥其应用价值。
2.2.5 干扰性实验结果
采用I-t曲线法考察不同浓度的酪胺、组胺、精胺、亚精胺、腐胺、尸胺、色胺对测定苯乙胺的干扰情况。结果发现,除色胺外,相同浓度甚至10 倍于苯乙胺浓度的其余6 种生物胺对苯乙胺的测定均无明显干扰。2.5×10-7、5.8×10-7、1.23×10-6mol/L苯乙胺和色胺的电化学响应如图5所示。与苯乙胺相比,相同浓度色胺的响应电流差值明显较小。由于色胺在水产品及其制品中含量相对较少,所以利用该法测定水产品及其制品中的苯乙胺时可不考虑色胺的影响。

图5 I-t曲线法测定苯乙胺和色胺的电流差比较图Fig. 5 Comparison of current difference of phenethylamine and tryptamine on AuNPs/AuE by I-t method
2.2.6 重复性实验结果
用6支AuNPs/AuE对浓度为1.66×10-7、3.32×10-7mol/L的苯乙胺溶液分别进行测定,测得苯乙胺响应电流的相对标准偏差分别为4.7%和4.0%,表明AuNPs/AuE的重复性良好。
2.3 样品分析与回收率的测定结果
将鱼露调味品按照1.3.4节方法进行前处理,然后使用I-t曲线法进行测定。测得该鱼露测试样品液中苯乙胺浓度为1.85×10-7mol/L,经换算得出该鱼露样品中苯乙胺浓度为1.11×10-5mol/L。为验证此方法的准确性,对鱼露样品进行加标回收实验。鱼露样品中不同浓度(1.66×10-7、3.31×10-7mol/L)苯乙胺的加标回收率为90.0%~110.8%,其相对标准偏差分别为4.8%和6.2%。
3 结 论
本实验采用IPA法和I-t曲线法测定苯乙胺,对工作电极、电极修饰方法、测定电位分别进行选择和优化,并比较两种方法的测定效果。结果表明:利用AuE和IPA法可以对食品中的组胺、酪胺和苯乙胺等生物胺的总量进行测定,但是该法不能对苯乙胺含量进行准确测定;采用胶体金修饰的AuE,在初始电位为0.1 V时,运用I-t曲线法测定苯乙胺具有良好的选择性和较高的灵敏度,检出限为1.4×10-8mol/L,测定鱼露样品中苯乙胺的加标回收率在90.0%~110.8%之间,该法适用于鱼露样品中苯乙胺的测定。
