犬上颈椎融合后C2-3 椎间盘内Ⅰ型胶原蛋白的变化*
2019-07-04董军杨晓刁攀梁宝宝蔡璇王旭斌贺西京
董军 杨晓 刁攀 梁宝宝 蔡璇 王旭斌 贺西京*
上颈椎融合术是治疗寰枢关节不稳的一种重要的手术方法[1]。按手术入路的不同可分为经口咽入路融合术和经后路融合术两种。由于椎体融合使得原有椎体节段运动功能丧失,融合术被认为是加速邻近节段退变的重要因素之一。颈椎邻近节段退变是指出现的邻近于融合节段的颈椎疾病,通常表现为颈部疼痛、上肢或手部感觉过敏或减退、椎间隙变窄、骨赘形成等一系列临床症状或影像学变化[2-3]。邻近节段退变的确切病因目前尚缺乏统一认识,对于该疾病的研究多集中在生物力学上。目前发现,融合后的颈椎的运动功能在融合节段上消失但重新分布于邻近的椎间隙内。在邻近节段退变的诸多变化中,椎间隙变窄为该疾病较早的改变,其实质为椎间盘的退变,其内的一系列胶原蛋白的含量和分布随之发生变化。椎间盘内的胶原纤维通过胶原蛋白肽链形成具有特定的三维空间结构,进而使得椎间盘具有高度的抗张强度和韧性。椎间盘退变时具有显著变化特征的为Ⅰ型胶原蛋白的变化。纤维环具有多层、有序排列的同轴心薄层结构,其内Ⅰ型胶原蛋白有序分布[4],Ⅰ型胶原蛋白主要分布于纤维环的外层,且其含量由外向内逐渐递减[5]。随着年龄的增长、椎间盘退变的进行,Ⅰ型胶原蛋白在纤维环内的表达逐渐增加,髓核内也出现Ⅰ型胶原蛋白[6-7]。这种胶原含量及分布的改变使得椎间盘内的空间结构发生改变,导致其承受能力降低,在临床上表现出纤维环破裂、髓核脱出。
寰枢关节为颈椎中旋转功能最大的解剖结构,其旋转功能约占整个颈椎的50%[8]。寰枢关节融合后,其原有的旋转功能将由下颈椎代偿。为了解上述生物力学的改变能否加速邻近节段退变,笔者试图通过直接观察颈椎间盘内Ⅰ型胶原蛋白的分布变化来了解对邻近节段退变所造成的影响。鉴于犬的寰枢关节和人的寰枢关节在解剖结构上极为相似且同样具备灵活的旋转功能,为进一步了解上颈椎融合术对邻近节段的影响,本实验通过建立犬的上颈椎融合模型观察C2-3椎间盘内Ⅰ型胶原蛋白的变化,初步了解上颈椎融合术对邻近椎间盘的影响。
1 材料与方法
本实验是在严格遵守本院医学伦理委员会要求的条件下完成的。
1.1 主要仪器
寰枢融合钢板6 具,本实验中所用寰枢关节融合钢板为本课题组自行设计的一款专用于犬的“工”字型钛合金假体(西北有色金属研究院加工)(见图1A)。该假体厚度为2 mm,在实验中根据具体犬的寰齿关节形态预折弯为与之相适应的形状。含4 个直径在3.5 mm 左右的螺钉孔(见图1B)。
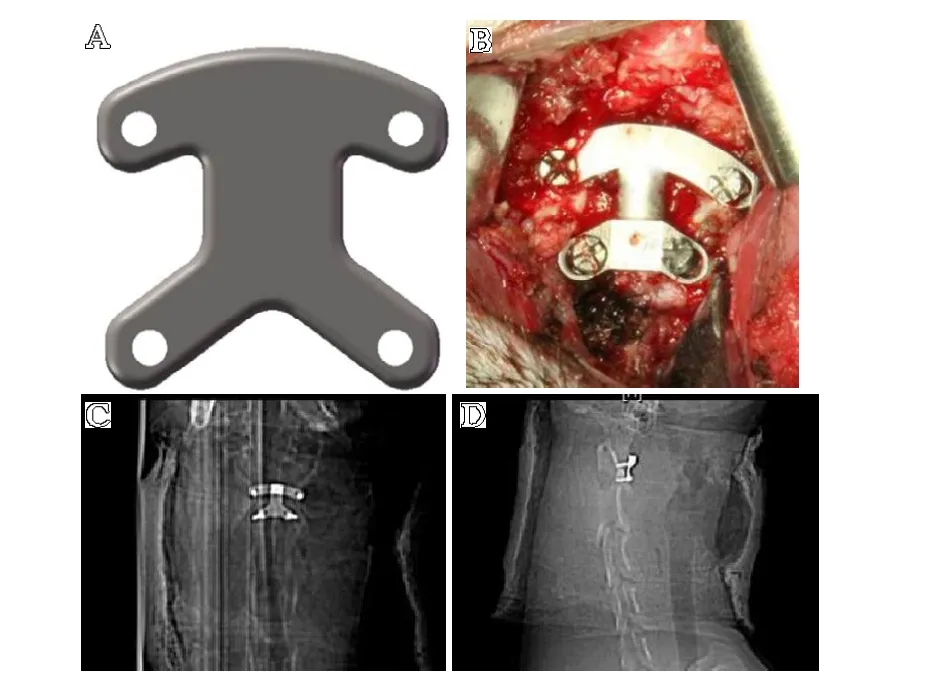
图1 上颈椎融合钛板、术中照片和术后即刻X 线:A.上颈椎融合板;B.术中安放于C1-2 的融合钛板;C.术后即刻正位X 线;D.术后即刻侧位X 线
1.2 手术方法
1.2.1 动物分组
成年健康雄性家犬12 只(由西安交通大学第二附属医院外科动物中心提供),平均体重:(23.0±0.5)kg。均禁食24 h、禁饮12 h 以排空胃肠道,并经后肢体表静脉建立静脉通道。每只犬予以3%戊巴比妥钠30 mg/kg,经静脉通道注射麻醉,待犬出现呼吸浅慢、角膜反射迟钝、舌外伸时,为麻醉适宜表现。若出现呼吸抑制,立即给予肾上腺素2 mL、尼可刹米0.375 mg 静脉推注,辅助挤压胸廓辅助呼吸抢救。全麻生效后,行X 线检查排除实验以检查患寰枢关节有无异常。明确无异常后将12 只犬随机分为实验组和对照组,每组各6 只。
1.2.2 模型建立
手术过程:将上述全麻生效的实验组犬肌注青霉素钠(320 U/只),并行颈前区备皮。备负压吸引器2 台,分别用于术区清洁和术中呼吸道分泌物的清除。取犬仰卧位,并将犬颈部向前反曲,充分暴露咽以下颈部,稀释碘伏反复消毒咽部后铺置无菌巾单。以正中手术切口,逐层切开咽后壁,充分显露寰椎前结节、前弓、侧块和枢椎椎体。根据上述解剖形态,将“工”形融合板用折弯器预折呈所需形态。用直径为3.0 mm 钻头分别在寰椎侧块和枢椎关节突下钻孔,并用测深测量孔的深度,选取适宜长度螺钉,依次拧入4 枚螺钉(见图1B)。待彻底止血后,逐层缝合肌层、黏膜层、皮肤切口。为防止颈部水肿造成器官压迫,术后不予环形石膏固定而以前后条形石膏托固定。对照组不进行手术处理。
术后护理:术后犬能自行站立并走动认为麻醉完全苏醒,可辅以饮水及流质食物。各组犬分笼饲养,每笼1 只,术后肌注青霉素(80 万单位)3 d,预防感染;并注意保暖,每天更换1 次敷料。控制室温在18 ~20℃;实验动物能够在笼内自由活动。
影像学观察:术后立即拍摄颈椎正、侧位X 线片。观察人工关节假体有无松动、脱钉、断裂。
材料获取与保存:于术后3 个月,通过注射大剂量戊巴比妥钠处死实验组和对照组犬。解剖颈椎获取C2-3椎间盘并立即放入4%多聚甲醛溶液(10%福尔马林)中固定至24 h,然后用于免疫荧光染色的部分转移至20%蔗糖溶液中脱水过夜,用滤纸吸干多余水分置入冻存管放入液氮罐中保存备冰冻切片使用。其余椎间盘用于HE 染色固定。
1.2.3 HE 染色
将上述保存在4%多聚甲醛里的组织块进行固定至72 h后,以浓度20%~90%乙醇作脱水剂,由低到高逐渐脱去上述组织块中的水分。置于二甲苯中透明,并以石蜡包埋,切成厚度为5 ~8 m 厚的薄皮。将切片放入伊红-苏木精染色液(HE)中染色2 ~3 min,在共聚焦显微镜下摄片。依据椎间盘退变组织学评分表(见表1)[9],将上述HE 染色的椎间盘进行评分。

表1 椎间盘退变组织学评分系统
1.2.4 免疫荧光染色
将保存在液氮罐内的C2-3椎间盘取出,置于室温下恢复温度,包埋于固定架上,用锋利刀片在-10℃下进行均匀切片,厚度为8 m;在室温下将原放置于湿盒内的冰冻切片吹干;用PBS 缓冲液在室温下振洗2 次,每次5 min;将上述切片用0.1%胰蛋白酶在37℃恒温箱下孵育10 min,进行抗原修复;在室温下,再用PBS 缓冲液振荡清洗2 次,每次5 min;滴加一抗(Collagen-Ⅰ-antibody,ABCAM 公司,编号:ab23446)(稀释度1∶200),切片过夜孵育后于室温下,用PBS 缓冲液清洗2 次,每次5 min;滴加二抗(FITC标记的山羊抗小鼠IgG 抗体,南京凯基生物科技有限公司,编号:KGAA)(稀释度1∶50)。孵育封片后置于荧光显微镜下观察。将在同一曝光时间(75 ms),发射波长为495 nm条件下进行摄片,得到免疫荧光图像,随机选取并记录5 个视野。利用Image-Pro Plus 6.0 软件将图像转换为灰度图像,并进行光密度测量,获得每个椎间盘的平均光密度值。
1.3 统计学方法
采用SPSS 19.0 软件进行统计学处理。将光密度结果以均值±标准差表示,并进行双侧独立样本 检验。对组织学评分采用Mann-Whitney U 秩和检验。<0.05 表示差异有统计学意义。
2 结果
实验组术后均能正常饮食,未见伤口感染,术后肢体功能未见明显异常。术后3 个月两组犬均行大剂量戊巴比妥钠静脉注射安乐死。
2.1 X 线检查
术后X 线检查提示假体固定于C1和C2椎体,4 枚螺钉分别置于寰椎侧块或枢椎关节突下方。未见钢板断裂、螺钉脱出等(见图1C、图1D)。
2.2 C2-3 椎间盘HE 染色
HE 染色发现实验组犬C2-3椎间盘纤维环结构紊乱,胶原纤维束间裂隙增大,髓核减少。对照组犬C2-3椎间盘纤维环结构呈有序环状分布,排列整齐、规则、纵横交错、大小及方向一致,无团块样结构出现。实验组椎间盘组织学评分平均为1.5 分,对照组椎间组织学评分平均为0.5 分(=3.105,<0.05)(见图2)。
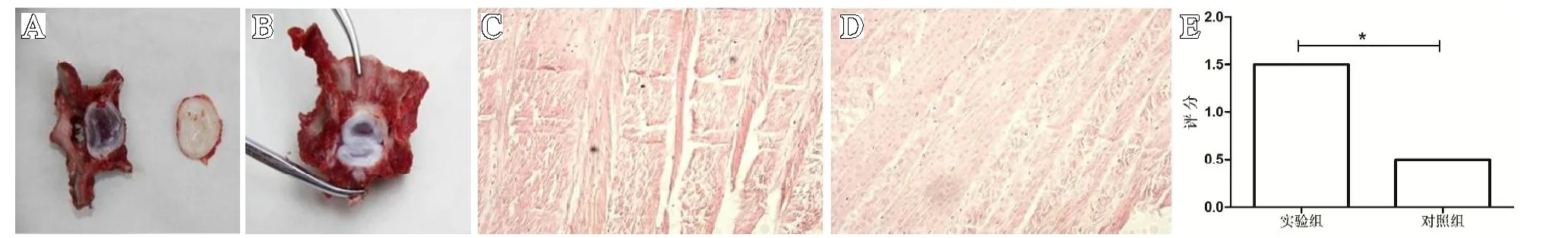
图2 犬C2-3 椎间盘外观照片及HE 染色图片:A.实验组椎间盘外观照片;B.对照组椎间盘外观照片;C.实验组C2-3 椎间盘HE 染色(×100);D.实验组C2-3 椎间盘HE 染色(×100);E.实验组和对照组椎间盘评分,*表示<0.05
2.3 C2-3 椎间盘免疫荧光染色
免疫荧光染色图发现正常组犬C2-3椎间盘内胶原纤维排列整齐,胶原走行清楚,胶原纤维环与髓核之间的过渡区较宽,纤维环呈同心圆排列规则整齐,实验组犬C2-3椎间盘纤维环中增生的胶原纤维排列紊乱,纤维环排列不规整,肿胀明显并呈结节样团状结构,出现裂隙及断裂(见图3A、图3B)。经分析发现实验组犬C2-3椎间盘Ⅰ型胶原蛋白较对照组增加(见表2),实验组C2-3椎间盘光密度为(391 052.98±18 869.81),对照组C2-3椎间盘光密度为(312 945.42±22 400.47),经双侧检验发现,两组光密度值差异有统计学意义(=6.532,<0.001)(见图3C)。
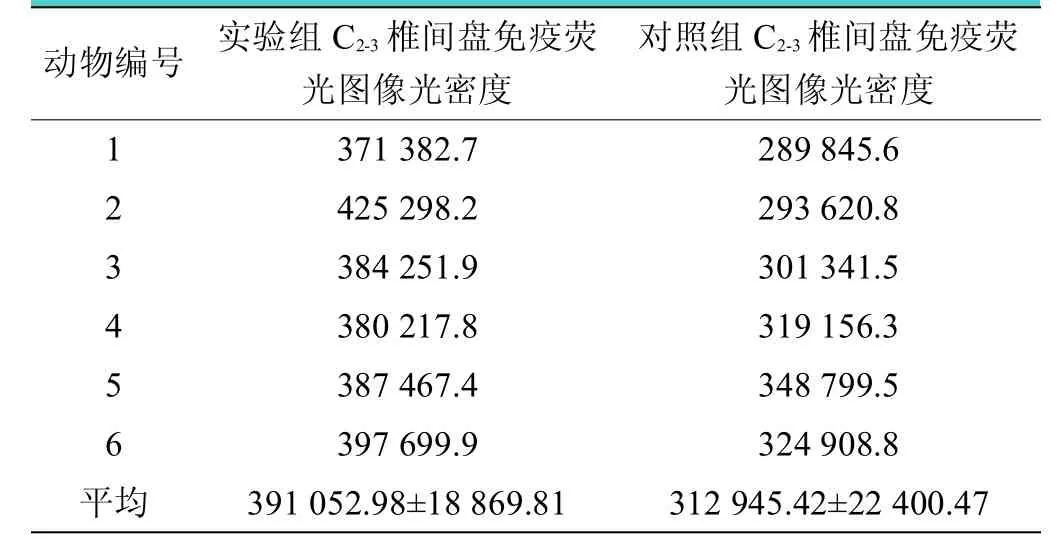
表2 实验组、对照组犬C2-3 椎间盘免疫荧光图像光密度

图3 免疫荧光染色图片:A.实验组C2-3 椎间盘内Ⅰ型胶原蛋白(白色箭头)(×200);B.对照组C2-3 椎间盘内Ⅰ型胶原蛋白(白色箭头)(×200);C.实验组和对照组C2-3 椎间盘光密度值,**表示<0.001
3 讨论
上颈椎融合术是治疗上颈椎骨折、不稳等的主要术式[1]。随着该术式在临床的应用,其安全性和有效性已经得到广泛证实,但在融合后C1-2旋转功能大大丧失是该术式不可避免的问题之一。近年来,融合后邻近节段退变这一问题受到越来越多的关注。目前对于该疾病的病因尚缺乏统一认识,对于邻近节段退变的研究多集中在生物力学研究上。研究发现,融合后颈椎的运动功能在融合节段上消失但重新分布于邻近的椎间隙内[10]。上述变化的直接结果使得邻近节段的运动范围较原有的增大且伴随着邻近椎间盘和关节突关节内的压力增加。
椎间盘是高度特异性的软骨性组织[11],由骨性终板、软骨终板、外层纤维环和内层髓核组成。它是脊柱吸收震荡、减缓冲击,为脊柱提供稳定性并保持脊柱一定活动范围的重要结构。纤维环的大体形态呈同心圆状排列,纤维环所含的胶原蛋白在每一层均有序排列。作为椎间盘的主要组成部分,胶原蛋白占纤维环干重的50%~70%,占髓核干重的15%~20%[12-13]。纤维环是非均一的韧性组织,主要由Ⅰ型胶原蛋白和蛋白聚糖组成;髓核是均一的凝胶状组织,主要由蛋白聚糖和Ⅱ型胶原蛋白组成[14]。
Nerlich 等[15]证实椎间盘内存在Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅸ、Ⅺ型胶原蛋白。其中I 型胶原蛋白形态粗大,集中分布于纤维环的周边,具有较强的抗拉伸性能,为抵抗邻近椎体过度运动提供良好的支持作用。上述多种胶原蛋白互相交联形成具有特定三维结构的胶原交联,该结构是维持椎间盘生物力学性能和结构框架的重要因素之一,尤其是胶原交联的种类和程度决定了胶原的机械性能[15]。胶原含量和种类的差异进一步导致蛋白多糖、水等细胞外基质合成与降解失衡,最终使得椎间盘不同区域承受负荷和应力的能力不同,进而使得椎间盘损伤的机会增加,表现为纤维环破裂、髓核突出等。但究其本质而言,椎间盘的退变过程即为其内原有正常胶原纤维空间结构改变的过程。吕振华、西永明等[6-7]通过核酸分子原位杂交技术观察Ⅰ型胶原蛋白在人椎间盘的表达规律,认为伴随年龄的增长、椎间盘退变的进行,Ⅰ型胶原蛋白在纤维环内的表达逐渐增加。本研究发现,实验组椎间盘内Ⅰ型胶原表达显著高于对照组,提示寰枢椎融合术能加速邻近C2-3椎间盘的退变。
理论上,对于脊柱融合术邻近节段的退变在组织学水平上的出现要较影像学上更早。而文献上报道组织学邻融合节段的C2-3椎间盘出现显著性差异至少在半年以上,本研究中实验组犬C2-3椎间盘在术后3 个月后Ⅰ型胶原蛋白的显著增加,提示上颈椎融合术更早加速C2-3椎间盘的退变。
本实验有如下局限性,仅建立了动物模型而未进一步观察接受上颈椎融合术后患者邻近椎间盘的核磁共振信号变化,以便更好了解C2-3椎间盘在人体内的动态变化过程。仅对一种胶原蛋白即Ⅰ型胶原蛋白进行了间接定性观察,缺乏深入的定量研究。
