腹腔镜与开腹胃癌根治术对进展期胃癌患者机体应激反应和细胞免疫功能的影响
2019-07-03徐英杰毛奇斌余居殿
钱 晨 杨 丰 徐英杰 何 俊 毛奇斌 余居殿 郑 植
近年来,随着人们饮食结构的变化、胃部幽门螺杆菌感染等,中国胃癌的发生呈年轻化趋势。由于胃癌的早期症状不明显,上腹不适、嗳气等症状与胃溃疡、胃炎等胃部慢性疾病的症状相似,易被患者忽略,一旦发现已处于胃癌进展期[1-3];此时,以手术为主的综合治疗成为其主要治疗手段[4]。传统开腹胃癌根治术的创伤较大,不利于患者的术后康复[5]。腹腔镜胃癌根治术因具有手术切口小、术中出血少、术后恢复快等优点,逐渐被用于进展期胃癌的治疗[6]。开腹胃癌根治术与腹腔镜胃癌根治术均可使患者机体产生应激反应,围术期应激反应可加重患者术后免疫功能抑制。目前,腹腔镜应用于进展期胃癌患者的临床疗效及其安全性尚存在争议。本研究通过比较两种手术方式对进展期胃癌患者机体应激反应和细胞免疫功能的影响,以期为此类患者选择合适的手术方式提供依据。
1 对象与方法
1.1 研究对象 选取上海东方肝胆外科医院于2014年1月—2018年4月间收治的497例进展期胃癌患者,男260例、女237例;年龄35~80岁,平均年龄为(43.0±4.5)岁;肿瘤直径2~7 cm,平均肿瘤直径为(4.0±1.2) cm;肿瘤位于胃底和贲门168例,胃体159例,胃窦170例;肿瘤临床分期为Ⅱ期212例,Ⅲ期285例;行近端胃切除术 181例,远端胃切除术179例,全胃切除术137例。根据手术方式将患者分入开腹胃癌根治组(开腹组,248例)和腹腔镜辅助胃癌根治组(腹腔镜组,249例)。纳入标准:①均经电子胃镜和病理学检查确诊为胃癌;②CT或MRI检查提示肿瘤已侵犯周围组织;③均为初诊患者,未行放射治疗、化学治疗和免疫治疗;④具有手术指征[7]。排除标准:①既往有腹部手术史;②合并心、肝、肾等脏器功能障碍;③术中见肿瘤扩散或远处转移;④肿瘤直径>6 cm。本研究经医院伦理委员会批准,患者及其家属均签署知情同意书。
1.2 手术方法 两组患者术前均常规禁食、禁水,全身麻醉后行气管插管。开腹组行开腹胃癌根治术:患者取平卧位,于上腹部正中作一长度为20~30 cm的绕脐切口;入腹后经探查确定肿瘤位置和浆膜侵犯程度,行淋巴结清扫,随后应用超声刀离断胃周血管,切除网膜,将胃拖出腹腔,切除肿瘤,完成消化道重建,常规置入引流管。腹腔镜组行腹腔镜辅助胃癌根治术:患者取平卧位,建立二氧化碳气腹,压力维持于15 mmHg (1 mmHg=0.133 kPa);采用常规5孔法,于脐下缘穿刺取观察孔,左侧腋前线肋缘下12 mm穿刺取主操作孔,左、右锁骨中线肋缘下和右侧腋前线肋缘下穿刺取辅助操作孔;手术范围、淋巴结清扫和手术顺序与开腹组一致。所有手术均由同一组医师完成。
1.3 应激反应和细胞免疫功能指标检测 分别于术前和术后第1、7天清晨抽取患者空腹静脉血4 mL,置入A、B两管。A管经720×g离心10 min,取上清液置于-30 ℃冰箱中待测;采用ELISA法(试剂盒购自上海酶联生物科技有限公司)检测血清丙二醛(MDA)、超氧化物歧化酶(SOD)、IL-6、CRP水平。B管应用FACSCAlibur型流式细胞仪(美国BD公司)检测CD4+、CD8+,计算CD4+/CD8+。
1.4 观察指标 记录并比较两组围术期各项指标,包括手术切口长度、淋巴结清扫数目、术后住院时间、手术时间、术后排气时间。观察并比较两组术后并发症(切口感染、胸腔积液、肠梗阻、腹腔感染、胃排空紊乱、肺部感染)情况,采用Clavien-Dindo并发症分级系统将并发症严重程度分为Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ级[8]。
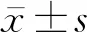
2 结 果
2.1 两组一般资料比较 两组间患者的性别、肿瘤部位、肿瘤临床分期和手术类型构成,以及年龄和肿瘤直径的差异均无统计学意义(P值均>0.05),见表1。
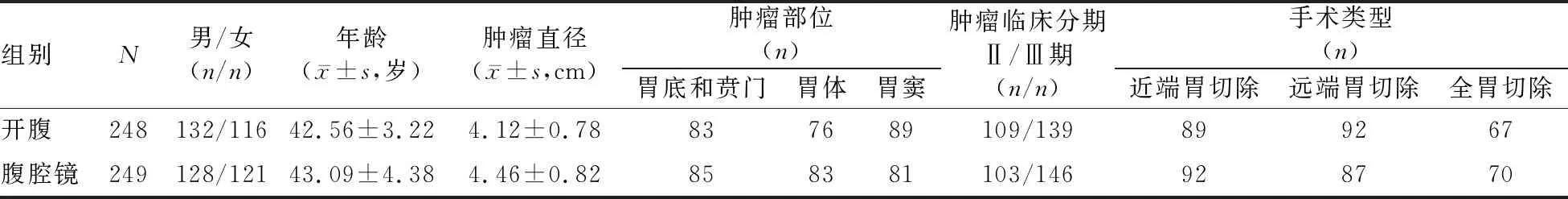
表1 两组一般资料比较
2.2 两组围术期指标比较 腹腔镜组的手术切口长度、术后住院时间和术后排气时间均显著短于开腹组(P值均<0.05),手术时间显著长于开腹组(P<0.05)。两组间淋巴结清扫数目的差异无统计学意义(P>0.05)。见表2。
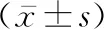

组别N手术切口长度(cm)手术时间(min)淋巴结清扫数目(n)术后住院时间(d)术后排气时间(d)开腹24824.01±3.17136.97±17.5113.84±2.7614.92±1.414.86±1.17腹腔镜24910.06±2.01①163.16±14.82①13.53±2.9511.82±1.32①3.25±1.08①
与开腹组比较:①P<0.05
2.3 两组应激反应指标比较 两组间术前MDA、SOD、IL-6和CRP水平的差异均无统计学意义(P值均>0.05)。两组术后第1、7 天的MDA、IL-6、CRP水平均显著高于同组术前(P值均<0.05),SOD水平均显著低于同组术前(P值均<0.05);术后第7天的MDA、IL-6、CRP水平均显著低于同组术后第1天(P值均<0.05),SOD水平显著高于同组术后第1天(P值均<0.05)。腹腔镜组术后第1、7天的MDA水平均显著高于开腹组同时间(P值均<0.05),SOD、IL-6和CRP水平均显著低于开腹组同时间(P值均<0.05)。见表3。
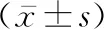
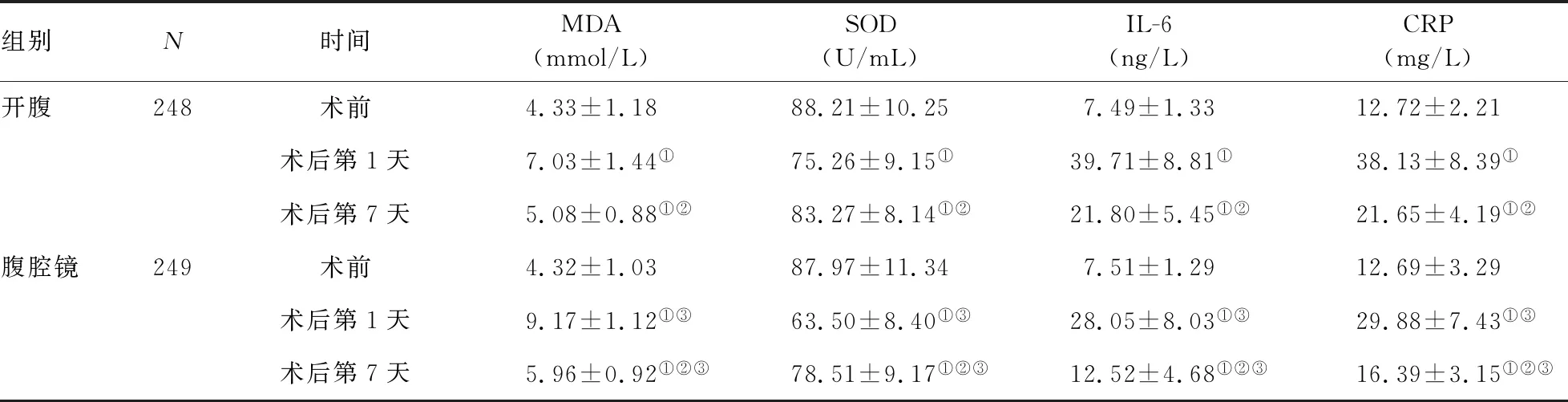
组别N时间MDA(mmol/L)SOD(U/mL)IL-6(ng/L)CRP(mg/L)开腹248术前4.33±1.1888.21±10.257.49±1.3312.72±2.21术后第1天7.03±1.44①75.26±9.15①39.71±8.81①38.13±8.39①术后第7天5.08±0.88①②83.27±8.14①②21.80±5.45①②21.65±4.19①②腹腔镜249术前4.32±1.0387.97±11.347.51±1.2912.69±3.29术后第1天9.17±1.12①③63.50±8.40①③28.05±8.03①③29.88±7.43①③术后第7天5.96±0.92①②③78.51±9.17①②③12.52±4.68①②③16.39±3.15①②③
与同组术前比较:①P<0.05;与同组术后第1天比较:②P<0.05;与开腹组同时间比较:③P<0.05
2.4 两组细胞免疫功能指标比较 两组间术前CD4+、CD8+、CD4+/CD8+的差异均无统计学意义(P值均>0.05)。两组术后第1、7天的CD4+、CD8+、CD4+/CD8+均显著低于同组术前(P值均<0.05),腹腔镜组术后第7天的CD4+、CD8+均显著高于同组术后第1天(P值均<0.05)。腹腔镜组术后第1、7天的CD4+、CD8+、CD4+/CD8+均显著高于开腹组同时间(P值均<0.05)。见表4。
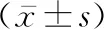
组别N时间CD4+(%)CD8+(%)CD4+/CD8+开腹248术前42.23±3.7828.54±2.851.48±0.29术后第1天23.71±4.75①17.56±2.84①1.35±0.32①术后第7天23.93±4.93①18.04±2.75①1.33±0.21①腹腔镜249术前41.67±3.6729.01±2.911.44±0.19术后第1天28.63±5.78①③20.35±2.65①③1.41±0.14①③术后第7天35.54±5.13①②③25.78±2.52①②③1.38±0.24①③
与同组术前比较:①P<0.05;与同组术后第1天比较:②P<0.05;与开腹组同时间比较:③P<0.05
2.5 两组术后并发症发生情况比较 腹腔镜组术后并发症发生率为12.05%(30/249),显著低于开腹组的18.55%(46/248,P<0.05),见表5。开腹组Clavien-Dindo并发症分级Ⅰ级13例(5.24%)、Ⅱ级10例(4.03%)、Ⅲa级8例(3.23%)、Ⅲb级10例(4.03%)、Ⅳ级4例(1.61%)、Ⅴ级1例(0.40%),腹腔镜组Ⅰ级12例(4.82%)、Ⅱ级9例(3.61%)、Ⅲa级5例(2.01%)、Ⅲb级3例(1.20%)、Ⅳ级1例(0.40%)、Ⅴ级0例。

表5 两组术后并发症发生情况 [n(%)]
3 讨 论
胃癌作为临床上常见的恶性肿瘤,起病隐匿,易转移、复发,预后极差[9-10]。胃癌根治术是治疗胃癌的主要方法,传统的开腹手术创伤大,术后恢复慢,对于免疫力低下的患者手术风险较大[11-12]。随着微创外科领域的发展,早期胃癌患者行腹腔镜辅助胃癌根治术的疗效已逐渐被认可[13-14],但腹腔镜辅助胃癌根治术能否取代传统开腹胃癌根治术治疗进展期胃癌尚需大样本研究进行验证。腹腔镜辅助胃癌根治术的操作技术难度较大,主要为能否充分切除肿瘤原发灶和受侵犯的周围组织,确保足够的切缘,以及能否彻底清扫淋巴结[15-16]。此外,由手术创伤引起的术后应激反应和消化道重建后的影响,可进一步增加患者的营养损耗,导致患者术后发生细胞免疫功能抑制,可能为肿瘤扩散提供机会,故围术期应尽可能减少患者应激反应、细胞免疫功能抑制的发生[17-18]。
淋巴结转移是胃癌转移的重要途径之一,彻底清扫淋巴结是保证胃癌患者手术成功的关键[19-20]。本研究结果显示,两组间患者淋巴结清扫数目的差异无统计学意义,表明腹腔镜辅助胃癌根治术中淋巴结清除效果与开腹手术相似。本研究结果显示,腹腔镜组的手术切口长度、术后住院时间和术后排气时间均显著短于开腹组,其原因为腹腔镜手术切口小,视野清晰,可彻底显露病灶,使手术过程顺利进行,且患者术后恢复快,从而缩短了住院时间[21-22];而腹腔镜组手术时间显著长于开腹组,与马沛[23]的研究结果不同,可能是由于术者对腹腔镜技术的掌握程度不一致,且研究样本量存在差异所致。
本研究结果显示,两组术后第1、7天的MDA、IL-6、CRP水平均显著高于同组术前,SOD水平均显著低于同组术前;术后第7天的MDA、IL-6、CRP水平均显著低于同组术后第1天,SOD水平显著高于同组术后第1天;表明两组术后机体均产生炎性反应和氧化应激反应。腹腔镜组术后第1、7天的MDA水平均显著高于开腹组同时间,SOD、IL-6和CRP水平均显著低于开腹组同时间。结果表明,与开腹胃癌根治术相比,腹腔镜辅助胃癌根治术可有效改善患者的炎性应激反应,但其改善患者氧化应激反应的效果并不明显。分析其原因:IL-6属于常见的促炎细胞因子,CRP是一种急性时相反应蛋白,其水平主要反映机体创伤程度,而腹腔镜辅助胃癌根治术可有效减少患者机体损伤,故其改善炎性应激反应的效果优于开腹胃癌根治术[24-25];氧化应激反应指标MDA改善不明显,这可能是由于腹腔镜下操作对术者的要求更高,导致手术时间延长,使机体长时间处于创伤应激状态;此外,腹腔镜需在气腹状态下操作,二氧化碳被吸收入血,导致机体处于细胞缺氧状态,低氧引起机体内环境呼吸链紊乱,使机体氧化-还原反应失衡,从而加重机体氧化应激反应[26-28]。上述结果均表明,腹腔镜辅助胃癌根治术可在一定程度上减轻术后应激反应,减少应激反应因子对器官的损害,降低术后并发症发生率,从而促进患者术后恢复。
在细胞免疫功能方面,刘险峰等[29]认为,胃癌手术患者术后可发生细胞免疫功能抑制或下降,对术后感染和肿瘤细胞迁移种植的控制极为不利。Luo等[30]的研究结果表明,细胞免疫功能对于阻止术后肿瘤的转移和播散,以及减少感染等并发症的发生具有重要意义。本研究结果显示,两组术后第1、7天的CD4+、CD8+、CD4+/CD8+均显著低于同组术前,表明两组患者术后细胞免疫功能均被抑制;腹腔镜组术后第1、7天的CD4+、CD8+、CD4+/CD8+均显著高于开腹组同时间,表明腹腔镜辅助胃癌根治术可显著改善细胞免疫抑制效果。本研究结果与易守勤等[31]的研究结果基本一致。分析其原因可能与腹腔镜手术创伤较小、患者的应激反应较轻、机体免疫力得以迅速恢复有关[32-33]。
本研究结果显示,腹腔镜组术后并发症发生率显著低于开腹组,其原因为腹腔镜辅助胃癌根治术对患者细胞免疫功能稳定性的影响小,细胞免疫功能可对机体起到保护作用,从而有效减少术后并发症的发生[34-35]。
综上所述,腹腔镜辅助胃癌根治术可有效改善围术期指标,减少机体应激反应,促进细胞免疫功能,减少术后并发症的发生,加速患者术后恢复。
