中国脓毒症/脓毒性休克急诊治疗指南(2018)
2019-07-01中国医师协会急诊医师分会中国研究型医院学会休克与脓毒症专业委员会
中国医师协会急诊医师分会,中国研究型医院学会休克与脓毒症专业委员会
脓毒症和脓毒性休克是急危重症医学面临的重要临床问题,全球每年脓毒症患者数超过1900万,其中有600万患者死亡,病死率超过1/4,存活的患者中约有300 万人存在认知功能障碍[1-3]。早期识别与恰当处理可改善脓毒症患者的预后。近年来,国内外对脓毒症领域的研究不断深入,临床实践及证据不断增加,2016年美国重症医学会(SCCM)与欧洲重症医学会(ESICM)联合发布脓毒症3.0定义及诊断标准,新定义的出现及临床证据的积累都会对临床决策产生重要影响。为了更好地指导我国急诊与危重症医学工作者对脓毒症和脓毒性休克的治疗,中国医师协会急诊医师分会和中国研究型医院学会休克与脓毒症专业委员会组织专家,基于循证医学的方法制定了《中国脓毒症/脓毒性休克急诊治疗指南(2018年)》(以下简称为“本指南”)。
检索策略
本指南针对相关重要临床问题进行文献检索,检索时间为1993年1月到2018年6月。文献检索首先确定包括脓毒症(sepsis)、严重脓毒症(severe sepsis)、脓毒性休克(septic shock)、脓毒性综合征(sepsis syndrome)、危重病(critical illness)及特定问题的关键词,在MEDLINE、EMBASE和Cochrane Library(Cochrane系统评价数据库,CDSR)、万方数据库、中国知网、维普等综合数据库中进行检索。针对中药治疗脓毒症/脓毒性休克也进行文献检索。检索时间截至2018年6月15日。根据临床使用情况,检索临床可用于脓毒症/脓毒性休克的中药13 种,共检索到相关词条37 875 条,剔除基础研究、综述、药学、不良反应、与脓毒症不相关等内容,共检索到895篇临床疗效相关文献。其中参附注射液186篇,血必净注射液472篇,参麦注射液、生脉注射液、醒脑静注射液、丹参注射液、参芪扶正注射液、黄芪注射液、痰热清注射液、安宫牛黄丸、清开灵注射液、热毒宁注射液、喜炎平注射液等其他中药共237篇。文献质量要求为Jadad 评分≥3 分,Jadad评分标准见表1。
推荐等级
按照推荐等级的评估、制定与评价系统(GRADE)的原则,指导证据质量评估[从高(A级)到极低(D级)],确定推荐等级(见表2、3)[4]。
GRADE系统的建立首先需对证据质量进行连续评估,然后评估疗效与风险之间的平衡、负担及费用,根据这些评估情况确定治疗推荐等级。证据质量和推荐强度的明确分级是 GRADE 系统评价方法的关键及典型特点。将证据质量分为高(A级)、中(B级)、低(C级)、极低(D级)。随机试验最初为高证据质量,但可能因试验实施过程的限制、结果的不一致或不精确、证据为间接证据以及可能的报告偏倚而造成证据质量下降(见表2)。间接证据包括研究人群、干预措施、结果的评定以及这些因素与相关问题之间的关联情况。
GRADE方法通过以下6项对证据进行评估:①偏倚风险;②不一致性;③间接性;④不精确性;⑤发表偏倚;⑥其他标准:随后评估疗效与风险之间的平衡、患者价值观与偏好、费用与来源、干预措施的可行性和可接受性等因素。GRADE 系统证据质量评估方法见表2。

表1 Jadad评分标准

表2 证据质量的确定
RCT最开始作为高质量证据,但如果存在上面提到任何一种局限性都会造成降级。而观察性(非随机)研究最开始作为低证据质量,但如果基于效应量足够大或其他因素,质量级别可能提升。GRADE系统将推荐强度分为强和弱,决定推荐强度的影响因素(见表3)。将推荐等级分为强或弱的临床意义比证据质量分级更大。我们评估推荐项目的有利效果是否优于其不良效果,推荐强度反映该评估可信度及专家的意见。强推荐的有利效果将显著优于不良效果。弱推荐等级表明推荐的有利效果很可能将超过不良效果,不过专家对这些推荐的权衡把握不足——这是因为某些证据质量较低(因此优势和风险仍存在不确定性)或其优点和缺点接近平衡。强推荐等级用“推荐”表示,而弱推荐等级用“建议”表示。
强推荐是指大多数患者接受的,并且大多数医生在大多数情况下采用的干预手段。对于患者个体来说,可能存在的环境因素会造成强推荐不能或者不应该适用,比如患者的偏好或临床特征是推荐不适用(见表4)。强推荐并不代表医疗标准。
这份文件中出现了很多最佳实践声明(BPS),这些声明代表了未分级的强推荐,并且需要在严格标准下使用。比如,当获益和危害不确定,采用GRADE方法很难总结证据时, 采用BPS 是合适的。GRADE 工作组建议的 BPS 标准见表5[5]。
投票过程:通过两个专业委员会成员的讨论制定陈述,和所有指南工作组成员面对面会议的审议,所有指南工作组成员会收到应用问卷星建立的投票模块的链接, 可以对该陈述投票表示同意、部分同意或反对。指南组成员投票率需达到75%且支持阈值达80%时,该陈述被接受。在三轮投票结束后仍未能达成共识者,投票者可以提出反馈以供陈述校正时考虑。
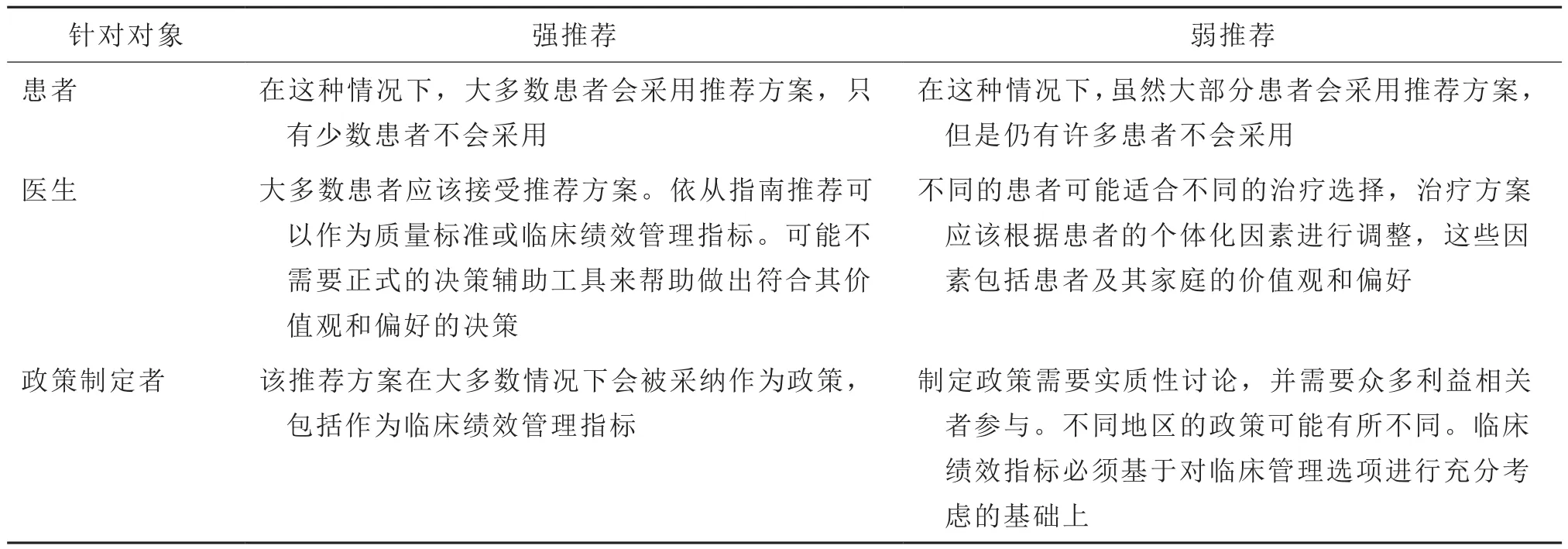
表4 推荐强度的应用

表5 BPS标准
定义
脓毒症是指因感染引起的宿主反应失调导致的危及生命的器官功能障碍[6-8]。脓毒性休克定义为脓毒症合并严重的循环、细胞和代谢紊乱,其死亡风险较单纯脓毒症更高[6]。
本指南虽然更新了脓毒症的定义,但是在制定时选用的临床证据还是沿用了之前定义的脓毒症、严重脓毒症、脓毒性休克。
诊断标准
对于感染或疑似感染的患者,当脓毒症相关序贯器官衰竭[sequential(sepsis-related)organ failure assessment,SOFA,见表6]评分较基线上升≥2分可诊断为脓毒症。由于SOFA评分操作起来比较复杂,临床上也可以使用床旁快速SOFA(quick SOFA,qSOFA, 见表7)标准识别重症患者,如果符合qSOFA标准中的至少2项时,应进一步评估患者是否存在脏器功能障碍[6]。
脓毒性休克是在脓毒症的基础上,出现持续性低血压,在充分容量复苏后仍需血管活性药来维持平均动脉压(MAP)≥65 mm Hg,以及血乳酸水平>2 mmol/L[6]。脓毒症和脓毒性休克的临床诊断流程见图1[6]。

表6 SOFA评分标准

表7 qSOFA标准
1 诊 断
推荐意见1:对于怀疑脓毒症或脓毒性休克患者,在不显著延迟启动抗菌药物治疗的前提下,推荐常规进行微生物培养(至少包括两组血培养)(BPS)。
在抗菌药物治疗开始之前先采样培养与改善预后有关[9-10]。如果能及时采样,则先采集血样进行培养;如果不能马上获得标本,尽快启动抗菌药物治疗。患者的标本来源包括血液、脑脊液、尿液、伤口、呼吸道分泌物及其他体液,一般不包括有创操作的标本来源。如果临床检查明确提示感染部位,则不需要对其他部位进行采样(除血样外)。对于留置静脉导管超过48 h且感染部位不明的患者,建议至少进行需氧瓶和厌氧瓶两组血培养。对于怀疑导管感染的患者,建议一组血标本经皮肤穿刺抽取,一组血标本由每个血管通路装置分别抽取。

图1 脓毒症和脓毒性休克的临床诊断流程
2 液体复苏
推荐意见2:脓毒性休克患者的液体复苏应尽早开始(BPS);对脓毒症所致的低灌注,推荐在拟诊为脓毒性休克起3 h内输注至少30 ml/kg的晶体溶液进行初始复苏(强推荐,低证据质量);完成初始复苏后,评估血流动力学状态以指导下一步的液体使用(BPS)。
早期开始液体复苏对于脓毒性休克至关重要。基于Rivers等[11]提出的方案,较早的指南已经推荐了标准化的定量复苏,称为早期目标导向性治疗(EGDT)。2018年“拯救脓毒症运动”对脓毒症集束化治疗进行更新,提出“1小时集束化治疗”策略,进一步强调了应立即开始复苏和治疗[12]。目前有干预试验将起始3 h内给予晶体溶液30 ml/kg作为早期复苏阶段的常规操作,也有观察性研究支持此项操作[13-14]。PROCESS 研究和 ARISE研究中,患者平均液体输注量约为30 ml/kg[15-16]。对于需要更多液体量的患者,应根据血流动力学评估结果指导进一步补液。在重症监护期间持续的液体正平衡是有害的[17-21]。因此,在患者血流动力学指标持续改善的前提下进行补液应谨慎,推荐进行补液试验评估液体反应性后再合理给予液体(BPS)。
推荐意见3:建议使用动态指标预测液体反应性(弱推荐,低证据质量)。
采用被动抬腿试验、容量负荷试验、补液后每搏输出量的变化、收缩压变化、脉压变化及机械通气后胸内压变化等动态检测指标预测液体反应性,可以提高诊断精度[22]。相关研究的回顾性分析结果显示,采用脉压变化预测脓毒症或脓毒性休克患者的液体反应性具有高敏感度及特异度[22]。
推荐意见4:对于需使用血管活性药物的脓毒性休克患者,推荐以MAP 65 mmHg 作为初始复苏目标(强推荐,中等证据质量);对于血乳酸水平升高的患者,建议以乳酸指导复苏,将乳酸恢复至正常水平(弱推荐,低证据质量)。
MAP是组织灌注的驱动力,在一定范围内反映组织灌注状态,临床研究比较65~85 mm Hg范围内 MAP目标值与患者相关临床指标的改善情况发现,与65 mmHg比较,更高的MAP目标值对患者28 d及90 d病死率、尿量、肾功能、动脉乳酸水平等均无显著改善[23-25],且可能增加患者心律失常风险[26]。另有研究表明,在年龄大于75岁的患者中,高MAP目标值与病死率的增加相关[27]。因此,强烈推荐MAP初始目标为65 mm Hg,但对于特殊患者,MAP目标值应根据患者的个体化情况而定,例如有高血压基础的脓毒性休克患者可能需要维持较高的MAP。
血乳酸水平与患者预后密切相关[28]。脓毒性休克患者早期动脉血乳酸高提示预后不良,24 h乳酸水平和乳酸清除率可有效评估临床治疗效果和预后[29]。对647例脓毒性休克患者以乳酸指导复苏的临床效果进行评估,与无乳酸监测复苏组比较,乳酸指导复苏组患者病死率显著下降[30-34]。对上述试验进行了Meta分析结果显示,与常规护理及采用ScvO2监测比较,采用早期乳酸清除策略可降低病死率[35-36]。在一项评价参附注射液治疗脓毒性休克的RCT研究中,血乳酸>4.5 mmol/L的患者接受参附注射液治疗后,其7d生存率较对照组显著提高[37]。一项纳入12个 RCTs共计904例患者的Meta分析显示,参附注射液可显著降低患者血乳酸水平[38]。我国一项RCT研究显示,监测血乳酸能够提高复苏效果,降低脓毒性休克患者的病死率。以6 h内血乳酸<2 mmol/L作为目标指导复苏可显著改善预后[39]。
推荐意见5:初始液体复苏及随后的容量替代治疗中,推荐使用晶体液(强推荐,中等证据质量)。
与晶体液比较,应用胶体液无任何显著获益,且可能导致肾损伤以及凝血机制异常等不良事件,同时,胶体液价格较高,因此强力推荐脓毒症和脓毒性休克患者的液体复苏使用晶体液。有研究表明,平衡晶体液和生理盐水进行复苏,晶体液能降低30天主要肾脏不良事件发生率;高肌酐和高氯人群使用平衡晶体液避免主要肾脏不良事件获益最大。有研究表明,与限氯策略比较,含氯策略治疗的患者急性肾损伤和肾脏替代治疗(RRT)的风险增高[40],故无论使用哪种溶液,均建议监测血清氯化物水平以避免高氯血症。
推荐意见6:不推荐使用羟乙基淀粉进行容量替代治疗(强推荐,高证据质量)。
目前已有多项研究对羟乙基淀粉(HES)在脓毒症患者中的安全性问题进行了报道。一项比较HES与白蛋白或晶体液的Meta分析结果显示,HES可导致更高的病死率及需进行连续性RRT(CRRT)的风险[41]。一项RCT研究显示,对于严重脓毒症液体复苏的患者,使用HES的90天死亡及RRT风险较醋酸林格液均显著增加[42]。Li等[43]的Meta分析结果也显示,HES可显著降低儿童脓毒症患者血小板计数,延长ICU住院时间,并对肾功能造成损害。
推荐意见7:在早期复苏及随后的容量替代治疗阶段,当需要大量的晶体溶液时,建议可以加用白蛋白(弱推荐,低证据质量)。
SAFE研究表明,严重脓毒症与脓毒性休克患者使用白蛋白进行液体复苏的安全性和有效性与生理盐水相当(合并脑外伤患者除外)[44]。一项汇总了17项白蛋白与其他液体治疗脓毒症或脓毒性休克患者随机试验数据的Meta分析显示,白蛋白在降低患者病死率方面更佳[45]。一项纳入1 818例严重脓毒症患者的多中心随机对照研究LBIOS结果显示,白蛋白联合晶体液复苏患者的28天病死率与仅用晶体液复苏组比较无显著性差异,但7天内的液体正平衡量及平均心率显著低于仅用晶体液组,MAP高于仅用晶体液组[46]。国内外多项关于比较白蛋白与其他液体复苏治疗疗效的Meta分析结果显示,白蛋白治疗可显著降低脓毒症及脓毒性休克患者(包括成人和儿童)28天和90天病死率[45,47-48]。
推荐意见8:推荐只有在患者血红蛋白降至<7.0 g/dl且排除心肌缺血、严重低氧血症或急性出血等情况时才可输注红细胞(强推荐,高证据质量)。
TRISS试验对比了ICU脓毒性休克患者的输血阈值7 g/dl与9 g/dl,研究发现,7 g/dl组患者输血量更少,90天病死率、缺血事件发生率及生命支持需求方面与9 g/dl组比较无显著差异;ProCESS研究涉及的输血阈值分别为10 g/dl与7.5 g/dl,结果表明,两组患者60天院内病死率及90天病死率比较无显著性差异[49-50]。
推荐意见9:对无出血或无计划进行有创操作的脓毒症患者,不建议预防性输注新鲜冰冻血浆(弱推荐,极低证据质量)。
目前尚无评估输注新鲜冰冻血浆对脓毒症患者预后的RCT研究。仅当证实有凝血因子缺乏、活动性出血或在外科手术或侵入性操作之前,建议输注新鲜冰冻血浆[51]。
推荐意见10:对于血小板计数<10 000/mm3(10×109/L)且无显著出血征象,或<20 000/mm3(20×109/L)同时存在高出血风险的患者,建议预防性输注血小板。对存在活动性出血或需进行手术或有创操作的患者,血小板计数需要达到 ≥50 000/mm3(50×109/L)(弱推荐,极低证据质量)。
血小板异常常见于脓毒症患者,且与不良治疗结局相关[52]。脓毒症患者经常出现可增加出血风险的危险因素,需要更高的血小板数,但目前尚无关于脓毒症患者预防性输注血小板的RCT研究。目前预防性血小板输注的推荐是基于白血病和干细胞移植治疗诱发的血小板减少症患者预防性血小板输注的相关临床试验[53-60]。
3 抗感染治疗
推荐意见11:推荐抗菌药物在入院后或判断脓毒症以后尽快使用,最佳在1 h 内,延迟不超过3 h(强推荐,中等证据质量)。
抗菌药物的尽早使用对脓毒症或脓毒性休克患者的预后至关重要。在出现脓毒症或脓毒性休克的情况下,延迟应用抗菌药物将增加病死率[61],且抗菌药物的延迟应用对住院时间、感染相关的器官损伤等次要终点产生不良影响[62-65]。Meta分析研究均支持脓毒症和脓毒性休克患者尽早应用抗菌药物[61-69]。
推荐意见12:对于脓毒症或脓毒性休克患者,推荐经验性使用可能覆盖所有病原体的抗菌药物(强推荐,中等证据质量)。对于脓毒性休克早期处理,推荐经验性联合使用抗菌药物(弱推荐,低证据质量);对于脓毒症而没有休克的患者或中性粒细胞减少的患者,不推荐常规联合使用抗菌药物(强推荐,中等证据质量)。
多项研究表明,未能进行适当的经验性抗菌药物治疗可显著增加脓毒症和脓毒性休克患者的发病率和病死率[67,70-72]。因此,初始经验性抗感染治疗方案应采用覆盖所有可能致病菌的单药或联合治疗。多数情况下,可使用一种碳青霉烯类或广谱青霉素/β-内酰胺酶抑制剂组合,也可使用三代或更高级别的头孢菌素,特别是选择多药治疗方案时。多项研究结果显示,联合治疗可提高严重脓毒症患者的生存率,尤其是脓毒性休克患者的生存率[73-74]。
对于无休克的脓毒症患者,有研究表明,联合治疗并不能显著改善患者预后,且存在增加患者病死率的风险[75-76]。对于中性粒细胞减少的脓毒症患者,研究一致表明,抗菌药物的联合应用对无休克的低风险患者无显著临床获益[77];对于血流动力学不稳定或出现器官衰竭的高风险患者,目前尚无足够证据支持联合治疗的临床获益[78-79]。
已发表的Meta分析结果显示,在抗感染治疗的基础上联合使用血必净注射液,可降低白细胞计数和过高的体温,控制炎症反应和多器官功能障碍综合征的发展,改善病情严重程度,降低脓毒症患者28天病死率[80-81]。
推荐意见13:在病原学诊断及药敏结果明确或临床症状充分改善后推荐进行降阶梯治疗(BPS)。
对绝大多数严重感染来说,在确定致病菌的情况下,应降阶梯至最窄谱抗菌药物治疗以缩小覆盖范围[82]。Guo等[82]进行的一项纳入9项研究的Meta分析结果显示,抗菌药物的降阶梯治疗与持续应用广谱抗菌药物对患者的病死率比较无显著差异。几项观察性研究结果显示,抗菌药物的降阶梯治疗能降低病死率[10,83]。鉴于不必要的持续性抗菌药物的使用给社会和个人带来的不良后果,推荐抗菌药物降阶梯治疗。当发现感染不存在时,应立即停止抗菌药物的使用,以避免产生耐药及不良反应。
推荐意见14:在脓毒症或者脓毒性休克患者中,抗菌药物的剂量优化策略应基于目前公认的药效学/药动学原则及药物的特性(BPS)。
脓毒症及脓毒性休克患者抗菌药物的剂量优化需考虑以下几点:肝肾功能不全的风险、未被发现的免疫功能障碍以及对耐药菌的易感体质。液体复苏导致的细胞外容量的增加使大多数抗菌药物的分布容积变大,导致多数患者体内抗菌药物水平未达到预期,因此,这些患者的初始抗菌药物治疗均应使用最高负荷剂量[84-87]。此外,脓毒症和脓毒性休克患者出现的多种生理紊乱可极大地改变抗菌药物的药动学稳定性,如血流动力学的改变、肾脏清除率的改变等[88-91]。因此,当脓毒症和脓毒性休克患者应用抗菌药物的多药联合治疗时,应对其进行治疗药物监测。
推荐意见15:建议脓毒症及脓毒性休克患者的抗菌药物疗程为7~10 d(弱推荐,低证据质量);对于脓毒性休克,如果初始应用联合治疗后临床症状改善或感染缓解,推荐降阶梯,停止联合治疗(BPS)。
不必要地延长抗菌药物的使用对社会和患者自身都是不利的。对于大多数严重感染的患者而言,治疗持续7~10 d 是足够的[92-95]。但由于脓毒症患者宿主因素的复杂性及微生物之间复杂的相互作用,抗菌药物疗程应根据患者病情个体化制定。多项观察性研究表明,脓毒性休克多药联合治疗的早期降阶梯与更好的临床预后相关[10,96-98]。此外,早期降阶梯可减少细菌耐药的发生[99-101]。另有研究表明,每日评估抗菌药物降阶梯的可行性可能降低患者病死率[10,102],因此推荐每日对脓毒症和脓毒性休克患者的抗菌药物使用进行降阶梯评估。
下列患者使用长时程(>10 d)抗菌药物治疗是合理的,包括临床改善缓慢、感染源难以控制、金黄色葡萄球菌相关的脓毒症(尤其是MRSA)及某些真菌、病毒感染、免疫缺陷患者[103-105]。
推荐意见16:建议以测定降钙素原(PCT)水平为辅助手段指导脓毒症患者抗菌药物疗程(弱推荐,低证据质量)。
目前世界许多地区通过测定血清PCT水平辅助诊断急性感染及辅助确定抗菌药物疗程。近期一项大型随机试验证明,以血清PCT水平指导重症感染患者抗菌药物使用,可显著缩短治疗持续时间,减小药物日剂量,降低患者病死率[106]。 以PCT作为辅助手段可缩短脓毒症患者抗菌药物疗程,且不增加病死率[107-115]。因此,PCT或其他生物标记物的检测可作为临床评估的辅助手段,抗菌药物的起始及减停需结合临床具体情况判定。
推荐意见17:推荐对可能有特定感染源的脓毒症患者,应尽快明确其感染源,并尽快采取适当的控制措施(BPS)。
脓毒症和脓毒性休克的感染源控制原则是感染部位的快速诊断和及时处理[116]。对易于清除的感染灶,包括腹腔内脓肿、胃肠道穿孔、胆管炎、胆囊炎、肾盂肾炎伴梗阻或脓肿、肠缺血、坏死性软组织感染和其他深部间隙感染(如脓胸或严重的关节内感染),应在初始复苏后尽快控制感染灶[117-118],一般诊断后不超过6~12 h[119-123]。当血管内植入装置为疑似感染源时,拔除导管可能是有益的。
4 血管活性药物
推荐意见18:推荐去甲肾上腺素作为首选血管加压药(强推荐,中等证据质量);对于快速性心律失常风险低或心动过缓的患者,可将多巴胺作为替代药物(弱推荐,低证据质量)。
去甲肾上腺素通过其缩血管作用而升高MAP,对心率和每搏输出量的影响小,可有效改善脓毒性休克患者的低血压状态。多巴胺主要通过增加心率和每搏输出量升高 MAP,可能对心脏收缩功能受损的患者疗效更好,但可能引发心动过速,增加患者心律失常的风险[124]。
一项纳入11项随机试验的比较去甲肾上腺素与多巴胺的系统评价和Meta分析(n=1 710)不支持常规使用多巴胺治疗脓毒性休克,研究显示,与多巴胺比较,去甲肾上腺素可降低患者病死率,并可显著降低心律失常的风险[125]。我国一项去甲肾上腺素与多巴胺治疗脓毒性休克的Meta分析显示,与多巴胺比较,去甲肾上腺素可以改善脓毒性休克患者的血流动力学,降低患者的病死率[126]。
推荐意见19:建议在去甲肾上腺素基础上加用血管加压素(最大剂量0.03 U/min)以达到目标MAP或降低去甲肾上腺素的用量(弱推荐,中等证据质量)。对于脓毒性休克患者,推荐在血管活性药物使用的基础上加用参附注射液以增加提升血压的效果、稳定血压和减少血管活性药物用量(强推荐,中等证据质量)。
脓毒性休克患者体内血管加压素水平低于休克状态的预期水平[127]。小剂量血管加压素(0.03 U/min)用于其他升压药治疗无效的脓毒性休克患者 ,可提高MAP或减少去甲肾上腺素的用量[127-132]。VASTT 研究结果显示,单用去甲肾上腺素组与联用血管加压素(0.03 U/min)组患者28天、90天病死率及严重不良事件发生率比较无显著性差异,亚组分析显示,病情较轻(随机时接受<15 μg /min去甲肾上腺素与血管加压素联合)的患者28天病死率更低[133]。后续试验表明,对于急性肾衰竭的脓毒性休克患者,联用小剂量血管加压素较单用去甲肾上腺素获益更多[134]。特利加压素与血管加压素具有相似的效应。研究表明,小剂量特利 加压素与去甲肾上腺素联用可通过改善组织血供、保护器官功能等显著改善临床效果[135]。
关于血管加压素与去甲肾上腺素的比较,对9项临床研究(共1 324例脓毒性休克患者)进行Meta分析显示,使用血管加压素(或特利加压素)与使用去甲肾上腺素患者病死率比较无显著性差异[129,132,136-139]。基于血管加压素对病死率影响的不确定性,不推荐使用血管加压素作为一线血管加压药用于改善MAP。
我国相关RCT及Meta分析研究显示,在常规治疗和使用血管活性药物的基础上,联合应用参附注射液,可升高脓毒性休克患者的MAP,降低病死率[37-38]。在改善临床症状、加强脏器功能保护上具有积极作用[140-141],并且可以减少血管活性药物的剂量,从而减轻相关不良反应[142]。
推荐意见20:不推荐使用低剂量多巴胺用于肾脏保护(强推荐,高证据质量)。
随机临床试验和相关Meta分析显示,与安慰剂比较,低剂量多巴胺(LDD)对患者 RRT 需求、尿量、生存期、住院时间、心律失常发生率等均无显著改善[143-144]。我国相关研究表明,LDD不能降低脓毒症急性肾衰竭患者RRT需求及病死率[145]。
推荐意见21:经过充分的液体复苏以及使用血管活性药物后,如果仍持续低灌注,建议使用多巴酚丁胺(弱推荐,低证据质量)。
多巴酚丁胺作为一线正性肌力药,为 EGDT临床试验标准治疗的一部分[11,146],在其使用中未发现对病死率的不良影响[15-16,23,147]。两项ICU脓毒症患者的大型前瞻性临床试验显示,使用多巴酚丁胺将患者心输出量提高至高于正常水平,不会改善临床结局[148-150]。然而,一些患者可能通过正性肌力药物改善组织灌注,增加氧气输送。我国一项评价多巴酚丁胺联用去甲肾上腺素治疗脓毒性休克伴顽固性低血压的研究表明,多巴酚丁胺可有效升高血压,改善循环与灌注,提高救治成功率[151]。
推荐意见22:建议所有需要血管活性药物的患者置入动脉导管进行连续性血压测定(弱推荐,极低证据质量)。
在休克状态,使用动脉导管监测血压比袖带血压计测量更准确,可进行连续监测且允许每搏输出量分析,有助于医务人员更准确评估患者的休克状态, 采取治疗措施[152-153]。
5 糖皮质激素
推荐意见23:对于脓毒性休克患者,在经过充分的液体复苏及血管活性药物治疗后,如果血流动力学仍不稳定,建议静脉使用氢化可的松,剂量为每天200 mg(弱推荐,低证据质量)。
脓毒性休克患者对液体和血管活性药物治疗的反应性是选择氢化可的松治疗的重要因素。法国一项多中心RCT研究结果显示,对于血管活性药无反应(液体复苏和血管活性药治疗超过1 h,收缩压<90 mm Hg)的脓毒性休克患者,相对肾上腺功能不全患者 [定义为最大促肾上腺皮质激素(ACTH)皮质醇增加≤9 μg/dl]使用氢化可的松可显著逆转休克,降低病死率[154]。两项小规模RCTs 也显示类固醇治疗对逆转休克的作用显著[155-156]。
对于无持续休克、死亡风险较低的严重脓毒症患者,一项大型欧洲多中心试验(CORTICUS)结果表明,不考虑血压对血管活性药物是否敏感的情况下,糖皮质激素未降低患者病死率[157]。另有研究报道,低剂量氢化可的松可逆转休克,减轻严重脓毒症患者的炎症反应,改善临床状态,但对28天病死率无显著改善[158-160]。
6 抗凝治疗
推荐意见24:不推荐使用抗凝血酶治疗脓毒症和脓毒性休克(强推荐,中等证据质量)。
目前多项关于抗凝血酶治疗脓毒症和脓毒性休克的研究结果均显示,抗凝血酶未能显著降低患者病死率,且与患者出血风险的增加有关[161-163],因此不推荐使用该药物。
近期关于肝素用于脓毒症及脓毒性休克的研究取得了较好进展,两项系统评价显示,肝素对无大出血风险脓毒症患者的生存率具有潜在的收益[164]。Yang等[165]开展了一项纳入224例患者的RCT,结果表明,早期给予肝素治疗可显著抑制血小板减少,进而改善组织灌注,降低活动性出血的风险。
国内RCT研究显示,血必净注射液治疗可改善脓毒症患者的凝血指标,改善血流动力学障碍,降低脓毒症患者弥散性血管内凝血(DIC)发生率和脓毒症并发DIC患者的28天病死率[166-168]。在脓毒症合并凝血功能障碍或发生DIC时,可使用血必净注射液治疗。
7 肾脏替代治疗
推荐意见 25:对于脓毒症合并急性肾损伤(AKI)的患者,如需行 RRT,CRRT 和间歇性RRT均可(弱推荐,中等证据质量)。对于血流动力学不稳定的脓毒症患者,建议使用 CRRT(弱推荐,极低证据质量)。
尽管许多非随机对照研究报道了使用CRRT对提高生存率具有非常显著的趋势[169-175],目前两项 Meta分析报道了接受CRRT和间歇性RRT的患者住院病死率比较无显著性差异[176-177],即使进行仅包括RCT研究的亚组分析,仍未发现两组间患者病死率的差异[177]。另有一项纳入360例患者的大规模 RCT研究结果显示,CRRT组和间歇RRT组患者生存率无显著性差异[178]。
对于血流动力学不稳定的脓毒症患者,目前尚无RCT评估CRRT和间歇性RRT的血流动力学耐受性。其余证据中,两项前瞻性试验报道CRRT有较好的血流动力学耐受性,但对患者局部灌注及生存率无改善[179-180]。
CRRT流量:在目前的文献综述中,有两个研究报道了CRRT的流量对急性肾功能衰竭患者临床结局的影响[181-182]。结果并未显示与较高流量RRT相关病死率的任何差异。比较RRT流量的两项大规模、多中心随机试验也未能显示出患者接受高流量RRT的相关获益[183-184]。对所有相关RCTs(n=1 505)结果进行Meta分析表明,RRT流量和病死率比较没有任何显著的相关性,然而,点估计值支持 CRRT 流量> 30 ml·kg-1·h-1),由于偏倚、一致性差等风险,估计的置信度较低,应进行进一步研究。
CRRT时机:2016年发布的两项相关RCTs结果表明,早期启动RRT对病死率、透析的需求及中枢感染方面的获益及风险不确定[185-186]。由于两项试验的入选标准和启动RRT的时机不同,且基于方法的间接性(许多非脓毒症患者),试验结果的准确性较低。
推荐意见26:对于脓毒症合并AKI的患者,如果仅有肌酐升高或少尿而无其他透析指征时,不建议进行RRT(弱推荐,低证据质量)。
近期一项相关RCT结果表明,早期开始RRT对于合并AKI重症患者的病死率无显著影响,但可增加患者透析次数及血液感染的发生[185],风 险和成本超过收益。因此,在没有其他明确透析指征的情况下,不推荐在仅肌酐增加或少尿的脓毒症合并AKI患者中进行RRT。
8 机械通气
推荐意见27:对脓毒症诱发急性呼吸窘迫综合征(ARDS)患者进行机械通气时,推荐设定潮气量为6 ml/kg(强推荐,高证据质量)。推荐设定平台压上限为30 cmH2O(强推荐,中等证据质量)。对脓毒症导致的中到重度ARDS(PaO2/FiO2≤200 mmHg)患者,建议使用较高的PEEP(弱推荐,中等证据质量)。
目前ARDS患者使用低潮气量肺保护策略是被广泛接受的。几项Meta分析表明,ARDS的压力和体积限制策略可降低患者的病死率[187-188]。一项大规模的RCT结果显示,相对于潮气量12 ml/kg,6 ml/kg潮气量可使ARDS患者病死率降低9%[189]。每个ARDS患者的精确潮气量需要根据诸如平台压力、选择呼气末正压通气(PEEP)、胸腹顺应性和患者呼吸力等因素调整,严重代谢性酸中毒、高分钟机械通气量或身材矮小的患者可能需要额外调整潮气量。
一些临床医生认为,潮气量>6 ml/kg预测体重机械通气可能是安全的,只要平台压力维持在≤30 cmH2O即可[189-190]。一项回顾性研究表明,由于较低的平台压力与住院病死率降低相关,即使平台压力≤30 cmH2O也应降低潮气量[191]。
在ARDS患者机械通气中提高PEEP可能会防止肺泡萎陷,增加气体交换面积。一项Meta分析显示,中 度 或 重 度 ARDS(PaO2/FiO2≤ 200 mmHg)患者使用较高的PEEP可降低病死率[192]。
推荐意见28:推荐对成人脓毒症导致PaO2/FiO2<150 mmHg的ARDS患者使用俯卧位通气(强推荐,中等证据质量),不推荐使用高频振荡通气(HFOV)(强推荐,中等证据质量)。
近期有两项针对HFOV在中-重度ARDS中作用的大规模RCTs发表[193-194],其中一项研究因HFOV组患者的病死率较高而提前终止。包括近期研究在内的5项RCTs的合并分析显示,HFOV对患者病死率及机械通气持续时间无影响,但HFOV组患者气压伤发生率增加。
俯卧位通气可降低胸膜腔压力梯度,提高胸壁顺应性,促进分泌物的清除,从而改善ARDS患者的通气。对于PaO2/FiO2<150 mm Hg的ARDS患者,与仰卧位比较,在插管开始后的前36 h内,每天进行16 h以上俯卧位通气可提高生存率[195]。包括该研究在内的Meta分析显示,俯卧位通气可降低患者病死率,改善氧合作用[196]。大多数患者采用俯卧位通气可改善氧合并可能改善肺顺应性[195,197-200]。
推荐意见 29: 建 议 使 用 神 经 肌 肉 阻 滞剂(NMBAs)的时间≤48 h(弱推荐,中等证据质量)。
NMBA 在ICU中最普遍的适应证是促进机械通气[201]。研究表明,与安慰剂比较,PaO2/FiO2<150 mm Hg的早期ARDS患者连续输注顺式阿曲库铵与生存率的改善和器官功能正常时间的延长相关,且未增加ICU获得性肌无力的风险[202]。合并分析三项关于NMBAs在ARDS中的作用的试验,结果显示,短疗程(≤48 h)连续输注NMBAs治疗患者的死亡风险及气压伤风险均降低[203]。一项关于严重脓毒症患者的RCT显示,在深度神经肌肉阻滞期间,氧气输送、氧气消耗及胃黏膜pH值无显著改善[204]。
推荐意见30:对于脓毒症导致的ARDS,如无组织低灌注证据,推荐使用限制性液体治疗策略(强推荐,中等证据质量)。
ARDS患者肺水肿的发病机制包括毛细血管通透性的增加、静水压力的增加及胶体渗透压的降低[205]。研究表明,对ARDS的限制性液体治疗策略可减少患者的机械通气时间及ICU住院时间,且对肾衰竭发生率及病死率无显著影响[206]。限制性液体策略对降低脓毒症患者ARDS的发生率有益处,在发生脓毒性休克的12 h以内,血管外肺水指数的下降意味着生存率的提高[207]。小样本研究显示,对重症患者采用限制性液体策略,与采用液体正平衡策略比较,病死率更低,机械通气时间更短,住院时间更短[208]。对1 000例急性肺损伤患者进行研究发现,与开放液体治疗组比较,限制性液体治疗组患者60天病死率未见显著改善,而氧合改善,肺损伤评分降低,机械通气时间缩短[209]。
推荐意见31:对于脓毒症导致的ARDS,如果无支气管痉挛,不推荐使用β2受体激动剂(强推荐,中等证据质量)。
几项RCTs研究评估了 β2受体激动剂在ARDS患者中的使用[210-212],其中两项试验由于无效或损伤而较早终止[212]。合并分析表明,β2受体激动剂可以减少ARDS患者的住院时间,显著减少机械通气时间,但也导致心律失常和心动过速的患者数增加[213]。
推荐意见32:对于脓毒症导致的ARDS,不推荐常规使用肺动脉置管(强推荐,高证据质量)。
目前缺乏可证明使用肺动脉导管治疗改善患者预后的证据[214-215]。两项多中心随机试验的合并分析未能显示使用肺动脉导管对病死率或ICU住院时间的任何受益[216-217]。
推荐意见33:对于脓毒症导致的呼吸衰竭患者,在可以耐受脱机时,推荐使用脱机方案(强推荐,中等证据质量)。脓毒症患者计划脱机前,推荐进行自主呼吸试验(强推荐,高证据质量)。
2016 ATS/ACCP临床实践指南:机械通气脱机推荐对机械通气超过24 h的成人患者使用低水平压力支持进行初始自主呼吸试验[218]。每日自主呼吸试验可减少患者机械通气时间和脱机持续时间[214,219-220]。呼吸试验应与自主唤醒试验同时进行[215]。自主呼吸试验成功可预示早期脱机的成功。
脱机方案包括自主呼吸试验、逐步减少压力支持和计算机辅助脱机。合并分析表明,与常规治疗比较,采用方案化脱机治疗的患者脱机持续时间及ICU 住院时间缩短,而ICU病死率或重新机械通气比率比较无显著性差异[219]。
9 镇静和镇痛
推荐意见34:对于需要机械通气的脓毒症患者,推荐应用最小剂量的连续性或者间断性镇静,以达到特定的镇静目标(BPS)。
有研究表明,限制机械通气的重症患者镇静剂的应用,可缩短患者机械通气时间、ICU住院时间及总住院时间,并可促进患者的早期活动[180,221-222],由此可推断脓毒症患者也会从最小化镇静中获益。限制镇静剂的使用包括如下几种方法:包含镇静评估的护理方案、使用间歇镇静而不是持续镇静、使用阿片类药物而避免镇静剂的使用及使用短效药物如丙泊酚、右美托咪定等,均证明可使需要机械通气的患者获益[222-225]。
10 血糖管理
推荐意见35:对于ICU脓毒症患者,推荐采用程序化血糖管理方案,推荐每1~2 h 监测一次血糖,连续两次测定血糖>10 mmol/L时启用胰岛素治疗,目标血糖为≤10 mmol/L(强推荐,高证据质量),血糖水平及胰岛素用量稳定后每4 h监测一次(BPS)。建议对有动脉置管的患者采集动脉血测定血糖(弱推荐,低证据质量)。
多项RCTs结果表明,与传统血糖控制(10~11.1 mmol/L)比较, 胰岛素强化治疗(3.9~6.1 mmol/L)未显著降低ICU患者病死率,并可显著增加严重低血糖风险[226-232]。一项针对脓毒症患者的Meta分析结果显示,胰岛素强化治疗对患者28天及90天病死率无显著改善,但增加患者低血糖风险[233]。多个医疗机构(如美国临床内分泌学家协会、美国糖尿病协会、美国心脏协会、美国医师学会和重症监护医学学会)公布的住院患者血糖控制的共识将葡萄糖水平定在7.8~10.0 mmol/L,因为没有证据表明7.8~10.0 mmol/L的指标与6.1~7.8 mmol/L的指标不同[234-235]。在没有显著低血糖的情况下可实施更严格的范围,如6.1~7.8 mmol/L[234-236]。应避免与高病死率相关的高血糖(>10 mmol/L)、低血糖和血糖水平波动较大[237-242]。
研究表明,多数患者1~2 h的监测间隔能满足血糖的及时调整,又能避免低血糖的发生,血糖较稳定后可延长监测时间。由于脓毒症患者糖代谢状态并非相同,具体监测间隔也应根据具体病情判定,对于血流动力学不稳定和应用儿茶酚胺的患者需注意低血糖的发生[229,243-244]。
床旁末梢血糖测定的准确性易受多种因素的影响,如设备类型、患者红细胞压积、患者氧分压及药物影响等。一项系统综述结果表明,使用动脉血测定血糖的准确度显著高于末梢毛细血管血[245]。美国食品药品管理局(FDA)及联邦医疗保险和医疗补助服务中心(CMS)也呼吁停止重症患者的末梢毛细管血糖测定[246]。
11 应激性溃疡
推荐意见36:对于脓毒症及脓毒性休克患者,如果存在消化道出血危险因素,推荐进行应激性溃疡的预防(强推荐,低证据质量)。
消化道应激性溃疡与重症患者的病死率相关[247]。一项Meta分析显示,预防应激性溃疡可降低重症患者的消化道出血风险[248]。针对脓毒症患者的研究表明,应激性溃疡的预防不会增加患者艰难梭菌的感染风险[249]。脓毒症患者常出现消化道出血的危险因素,如凝血障碍、机械通气超过48 h等,因此,在有危险因素的患者中预防应激性溃疡的获益大于其风险。
执笔人(按姓氏拼音排序):
曹 钰 柴艳芬 邓 颖 方邦江 刘明华 卢中秋
陆一鸣 聂时南 钱传云 田英平 杨立山 姚咏明
尹 文 于学忠 张新超 赵 敏 赵晓东 周荣斌
朱华栋 朱 曦 曾红科
共识专家组成员(以姓氏拼音为序):
蔡文伟 曹小平 曹 钰 柴艳芬 陈 兵 陈大庆
陈 锋 陈凤英 陈立波 陈晓辉 陈旭林 陈旭岩
陈玉国 楚英杰 褚 沛 邓 颖 邓 杨 丁 宁
董 凯 董士民 方邦江 方向明 封启明 冯建宏
干建新 高春江 高 路 高 燕 公保才旦龚建平
辜小丹 郭树彬 何 建 何 庆 洪玉才 胡大海
胡卫健 黄 亮 黄子通 姬新才 解 建 金武丕
黎檀实 李超乾 李金宝 李 莉 李培武 李树生
李文雄 李小刚 李银平 梁华平 梁诗颂 梁显泉
蔺佩鸿 刘 净 刘靖华 刘克玄 刘良明 刘明华
刘晓亮 刘 志 卢一郡 卢中秋 陆一鸣 逯林欣
吕传柱 马晓春 马岳峰 马中富 毛恩强 梅建强
米玉红 聂时南 欧阳军 潘曙明 彭 鹏 彭志勇
钱传云 钱克俭 秦伟毅 阮海林 单爱军 单志刚
商德亚 史继学 舒 强 司君利 宋 维 宋祖军
苏 磊 苏美仙 孙炳伟 孙明莉 孙运波 唐学杰
唐子人 田英平 童朝阳 童亚林 汪 健 王伯良
王华东 王时光 王小闯 王 煜 王 真 王 仲
魏 捷 吴先正 伍国锋 向旭东 肖献忠 肖 雪
熊旭东 徐 峰 许硕贵 许 铁 薛克栋 郇京宁
杨立山 杨 旻 杨明施 杨晓明 姚咏明 尹 文
于湘友 于学忠 詹 红 张国强 张国秀 张 泓
张剑锋 张劲松 张连阳 张 茂 张庆富 张庆红
张西京 张新超 赵 斌 赵 敏 赵晓东 赵 剡
郑 江 郑 宁 郑亚安 周发春 周荣斌 周 彤
朱 曦 朱华栋 朱继红 曾红科 左永波
