基于GC-MS分析两地白色藜麦种子的代谢差异
2019-06-24时羽杰李兴龙余海萍邬晓勇
时羽杰,李兴龙,唐 媛,余海萍,邬晓勇,*
(1.成都大学 农业农村部杂粮加工重点实验室,四川 成都 610106; 2.成都大学 药学与生物工程学院,四川 成都 610106)
代谢组学(metabolomics)是继基因组学、蛋白组学之后又一门新兴的组学,是系统生物学的重要组成部分,是对存在于生物体细胞、组织和生物流体中的非常小的分子(分子量<1 500)的代谢物进行系统的研究[1]。它主要包括靶向代谢组和非靶向代谢组[2]。靶向代谢组主要对单个或少量目标代谢物检测,但可检测的通量较低,需要使用大量标准品鉴定;而非靶向代谢组学是在有限的相关研究和背景知识的基础上,对整个代谢组进行系统、全面的分析,获取大量代谢物的数据,并对其进行处理,从而找出差异代谢物的一种研究方法[3-4]。代谢组学已在植物耐受胁迫方面被广泛应用,植物在受到环境胁迫和与不同生物及非生物的相互作用中会产生许多次生代谢产物,以保持植物在生境中良好的适应性,所以可通过研究植物的差异代谢物质的显著性变化来阐述其抗逆性[5]。
藜麦(Chenopodiumquinoa)是一种一年生苋科藜属双子叶植物[6],起源于南美洲安第斯山脉,因其有很高的营养价值,被称为“粮食之母”,在当地距今已有7 000多年的种植历史[7]。藜麦是适宜人类食用的营养食品,含有蛋白质、矿物质、氨基酸、纤维素、维生素等营养成分,含量明显高于大多数常见谷物[8]。美国国家航空航天局(NASA)将其列为人类未来移民外太空的理想“太空粮食”[9]。联合国粮农组织(FAO)认为藜麦是唯一一种可满足人体基本营养需求的单体的粮食作物,并正式推荐藜麦为最适宜人类的“全营养食品”[10],还将2013年定为国际藜麦年,以促进藜麦在全世界的推广和发展[11]。藜麦种子有多种颜色,营养品质差异较大[12]。来源于不同产地的同种藜麦在营养品质上存在明显的差异[13]。Park等[14]通过测定不同产地的藜麦种子发现美国产的藜麦种子的总多酚含量明显高于秘鲁与韩国。曹亚楠等[15]利用UPLC结合统计分析的方法研究四川、云南、甘肃、内蒙古和国外等多个产地的藜麦种子的营养成分发现,由于环境和土壤性质等原因,营养组分有很大差异。郭敏等[16]通过利用GC-MS研究云南、青海、秘鲁三地的藜麦种子,发现不同产地藜麦的脂肪酸组成相似,但含量差异显著,还有葡萄糖、麦芽糖等小分子物质差异也很显著。Reguera等[17]研究不同产地对藜麦营养成分的影响,发现不同的生境对藜麦营养成分影响较大。由于藜麦含有大量的多酚和黄酮物质,使得藜麦有较强的抗氧化能力,可以快速地通过自身的调节清除氧自由基,保护植物组织和细胞抵御非生物胁迫,赋予藜麦较强的抗逆性。不同的产地导致藜麦的抗氧化物质活性也有很大的差异。赵亚东[18]通过测定西宁和乌兰两地的藜麦发现,营养物质存在显著差异,西宁藜麦赖氨酸、粗纤维、脂肪、蛋白、淀粉等含量均高于乌兰藜麦,而乌兰藜麦的黄酮、多酚、皂苷等功能性物质的含量均高于西宁藜麦,所以乌兰藜麦有更强的清除氧自由基的能力,有更强的抗逆性。Hirose等[19]通过研究不同产地日本和南美的藜麦的抗氧化特性及黄酮类成分,发现日本藜麦的黄酮类成分高于南美藜麦,有较好的抗氧化活性,能更好地抵御非生物的胁迫。由于藜麦的高营养价值以及较强的抗逆性,能在土壤贫瘠的高寒地区种植,所以国内研究人员对其营养成分、抗氧化活性物质等研究较为深入。但利用GC-MS技术对不同产地藜麦的代谢物质进行分析,从差异代谢物以及代谢途径对不同产地的藜麦进行研究的报道甚少。所以本实验以非靶向代谢组学来探究四川和青海两地的白色藜麦种子,以获取全面的差异代谢物和相关代谢通路的信息,来揭示两地不同生境下白色藜麦种子的代谢差异,为今后研究揭示藜麦在不同栽培地区造成的差异提供理论依据,以期更好地指导藜麦在四川和青海两地的种植。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料与试剂
白色藜麦种子由成都大学农业农村部杂粮加工重点实验室提供,于2018年5月分别在四川省凉山州的盐源县和青海海西州都兰县种植,于2018年9月分别在两地收获藜麦种子,经发芽试验筛选,取发芽势和发芽率相似的种子,用筛选后的种子作为样本材料。
N-甲基-N-三甲基硅基三氟乙酰胺内含1%三甲基氯硅烷(GC derivatization,≥98.5%)、甲氧氨基盐酸盐、核糖醇标准品均购自Sigma公司。吡啶、甲醇、氯仿均为色谱纯(成都科隆化学品有限公司)。
1.1.2 实验仪器
Agilent GC-MS 7890B 5977气质联用仪(美国)、DB-5MS(30 m×0.25 mm,0.25 μm)毛细管气相色谱柱(安捷伦,美国)、THZ-82水浴恒温振荡器(常州荣华仪器制造有限公司)、通风橱、台式高速冷冻离心机H1850R(湘仪,湖南)、ZLS-2真空离心浓缩仪(赫西仪器有限公司,湖南)。
1.2 实验方法
代谢组样品制备参考薛水玉等[20]的方法,将藜麦种子加入液氮快速研磨,称取100 mg于EP管中,每个样品做6个重复样。均加入甲醇∶水∶氯仿体积比为2∶2∶1的溶液进行提取,于各管中移取300 μL上清液至一个干净的EP管中将有机溶剂完全挥干,再进行衍生化处理[21],将处理后的样品转移置进样瓶内衬管中于GC-MS中进行检测。
质控样品QC制备:等量移取每个样品的上清液混匀至300 μL于EP管中,做6个重复样本,与样品进行一样的处理后平均分配插入样品中上GC-MS进行检测,可以用于验证仪器和方法的稳定性和准确性。
1.3 GC-MS分析条件
色谱柱为DB-5MS(30 m×0.25 mm,0.25 μm)毛细管气相色谱柱。升温程序为起始温度保持在80 ℃,2 min后以10 ℃·min-1升至190 ℃,再以3 ℃·min-1升至220 ℃,最后以20 ℃·min-1升至280 ℃,保持10 min;载气为氦气(99.999%);恒流,流速为1 mL·min-1;进样模式为不分流进样,进样量1 μL。
电子碰撞内能为70 eV;离子源温度为220 ℃;传输线温度为270 ℃;注射剂温度为280 ℃;扫描速度为每20 s光谱全波段扫描法捕获;溶剂延迟:420 s;质量扫描范围m/z为70—500。
1.4 数据处理
用GC-MS光谱全波段扫描法分析藜麦种子的代谢物质。将原始数据上传至XCMS 平台进行预处理包括行峰识别、峰过滤、峰对齐等[22],同时设置相应参数[23]。最后得到包括质核比(m/z)和保留时间(rt)及峰面积(intensity)等信息的数据矩阵;导出数据至Excel进行后续整理,用SIMCA-P软件作主成分分析,然后利用正交-偏最小二乘判别分析,筛选差异代谢物,再利用Mev进行聚类热图分析,最后利用MetaboAnalyst平台进行代谢通路的分析。
2 结果与分析
2.1 主成分分析
用XCMS对原始数据进行峰识别、过滤、对齐等处理后,先将数据导出至Excel中进行面积归一化处理,把处理后的数据导入SIMCA-P软件中进行主成分分析(PCA),用UV算法处理数据进行拟合,拟合后方程的R2X=0.781>0.5说明拟合性较好,得到PCA的得分图(图1)。由图1可以观察到质控样品QC较为密集,说明方法和仪器稳定可靠,模型可以用于数据的分析。且所有样品除了点E2,其余的点都处在95%的置信区间内。组内样品都较为聚集,说明样品的重复性很好,且较为稳定;组间的样品E-F较为分散,说明E和F间存在着差异。用DModX进行初步筛选剔除异常点E2,以便后续分析的准确性。

E,青海都兰县的藜麦样本;F,四川盐源县的藜麦样本。下同。E, The samples from Dulan County, Qinghai Province; F, The samples from Yanyuan County, Sichuan Province. The same as below.图1 PCA总得分图Fig.1 PCA total score
2.2 正交-偏最小二乘判别分析
2.2.1 OPLS-DA分析模型的建立及验证
为了筛选出组间的差异代谢物,要通过监督分析模式,正交-偏最小二乘判别分析(OPLS-DA)过滤掉与分类无关的信息以更为准确地分析组间差异[24]。首先把青海都兰和四川盐源的白色藜麦种子进行分组,用Par算法处理数据后,用OPLS-DA模型进行拟合,得到OPLS-DA得分图(图2-a)。由得分图可知,E-F组明显分开,说明组间差异大;组内点相对较为聚集,说明样品内的重复性好且较为稳定。再经过OPLS-DA置换检验来验证模型是否过拟合,得到检验图(图2-b)。图中所有蓝色的Q2点从左到右均低于最右边的原始的蓝色的Q2点,且Q2<0,R2和Q2的回归线与横坐标交叉或者小于0,说明评估模型可靠有效[25]。可以用OPLS-DA模型来进行数据的分析。
2.2.2 差异代谢物筛选
根据OPLS-DA分析得到S-plot图(图3-a)和变量投影重要性(VIP)图(图3-b)来筛选差异代谢物质。S-plot图中所有的代谢物质呈现“S”型分布,其中越靠近“S”型的末尾两端,贡献越大,差异越显著[27];VIP图中柱子越高,VIP值越大,贡献越大,差异越显著。再通过SPSS 22.0软件对筛选出的差异代谢物进行t检验,当P<0.05时表明差异显著,被认为有统计学意义。最后通过综合分析(VIP>1,P-value<0.05)来筛选出差异标志代谢物[26],总共筛选出显著差异代谢29个。再用SPSS 22.0进行变化差异倍数分析(fold change,FC)得到FC值,把FC值进行log以2为底的数据转换,让差异特别大的和差异比较小的数值缩小之间的差距,突显差异代谢物的表达,一般来说,log2FC>0,说明表达为上调;log2FC<0,说明表达为下调。本实验的数据处理后结果如表2,经过筛选总共检测到差异代谢物质29个,主要是15个氨基酸(甘氨酸、L-缬氨酸、L-谷氨酸、谷胱甘肽、GABA等),6个有机酸(5-磺基水杨酸、乳清酸、肉桂酸等),还有一些糖醇、胺类、多酚和生物碱。其中有22个差异代谢物质的log2FC>0,为表达上调,主要包括12个氨基酸,5个有机酸和一些糖醇、多酚和生物碱;7个差异代谢物质的log2FC<0,为表达下调,主要包括5-磺基水杨酸、N,N-二甲基甲酰胺、β-丙氨酰-赖氨酸、L-谷氨酸、表没食子儿茶素、3-甲基氧基苯二甲酸酯、异丁胺。所以基本上所有的氨基酸和有机酸的含量都显著增加,氨基酸和有机酸是重要的渗透调节物质,与植物的抗逆性密切相关。
2.3 聚类热图分析
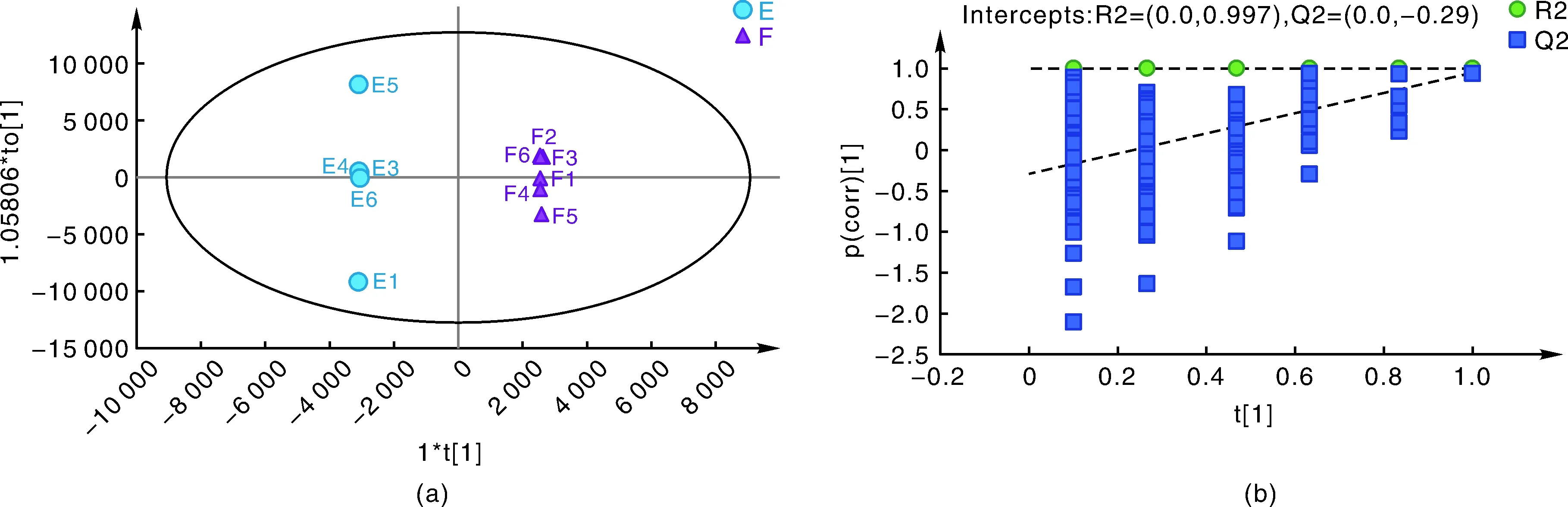
图2 OPLS-DA得分图(a)和检验图(b)Fig.2 OPLS-DA score plot (a) and permutation test graph (b)
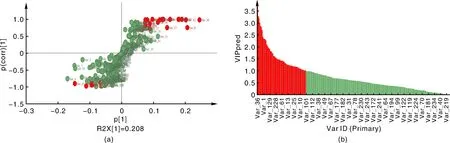
图3 OPLS-DA的S-plot图(a)和变量投影重要性图(b)Fig.3 S-plot graph (a) and VIP graph (b) of OPLS-DA
表1E-F中筛选的差异代谢物
Table1Differential metabolites screened in E-F
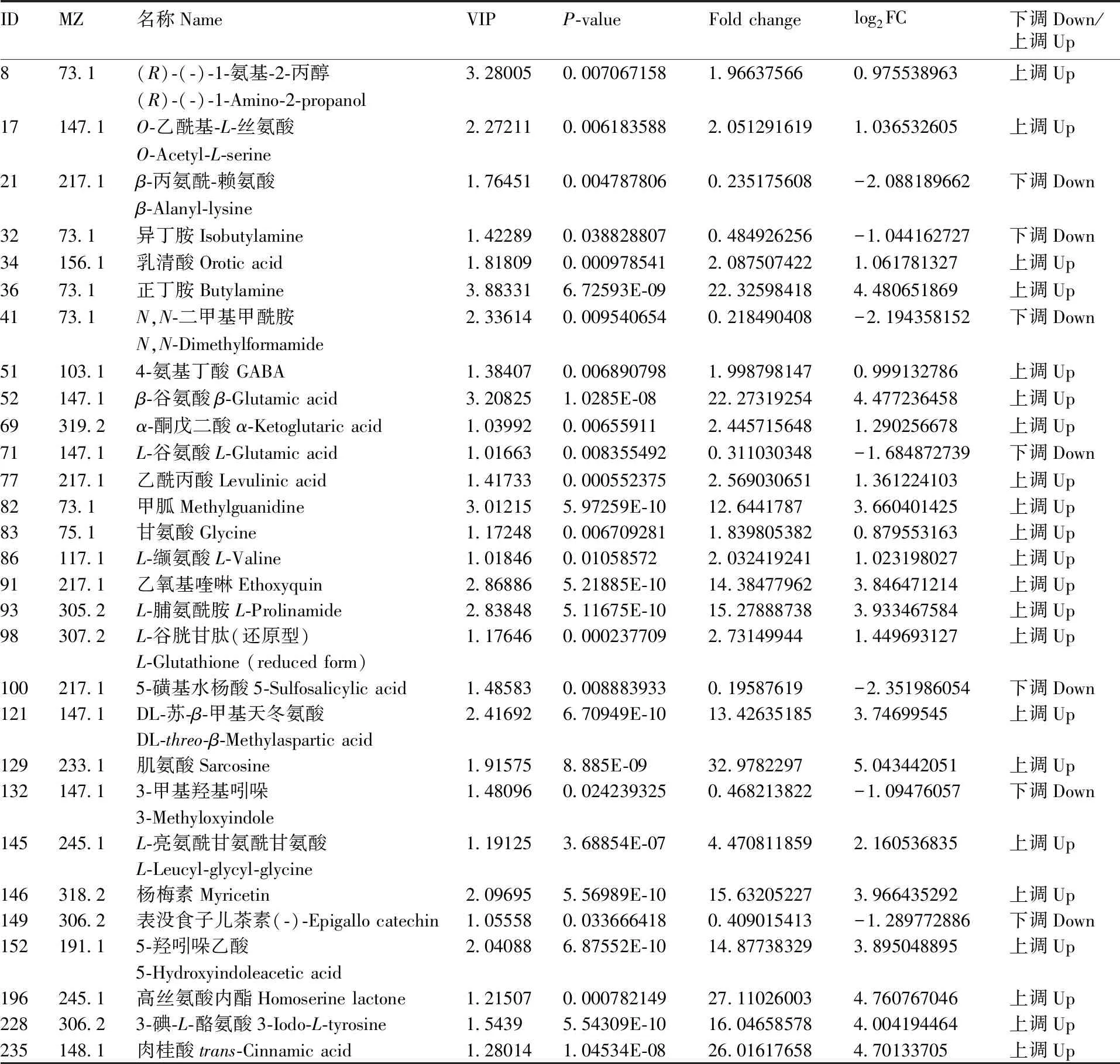
IDMZ名称NameVIPP-valueFold changelog2FC下调Down/上调Up873.1(R)-(-)-1-氨基-2-丙醇3.280050.0070671581.966375660.975538963上调Up(R)-(-)-1-Amino-2-propanol17147.1O-乙酰基-L-丝氨酸2.272110.0061835882.0512916191.036532605上调UpO-Acetyl-L-serine21217.1β-丙氨酰-赖氨酸1.764510.0047878060.235175608-2.088189662下调Downβ-Alanyl-lysine3273.1异丁胺Isobutylamine1.422890.0388288070.484926256-1.044162727下调Down34156.1乳清酸Orotic acid 1.818090.0009785412.0875074221.061781327上调Up3673.1正丁胺Butylamine3.883316.72593E-0922.325984184.480651869上调Up4173.1N,N-二甲基甲酰胺2.336140.0095406540.218490408-2.194358152下调DownN,N-Dimethylformamide51103.14-氨基丁酸 GABA 1.384070.0068907981.9987981470.999132786上调Up52147.1β-谷氨酸β-Glutamic acid3.208251.0285E-0822.273192544.477236458上调Up69319.2α-酮戊二酸α-Ketoglutaric acid1.039920.006559112.4457156481.290256678上调Up71147.1L-谷氨酸L-Glutamic acid 1.016630.0083554920.311030348-1.684872739下调Down77217.1乙酰丙酸Levulinic acid 1.417330.0005523752.5690306511.361224103上调Up8273.1甲胍Methylguanidine3.012155.97259E-1012.64417873.660401425上调Up8375.1甘氨酸Glycine 1.172480.0067092811.8398053820.879553163上调Up86117.1L-缬氨酸L-Valine 1.018460.010585722.0324192411.023198027上调Up91217.1乙氧基喹啉Ethoxyquin2.868865.21885E-1014.384779623.846471214上调Up93305.2L-脯氨酰胺L-Prolinamide 2.838485.11675E-1015.278887383.933467584上调Up98307.2L-谷胱甘肽(还原型)1.176460.0002377092.731499441.449693127上调UpL-Glutathione (reduced form)100217.15-磺基水杨酸5-Sulfosalicylic acid1.485830.0088839330.19587619-2.351986054下调Down121147.1DL-苏-β-甲基天冬氨酸2.416926.70949E-1013.426351853.74699545上调UpDL-threo-β-Methylaspartic acid129233.1肌氨酸Sarcosine1.915758.885E-0932.97822975.043442051上调Up132147.13-甲基羟基吲哚1.480960.0242393250.468213822-1.09476057下调Down3-Methyloxyindole145245.1L-亮氨酰甘氨酰甘氨酸1.191253.68854E-074.4708118592.160536835上调Up L-Leucyl-glycyl-glycine146318.2杨梅素Myricetin 2.096955.56989E-1015.632052273.966435292上调Up149306.2表没食子儿茶素(-)-Epigallo catechin 1.055580.0336664180.409015413-1.289772886下调Down152191.15-羟吲哚乙酸2.040886.87552E-1014.877383293.895048895上调Up5-Hydroxyindoleacetic acid 196245.1高丝氨酸内酯Homoserine lactone1.215070.00078214927.110260034.760767046上调Up228306.23-碘-L-酪氨酸3-Iodo-L-tyrosine1.54395.54309E-1016.046585784.004194464上调Up235148.1肉桂酸trans-Cinnamic acid 1.280141.04534E-0826.016176584.70133705上调Up
将E-F中筛选出的差异代谢物质进行聚类热图分析,得到聚类热图(图4)。图中每一个纵列表示一组样本,每个像素点表示一个代谢物。每个像素点的颜色从绿色到红色过渡,其中颜色表示物质的表达程度,红色为高表达代谢物,绿色为低表达代谢物。进行层次聚类分析,图中显示E1、E3、E4、E5、E6、E2的E组所有样品都聚集在同一簇中,F3、F4、F5、F1、F2、F6的F组的所有样品都聚集在同一簇中,而且E组和F组明显分开,说明两组之间存在明显差异,也说明筛选出的显著差异代谢物能作为标志物将两组明显区分开,其中有的代谢物质也被聚在一簇中,说明这些代谢物有相似的功能或参与了同一条代谢通路。
2.4 差异代谢物通路分析
把筛选出的差异代谢物质数据上传至MetaboAnalyst平台中进行信号通路分析,得到代谢通路影响因子图(图5)。识别出可能的受生物扰动的代谢通路[28],对差异代谢物和通路进行相关性分析,总共检测到24条相关通路,其中气泡大小表示impact值的大小,气泡越大说明impact值越大;气泡的颜色深浅表示p值的大小,颜色越深表示-log(p)值越大。根据impact值和-log(p)值的综合分析,选出impact>0.2或-log(p)较大的通路[29],分别为谷胱甘肽代谢(glutathione metabolism),氮代谢(nitrogen metabolism),丙氨酸、天冬氨酸和谷氨酸代谢(alanine, aspartate and glutamate metabolism),氨酰基-tRNA生物合成(aminoacyl-tRNA biosynthesis),苯基丙氨酸代谢(phenylalanine metabolism),硫代谢(sulfur metabolism),甘氨酸、丝氨酸和苏氨酸代谢(glycine, serine and threonine metabolism),并在图中标出。
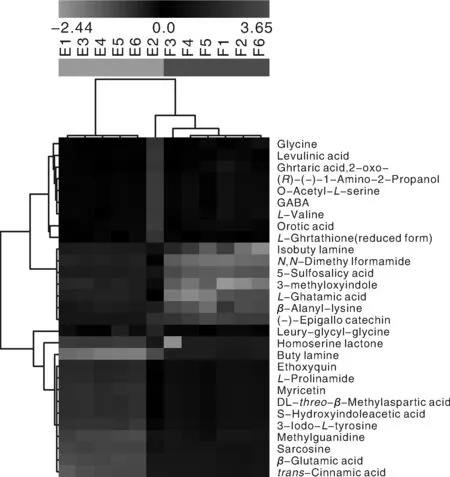
图4 差异代谢物的聚类热图Fig.4 Cluster heat map of differential metabolites
其中谷胱甘肽代谢通路最为显著,p值为0.004 119 9,-log(p)为5.491 9,impact值为0.505 08。主要有3个被检测到的差异代谢物富集于此代谢通路上,分别为甘氨酸(glycine)、谷胱甘肽(glutathione)、L-谷氨酸(L-glutamic acid)。谷胱甘肽具有抗氧化的功能,可以帮助植物清除自由基和过氧化物,维持植物体相对稳定的状态,可提高植物的抗逆能力,对植物抵御环境因素的变动有着重要作用[30]。而四川盐源的白色藜麦与青海都兰的白色藜麦相比,甘氨酸和谷胱甘肽表达上调,L-谷氨酸表达下调。其余的代谢途径有3条是氨基酸代谢途径,还有3条分别是氮代谢、硫代谢和氨酰基-tRNA生物合成,都与蛋白质的合成密切相关。且通路中涉及的大部分氨基酸和有机酸均为上调表达,说明白色藜麦主要是通过氨基酸和有机酸含量的增加以及相关通路的调节,尤其是谷胱甘肽代谢途径通过谷胱甘肽还原态和氧化态的循环来消除植物体内由于胁迫产生的氧自由基来保护植物组织和细胞,提高其对环境的适应性及其抗逆性。而四川盐源的白色藜麦与青海都兰的白色藜麦相比,大部分氨基酸和有机酸均显著增加,说明了四川盐源的白色藜麦有更好的抗逆性和适应性,白色藜麦更适于在四川盐源栽培种植。
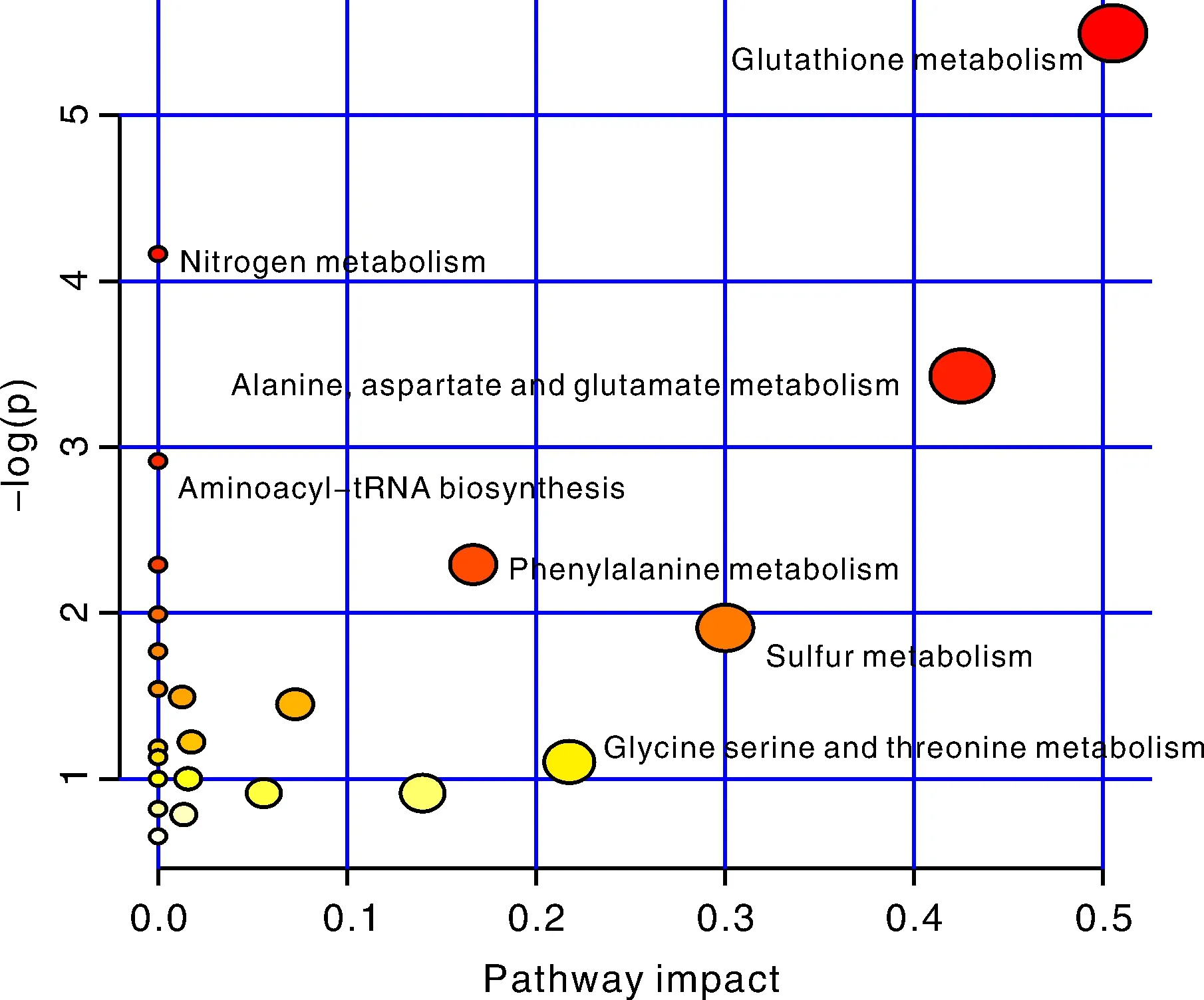
图5 代谢通路影响因子图Fig.5 Influence factors of metabolic pathway
3 结论与讨论
利用非靶向代谢组分析对四川盐源和青海都兰两地的白色藜麦种子进行分析后,总共筛选出29个显著差异代谢物质,其中有15个氨基酸(甘氨酸、L-缬氨酸、L-谷氨酸、谷胱甘肽、GABA等),6个有机酸(5-磺基水杨酸、乳清酸、肉桂酸等),还有一些糖醇、胺类、多酚和生物碱。其中有22个代谢物质是表达上调,7个代谢物质是表达下调。再根据主要的差异物质进行代谢通路的富集分析,得到相关通路24条,其中有7条通路较为显著,分别为谷胱甘肽代谢,氮代谢,丙氨酸、天冬氨酸和谷氨酸代谢,氨酰基-tRNA生物合成,苯基丙氨酸代谢,硫代谢,甘氨酸、丝氨酸和苏氨酸代谢。
谷胱甘肽代谢(glutathione metabolism)通路影响值最大,差异最为显著。谷胱甘肽作为生物体内最主要的非蛋白巯基和含量最丰富的低分子量多肽,具有很强的抗氧化性,在植物抗逆中直接和间接参与许多功能活动[31]。大量研究表明,氨基酸和有机酸含量的增加能提高植物的抗逆性[32]。刘建兵[33]研究发现,干旱胁迫下马尾松苗木的脯氨酸及游离氨基酸显著增加,使得苗木能在干旱环境下生长。高荣嵘等[34]研究发现,花生幼苗在受到盐胁迫后游离氨基酸的含量显著上升,提高了幼苗的抗盐性。包雨卓[35]采用GC-MS技术分析冬小麦在低温胁迫下的代谢物质变化,发现大部分糖类、氨基酸和有机酸显著增加,且随着温度降低而升高,说明冬小麦通过大部分糖类、氨基酸和有机酸的显著增加来抵御低温胁迫。本实验对比四川盐源和青海都兰的白色藜麦种子的差异代谢物质变化,发现参与谷胱甘肽代谢的代谢物质甘氨酸和谷胱甘肽均显著增加,还有大部分的氨基酸和有机酸也都显著增加。说明四川盐源的白色藜麦比青海都兰的白色藜麦有更多的抗氧化活性物质和渗透调节物质,能更快地清除环境胁迫所产生的氧自由基来保护植物组织和细胞,具有更强的抗逆性和适应性,这可能与四川盐源的地理气候有关。盐源县日温差较大,年均气温12.1 ℃,最高温度30.7 ℃,最低温度零下11.3 ℃。研究结果表明,四川盐源的白色藜麦更适合在这条件下生长,导致植株有更强的抗逆性和适应性,结果为后期进一步研究藜麦的生态适应性以及抗逆性奠定了理论基础。
