微塑料在海洋渔业水域中的污染现状及其生物效应研究进展*
2019-06-21杜雨珊赵信国陈碧鹃孙雪梅曲克明
夏 斌 杜雨珊 赵信国 朱 琳 陈碧鹃 孙雪梅 曲克明
(1.农业农村部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071; 2.青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 青岛 266071; 3.上海海洋大学海洋科学学院 上海 201306)
塑料制品由于轻便、可塑性强和耐用等特性而被广泛应用于航空、航天、军事、农业、工业以及日常生活等多个领域。据统计,全球塑料年产量已经从1950年的150万t激增至2017年的约3.48亿t,并且还在不断增加(Plastics Europe,2018)。随着塑料的大量生产和使用,这势必会导致每年有数量庞大的塑料垃圾进入海洋。据预测,到2025年,全球海洋中塑料垃圾量将高达 2.5 亿 t (Jambecket al,2015)。联合国环境规划署(UNEP)发布的报告指出,海洋塑料垃圾给全球海洋生态系统造成的经济损失超过 80亿美元,其中,仅水产品损失就达31亿美元(UNEP,2016)。2015年召开的第二届联合国环境大会上,海洋塑料污染被列入与全球气候变化、臭氧耗竭、海洋酸化并列的重大全球环境问题。
通常将尺寸小于5 mm的塑料碎片或颗粒定义为微塑料(Thompsonet al,2004)。海洋微塑料主要分为初生微塑料和次生微塑料。初生微塑料是指工业生产过程中被制备成粒径小于5 mm的塑料颗粒,如牙膏、洁面乳和空气清新剂中的塑料微粒等;次生微塑料是指大尺寸的塑料垃圾经过物理、化学和微生物作用分裂或降解而成的塑料微粒。微塑料因其持久性和高迁移性,已在全球海洋中普遍存在(Chaeet al,2017),被形象地称为“海洋中的PM2.5”。海洋中的微塑料既是海洋污染物,直接对海洋生物产生毒性效应(Barbozaet al,2015; Yinet al,2018; 陈启晴等,2018),也是有毒污染物和微生物的传播载体,间接影响海洋生物(Carberyet al,2018; 何蕾等,2018)。2018 年,《Science》报道,海洋微塑料吸附的有害物质能引起珊瑚礁疾病率的增加,使骨骼侵蚀带病(Skeletal eroding band disease)增加 24%,白化病上升 17%,黑带病上升5%(Lambet al,2018)。由此可见,微塑料已成为倍受国际关注的新型污染物(Gallowayet al,2016),其海洋环境效应已成为国内外的研究热点(Barbozaet al,2015)。
据联合国粮农组织(FAO)统计,2014年,渔业资源为全球 43亿人口提供了约 15%的优质蛋白(FAO,2014),作为人类获取优质蛋白的重要来源,至 2026年,全球渔业产量将达到1.94亿t。但迄今,已在全球 233种海洋生物体内发现了微塑料(Wilcoxet al,2015),表明海洋生物已经受到了微塑料的污染,不禁引发人们对水产品质量安全和人体健康的担忧。渔业水域是指适宜水产捕捞、水产增殖的水生经济动植物繁殖、生长、索饵和越冬洄游的水域总称。本文通过对国内外研究成果的归纳和总结,分析微塑料在海洋渔业水域的污染现状,阐述微塑料对海洋渔业生物的毒性效应及潜在的水产品质量安全风险,并对未来的研究前景进行展望,以期为准确评估微塑料对海洋渔业资源和水产品质量安全的影响提供科学依据。
1 海洋渔业水域中微塑料的主要来源
海洋渔业水域中微塑料的主要来源有:
(1) 陆源输入 陆地上的塑料袋、泡沫和纤维等塑料垃圾经过风力作用和雨水冲刷,通过地表径流进入海洋环境,引起海洋塑料污染。2017年《Nature Communications》期刊报道,全球每年有115~241万t塑料垃圾从河流进入海洋(Lebretonet al,2017)。陆源输入是海洋渔业水域微塑料的一个主要来源。
(2) 滨海旅游 在人口活动密集的海滩等海滨旅游景点,由于沙滩比热低、升温快、光氧化速度快,被游客随意丢弃的塑料包装袋、矿泉水瓶等塑料垃圾,易破碎形成微塑料进入到海洋环境中。
(3) 船舶运输 海上过往船舶向海洋丢弃大量的塑料垃圾也是微塑料的一个重要来源。据UNEP (2005)估算,2005年全球船舶运输过程中输入到海洋的塑料垃圾达到500万t。此外,海上航运事故也会导致大量塑料产品进入海洋。
(4) 渔业捕捞 在底栖挖泥和拖网作业的渔业捕捞活动中,渔绳和渔网会因磨损、截断而耗损,从而增加海洋渔业水域中微塑料的含量。另外,由于这些渔具的长期使用和维护力度不足,每年会有大量塑料渔具被遗弃在海洋中(Macfadyenet al,2009)。Lusher等(2013)发现,海洋生物体内摄入的塑料纤维与常用的渔具结构相似,从而证实生物体内的微塑料污染与当地的渔业生产活动有密切关联(Dantaset al,2012; Witteet al,2014; Mathalonet al,2014)。
(5) 养殖设施 近海网箱和筏式养殖过程中大量使用渔网、渔绳和浮球等塑料制品,其老化破损都会造成大量塑料碎片进入海洋。Mathalon等(2014)研究发现,与野生贻贝相比,人工养殖的贻贝体内塑料纤维的含量较高。
(6) 大气沉降 Dris等(2016)对大气沉降物质组成进行了分析,发现50%为天然纤维沉降物,21%为经过人工加工的天然纤维,17%为人造塑料纤维(主要为聚对苯二甲酸乙二醇酯),12%为人造混合纤维(聚对苯二甲酸乙二醇酯和聚氨酯的混合纤维以及棉和聚酰胺的混合纤维)。这表明大气沉降可能是海洋渔业水域中微塑料的来源。
2 海洋渔业水域中微塑料的分布特征
在风力和洋流作用下,海洋环境中的微塑料会进行远距离迁移,已广泛分布在河口、近海、远洋、极地和深海等全球各处海域。一般来说,风、表面流和地转环流可以促进大粒径的微塑料进行大范围扩散(Lawet al,2010)。在较小范围内,湍流和潮汐会导致沉积物中的微塑料再次悬浮(Ballentet al,2012,2013)。
?
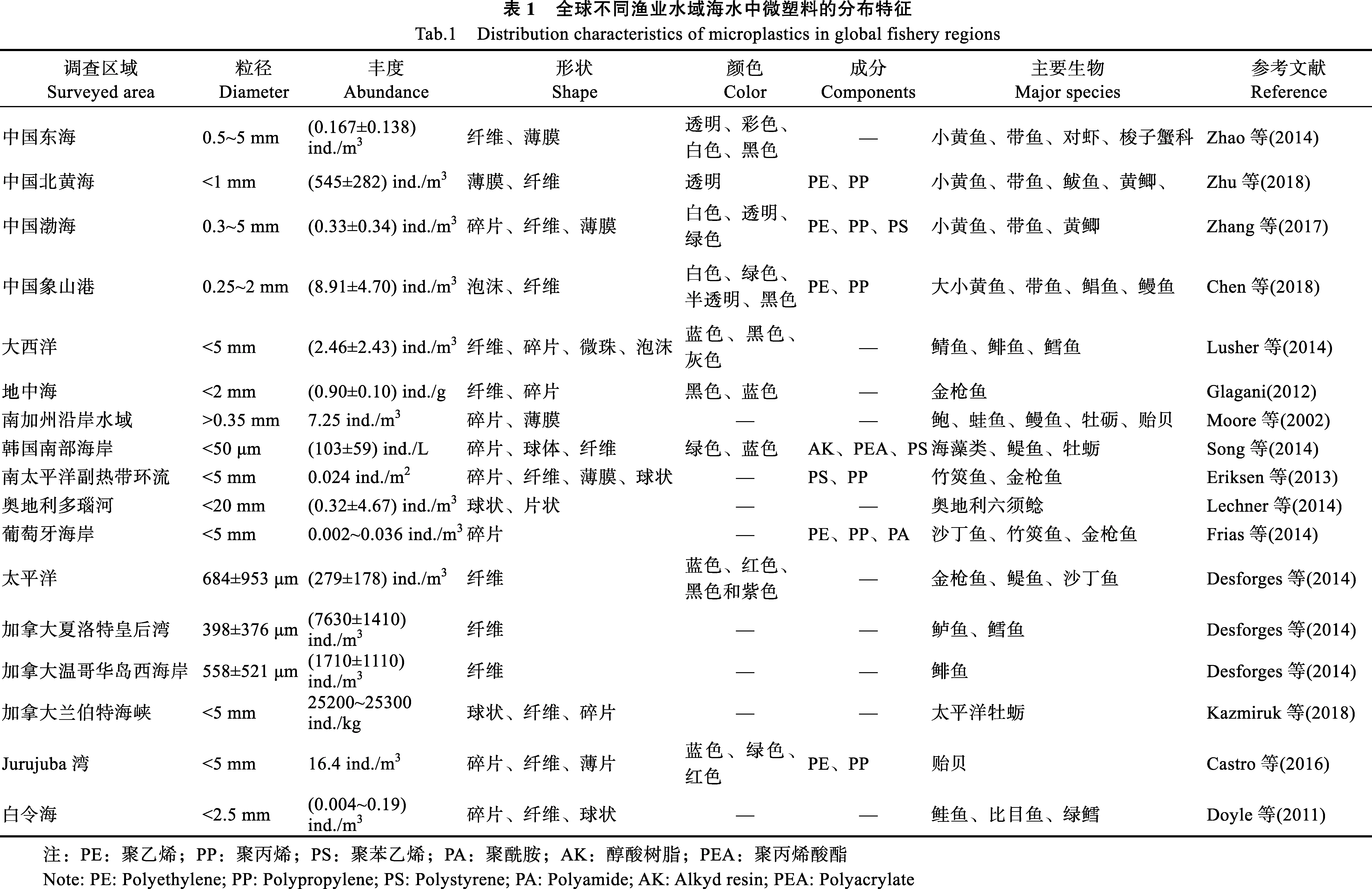
表1概括了不同渔业水域内微塑料的丰度、粒径、形状、颜色和成分:
(1) 从微塑料丰度分析,空间分布非常不均匀。韩国养殖水域微塑料含量较高,达到105ind./m3(Songet al,2014),而葡萄牙海岸海水微塑料含量仅为10-3ind./m3(Friaset al,2014)。
(2) 从微塑料的粒径分析,不同渔业水域微塑料的粒径差异较大。例如,在加拿大温哥华岛西海岸检测到的微塑料(558±521 μm)丰度为(1710±1110) ind./m3(Desforgeset al,2014)。在捕捞活动密集的渔业水域,如中国长江口和东海海岸,绝大多数的塑料颗粒以小粒径的形式存在,0.5~5 mm的微塑料占90%左右(Zhaoet al,2014),而我国象山港的微塑料粒径主要分布在 0.25~2 mm,平均粒径为(1.54±1.53) mm (Chenet al,2018)。
(3) 从微塑料的形状分析,主要为纤维状、碎片、薄膜和球状,其中,纤维状微塑料是渔业水域中最常见的微塑料,这主要是由于捕捞和养殖活动中渔绳和渔网的破损,导致纤维状微塑料所占比例较高。例如,加拿大夏洛特皇后湾水产养殖设施高度集中,当地纤维状微塑料的数量显著增加(Desforgeset al,2014)。在捕捞活动密集的东北大西洋和东北太平洋,纤维状塑料占了 70%以上(Lusheret al,2014; Desforgeset al,2014)。但在韩国南部海岸,微塑料主要以颗粒碎片的形式存在,特别是醇酸树脂类(船身常用的粘合剂涂料)的油漆颗粒(Songet al,2014)。由此可见,韩国南部海岸微塑料的主要来源不是渔业生产活动,而是船舶运输。
(4) 从微塑料的颜色分析,不同渔业水域微塑料的颜色组成差异很大,但大多以蓝色、白色、红色、黑色和透明为主,其中,东北大西洋中蓝色微塑料占37.7%,而该海域海洋生物体内摄入最多的微塑料也是蓝色纤维状(Lusheret al,2014)。
(5) 从微塑料的成分分析,主要以聚丙烯、聚乙烯、聚苯乙烯和聚酰胺等成分为主,是塑料制品中产量最高的一些种类。此外,这些成分的塑料也常用于养殖和捕捞活动中,如聚苯乙烯常用来制作水产养殖中的泡沫浮标,聚丙烯、聚乙烯和聚酰胺多用于制成捕捞用的渔绳、渔网和渔线。已有研究表明,我国象山港作为历史悠久的海水养殖区,检测到的微塑料成分多以聚苯乙烯为主,约占 38.6%(Chenet al,2018)。
综上所述,在海洋渔业水域中,微塑料丰度和粒径分布差异较大,形状以纤维状和颗粒碎片状为主,颜色主要为蓝色、白色、红色、黑色和透明色,主要成分为聚丙烯、聚乙烯和聚苯乙烯。
3 微塑料对海洋渔业生物的毒性效应
微塑料广泛分布于海洋渔业环境水域中,由于其粒径小,极易被渔业生物摄入(Mooreet al,2001),进而产生一系列毒性效应(表2),主要包括抑制生长发育、影响摄食及行为能力、生殖毒性、免疫毒性、遗传损伤等。
3.1 抑制生长发育
微塑料会抑制海洋渔业生物的生长发育。例如,沉积物中的聚苯乙烯微塑料(40~1300 μm)会显著抑制沙蚕(Arenicola marina)的生长,且抑制程度与微塑料的浓度呈正相关(Besselinget al,2013)。聚乙烯微塑料会抑制海胆(Tripneustes gratilla)的摄食与生长,但不会对海胆产生致死效应(Kaposiet al,2014)。微塑料被海洋渔业生物摄入体内后会在消化道中累积并阻塞消化道(Browneet al,2008; Wilcoxet al,2015),产生饱腹感,导致其摄食能力下降,体内能量储备减少(Wrightet al,2013),从而影响渔业生物的生长。Yin等(2018)研究发现,聚苯乙烯微塑料显著影响了许氏平鲉(Sebastes schlegelii)的能量储备,降低了生物体的营养品质。Bour等(2018)观察到暴露在较大塑料颗粒下(125~500 μm)的双壳贝类,发现其蛋白质和脂质含量未发生变化,但总的能量储备随着暴露微塑料的含量增加而降低。粒径为1~50 μm的聚乙烯微塑料会破坏紫贻贝(Mytilus galloprovincialis)的体内平衡,导致紫贻贝能量消耗增加和生长速率下降(Detreeet al,2018)。
3.2 影响摄食及行为能力
摄入微塑料会影响渔业生物的摄食和行为能力。研究表明,聚苯乙烯微塑料(1×106ind./L)会显著降低许氏平鲉(S.schlegelii)的摄食和游泳能力,缩小许氏平鲉的活动范围,增强许氏平鲉的集群行为(Yinet al,2018)。聚乙烯微塑料暴露后,虎鱼(Pomatoschistus microps)的游泳能力下降(Oliveiraet al,2013),捕食能力减弱(Ferreiraet al,2016),并且出现嗜睡的特征(Oliveiraet al,2013)。当沙蚕(A.marina)处于高浓度的微塑料暴露中,也会引发炎症反应,降低能量储备,并且导致其摄食活动受到抑制(Wrightet al,2013)。但也有研究发现,在微塑料和芘联合暴露下,尖吻鲈(Lates calcarifer)幼鱼的摄食能力没有受到显著影响,但游泳速度明显下降(Guvenet al,2018)。

?
3.3 生殖毒性
微塑料会危害海洋生物的生殖健康。在聚苯乙烯微塑料的暴露下,太平洋牡蛎(Crassostrea gigas)排出的卵细胞数量显著降低,精子的运动水平下降,表明微塑料会显著抑制太平洋牡蛎的繁殖能力(Sussarelluet al,2016)。目前,关于微塑料对渔业生物生殖毒性的研究还很少,只有一些对其他海洋生物的报道。例如,Ogonowski等(2016)研究表明,微塑料(105ind./ml)会导致大型溞(Daphnia magna)的死亡率升高,还会减弱大型溞的繁殖能力。Sussarellu等(2016)将太平洋牡蛎亲本暴露在聚苯乙烯微球中,显示微塑料影响牡蛎亲本的能量分配和生殖腺的成熟。Lee等(2013)研究发现,当聚苯乙烯微塑料(0.05 μm)浓度大于 12.5 μg/ml时,会导致日本虎斑猛水蚤(Tigriopus japonicus)下一代的死亡;而在 0.5 μm 聚苯乙烯微塑料暴露下,最高浓度组(25 μg/ml)同样会导致日本虎斑猛水蚤子代存活率显著下降。Jeong等(2017)研究发现,与0.5 μm和6 μm的聚苯乙烯微塑料相比,0.05 μm微粒可以穿过海洋桡足类的细胞膜,引起细胞损伤和氧化应激,最终导致桡足类生长速率下降和繁殖能力减弱。Cole等(2015)研究表明,20 μm聚苯乙烯微塑料长期暴露显著影响了海洋桡足类的能量储备和繁殖能力,不利于种群繁殖的稳定性。
3.4 免疫毒性
微塑料在进入海洋渔业生物组织和器官后,会引发一系列的免疫反应。例如,粒径为40~150 μm的聚氯乙烯(PVC)和聚乙烯(PE)微塑料会对海鲷(Sparus aurata)和海鲈(Dicentrarchus labrax)的白细胞产生氧化损伤,从而产生免疫毒性,并且 PVC的毒性要大于 PE (Espinosaet al,2018)。另外,有研究发现,粒径为3.0 μm和9.6 μm的微塑料会从紫贻贝(Mytilus edulis)的内脏转移到淋巴系统,但没有产生生物效应(Browneet al,2008),而粒径小于 80 μm 的高密度聚乙烯微塑料可进入贻贝的消化系统,导致贻贝血流粒细胞增多和溶酶体膜不稳定,从而引发机体免疫系统的炎症反应(von Mooset al,2012)。在聚乙烯微塑料(1.5×107ind./L)暴露下,会引起紫贻贝(M.galloprovincialis)氧化应激、免疫应答以及细胞凋亡(Detreeet al,2017)。Granby等(2018)研究表明,用微塑料和卤代污染物投喂海鲈,会增加鲈鱼对卤代污染物的富集量,肝脏代谢及基因表达异常,同时也引起氧化应激和免疫反应。还有研究将海胆(Paracentrotus lividus)暴露于氨基修饰聚苯乙烯纳米微塑料(10和25 μg/ml)中,引起吞噬细胞的溶酶体膜的不稳定和细胞凋亡,表明聚苯乙烯纳米微塑料对海胆产生免疫毒性(Marques-Santoset al,2018)。
3.5 遗传损伤
微塑料会对海洋渔业生物产生遗传损伤。研究显示,微塑料吸附多环芳烃后会对紫贻贝(M.galloprovincialis)产生免疫毒性、神经毒性以及基因毒性,这会造成贻贝的遗传损伤(Avioet al,2015a)。但是,目前有关微塑料对海洋渔业生物遗传毒性的研究还很少,只有一些对其他海洋生物的报道。Besseling等(2014)研究表明,大型溞(D.magna)体型的缩小与纳米聚苯乙烯塑料颗粒的暴露有关,导致其子代数量减少以及畸形率上升。
4 微塑料对海洋渔业生物的致毒机制
微塑料对海洋渔业生物产生毒性效应的致毒机制主要包括摄入微塑料对渔业生物的影响、微塑料与其他污染物的复合效应,以及微塑料作为微生物、附生动植物载体产生的影响。
4.1 摄入微塑料对渔业生物的影响
微塑料广泛存在于海洋环境中,由于其粒径较小,易被渔业生物误食。Browne等(2008)使用带荧光标记的聚苯乙烯微塑料球混合微藻投喂紫贻贝(M.edulis),随后在贻贝肠道和循环系统中均发现了微塑料颗粒,这表明贻贝能够直接从环境中摄入微塑料。在近海的渔业生物体中也发现了微塑料。Jabeen等(2017)在长江口、东海以及南海收集了21种海水鱼,检测发现,所有海水鱼的胃肠道中均含有微塑料,其中纤维状是最常见的形状。Ory等(2017)在中国沿岸17个站点采集了养殖牡蛎,检测发现 84%的牡蛎中含有微塑料。微塑料被渔业生物摄食后,可经由胃肠道转移至其他组织或器官中,从而对渔业生物产生物理性损害。von Moos等(2012)将紫贻贝(M.edulis)暴露于聚乙烯微塑料中,观察紫贻贝消化腺部位的内吞情况,发现聚乙烯微塑料较易被紫贻贝消化腺的上皮细胞所摄取,且在细胞、组织结构上对贝类生物体造成较大损伤。Avio等(2015b)发现聚乙烯、聚苯乙烯微塑料(粒径0.2~0.6 mm)由鱼类胃肠道转移至肝脏中。
微塑料的粒径、表面电荷等性质是影响其被生物富集的重要因素(Lusheret al,2017)。一般而言,粒径越小,进入生物体后更容易被吸收。已有研究证实,50~100 nm的聚苯乙烯塑料微球比 300~3000 nm的微球更容易被派尔集合淋巴结和肠道绒毛吸收(Janiet al,1992; Florenceet al,2001)。但是,渔业生物对摄取食物的粒径也有一定的选择性。研究发现,相比于2 μm的微塑料,太平洋牡蛎更倾向摄食6 μm的聚苯乙烯微球(Sussarelluet al,2016)。所以在研究微塑料的毒性效应及致毒机制时,应考虑把渔业生物的摄食习性纳入研究的范畴(Mizrajiet al,2017)。
4.2 微塑料与其他污染物的复合效应
在海洋环境中,微塑料比表面积大,且具有高疏水性,易吸附不同类型的环境污染物(如多氯联苯、多环芳烃、氯化农药以及重金属等)。微塑料被海洋渔业生物摄食后,在一定条件下会释放出吸附的污染物。有研究表明,在生物体肠道环境中微塑料对污染物的解吸速率比在海水中高出 30多倍(Bakiret al,2014),从而对渔业生物产生更强的毒性效应(徐擎擎等,2018)。Avio等(2015a)研究发现,聚乙烯微塑料与多环芳烃的复合污染导致紫贻贝(M.galloprovincialis)对多环芳烃的吸收利用率明显提高。Barboza等(2018)发现塑料微球改变了汞在鲈鱼((D.labrax)脑部和肌肉中的富集量。Rochman等(2013)的研究表明,当鱼类摄入吸附了有机污染物的聚乙烯微粒之后,微塑料会在鱼体内累积并产生胁迫作用,还会影响多环芳烃受体(AhR)基因的表达。另一项研究发现,与仅暴露于荧蒽的贻贝(Mytilusspp.)相比,在同时暴露于微塑料和荧蒽的贻贝中检测到更高的荧蒽浓度,且贻贝的组织病理学损伤更加显著,这说明微塑料结合其他污染物后具有明显的复合毒性(Paul-Pontet al,2016)。Rochman等(2014)研究发现,日本青鳉(Oryzias latipes)摄食表面吸附有多氯联苯、多环芳烃和多溴二苯醚等污染物的微塑料后,鱼体内雌激素受体(ERα)、卵黄蛋白原(Vtg I)、卵壳前体蛋白(Chg H)的基因表达水平发生改变,表明微塑料与上述有机污染物的复合污染影响了日本青鳉的内分泌系统功能。微塑料除了与吸附污染物产生复合毒性外,其自身携带的化学添加剂在海洋环境中浸出后也会对渔业生物产生毒性。这些添加剂包括增塑剂、阻燃剂、塑化剂和双酚 A等有毒物质。以双酚 A为例,作为聚乙烯、聚丙烯和聚氯乙烯等塑料聚合物的添加剂,能引起内分泌失调,并具有一定的胚胎毒性和致畸性。此外,新陈代谢紊乱导致的肥胖和乳腺癌也被认为与双酚A有关(韩林等,2016)。
目前研究表明,微塑料本身的毒性是相对较小的,环境浓度下的微塑料基本不会对海洋生物产生毒性效应,但微塑料在吸附环境污染物后,会显著增强吸附污染物的毒性效应。例如,纳米级微塑料增强了四溴联苯醚和三氯生对海洋轮虫(Brachionus koreanus)的毒性效应(Jeongetal,2018),因此,微塑料与其他污染物对海洋渔业生物的复合效应须引起高度重视。海洋环境中微塑料与污染物的复合效应对海洋生物的毒性作用更加复杂,需要全面了解微塑料对污染物的吸附、解吸、释放和运输过程,相关的致毒机制及影响因素亟待进一步研究,以便更加准确地评价微塑料的渔业环境效应。
4.3 微塑料作为微生物、附生动植物的载体作用
微塑料在进入海洋环境后,容易吸附排泄物、有机物和无机营养盐,进而吸引微生物和浮游动植物附着其表面上。在北太平洋环流区的一项研究表明,微塑料表面聚集的微生物主要包括芽孢杆菌、球状菌和羽状硅藻等(Carsonet al,2013)。同时,Oberbeckmann等(2014)发现,收集自英国北海的塑料颗粒表面附着了拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和蓝细菌门(Cyanobacteria)的细菌。Jiang等(2018)采用高通量测序技术对中国长江口潮间带微塑料样品上的细菌群落进行分析,发现主要细菌为 α-变形菌(Alphaproteobacteria)、γ-变形菌(Gammaproteobacteria)、黄杆菌纲(Flavobacteriia)、酸杆菌门(Acidobacteria)以及蓝细菌门(Cyanobacteria)。还有研究在北海、波罗的海和北大西洋的微塑料表面检测出致病弧菌(Vibriospp.) (Zettleret al,2013; Kirsteinet al,2016)。随着微塑料的不断迁移,可能促使附着在其表面的致病菌迅速扩散,导致大面积感染事件,甚至危害人体健康。另外,微塑料也能够为浮游生物提供稳定的栖息生境,使其获得丰富的营养,进而吸引较低营养级渔业生物对微塑料的摄食,同时可能会加剧摄食后引起的毒性效应。相关研究发现,在地中海西北部海岸的微塑料上,附着了底栖硅藻、小型甲藻以及有害甲藻(Masóet al,2003)。一旦这些微塑料迁移到适宜有害甲藻生长的海域,可能会急剧繁殖扩散,释放大量毒素,影响水产品质量安全,最终对人类健康产生潜在危害。
虽然微塑料对微生物和浮游动植物的载体作用,至今尚未开展系统深入的研究,很多结论未能获得有效的数据支持,但微塑料表面黏附的致病菌和有毒藻类,随着微塑料的迁移,很可能引发海洋生态灾难,其潜在影响应引起高度重视。今后应加强对海洋微塑料附着生物种类和丰度的研究,并积极探讨可能带来的环境风险和生态效应。
5 微塑料在食物链中的传递作用
由于尺寸小、难降解,微塑料易被海洋生物摄入,并且蓄积在体内。目前,已在原生生物、桡足类、环节动物、棘皮动物、刺细胞动物、端足类、十足类、等足类、软体动物和鱼类等大量海洋生物体内发现了微塑料(Christakiet al,1998; Thompsonet al,2004; Besselinget al,2013; Coleet al,2013; Tanakaet al,2013; Ugoliniet al,2013; Hameret al,2014; Kaposiet al,2014; Wattset al,2014; Avioet al,2015b; Hallet al,2015; Nobreet al,2015; Pedaet al,2016)。更令人担忧的是,微塑料还会沿着食物链,从低营养级生物传递至高营养级生物(图1)。据Farrell等(2013)报道,用体内蓄积有0.5 μm聚苯乙烯塑料微球的紫贻贝饲喂 青蟹(Carcinus maenas)后,微塑料颗粒随之出现在青蟹的胃、肝脏和血淋巴等组织器官中,并检测到血淋巴中的微塑料含量最高。Cedervall等(2012)发现,聚苯乙烯纳米颗粒会沿着栅藻(Scenedesmussp.)-大型溞(Daphnia magna)-鲫鱼(Carassius carassius)三级食物链传递,最终蓄积在鲫鱼体内。与对照组相比,通过食物链富集微塑料后,鲫鱼的群集行为、生理状态和脂质代谢强度均发生显著改变(Mattssonet al,2015)。但也有研究发现,微塑料可以从丰年虾传递至斑马鱼体内,但并没有在斑马鱼体内蓄积,可能是由于微塑料以粪便的形式被斑马鱼排出体外(Batelet al,2016)。此外,在食物链传递过程中,微塑料携带的有毒污染物以及病原微生物可能会一同转移至高营养级生物,并在高营养级生物体内扩散,最终危害海洋生态系统乃至人类健康。

图1 海洋中微塑料的环境行为及其在海洋食物网中的传递(修改自刘强等,2017)Fig.1 Environmental behavior of microplastics in the ocean and their transfer in marine food web (revised from Liu et al,2017)
6 微塑料对水产品质量安全的潜在影响
水产品是人类获取优质蛋白的重要来源。目前,微塑料在鱼类、贝类、虾类和蟹类等渔业生物体内均 有检出(Kaposiet al,2014; van Cauwenbergheet al,2014; Liboironet al,2016),表明渔业生物已经受到微塑料的污染,引起人们对水产品质量安全的关注。微塑料对水产品质量安全的潜在影响主要包括三个方面:
(1) 微塑料本身对水产品质量安全的影响。目前,食用贻贝、牡蛎等贝类体内均有大量微塑料存在(Liet al,2018; Renziet al,2018),是人类从海产品中摄入微塑料的主要来源。与食用鱼类不同,人类食用贝类时通常不会去除内脏,这种饮食习惯会大大增加人类对微塑料的摄入量(Wallaceet al,2016)。据估算,人类每食用225 g贻贝组织,同时会摄入约900个微塑料(Liet al,2015),每人每年因食用贝类而摄入微塑料的数量可达 11000 个(van Cauwenbergheet al,2014),进而推测食用被微塑料污染的海产品可能会危害人体健康。但与日常生活中进入体内的微塑料数量相比,通过食用贻贝摄入微塑料的数量相对较少(Catarinoet al,2018)。
(2) 微塑料释放添加剂及携带有毒污染物的风险。已有研究发现,微塑料中污染物的暴露剂量很小,通过饮食摄入微塑料而接触的PAHs占0.02%~0.1%,PCBs占0.007%~0.03%,DDT占0.0000002%~0.004%,而添加剂的暴露剂量更少,BPA占 0.000005%~ 0.00002%,PBDEs占 0.0007%~0.003% (Lusheret al,2017),这表明微塑料释放添加剂及携带有毒污染物对水产品质量安全影响的风险较小。
(3) 微塑料携带病原微生物的风险。被微塑料污染的水产品,可能会携带病原生物(如海洋弧菌等),当处理和食用这些水产品时,就可能会引起人体感染发病。目前尚无相关研究报道证实这一推测,但仍然需要引起人们对水产品质量安全的高度重视。
7 结语与展望
微塑料作为一种新型的海洋污染物,受到国内外的高度关注。当前研究表明,微塑料被海洋渔业生物摄入后,会抑制其生长发育、摄食及行为能力,并引起生殖毒性、免疫毒性、遗传损伤等毒性效应。此外,微塑料沿着海洋食物链传递,可能会增加其在高营养级生物体内的富集量,产生生物放大作用,最终影响海洋生态系统结构和功能的稳定。尽管已经开展了相关实验予以佐证,但目前所获得的实验数据还未能有力证实微塑料会对人类健康产生负面影响。从研究现状来看,未来还存在诸多问题需要解决:
(1) 海洋渔业水域微塑料的源解析。采集常见的生活或者工业塑料样品,分析其密度、化学添加剂和成分等稳定的关键性参数;构建不同生产、使用和排放途径的塑料指纹信息库;通过比对海水样品与可能来源的塑料样品化学特征库,最后结合多元统计和贝叶斯分析方法,识别不同海洋渔业水域中微塑料污染的主要来源,为我国海洋渔业水域微塑料污染的监管提供技术支持。
(2) 微塑料的复合毒性效应和载体作用研究。微塑料与环境污染物的复合毒性可能已经超过微塑料自身的物理损伤,需要加强微塑料对环境污染物吸附/解吸过程的研究,揭示其联合致毒机制。此外,微塑料作为病原微生物的载体传播病害,其对海洋渔业资源的潜在风险尚未进行深入研究,今后应推进相关实验的开展。
(3) 微塑料的海洋生态风险评估。目前,在有关微塑料毒性效应的研究中,多采用微塑料标准品为研究对象,且实验中的暴露剂量远高于环境浓度,还存在暴露时间短、无法满足长期暴露研究需求的局限,这些不足导致了目前的研究工作并不能真实、准确、客观地评价现实环境中微塑料的生态风险,因此,应当加强环境特征微塑料在环境浓度下对海洋生物长期暴露的毒性效应研究。
