饱和氢气生理盐水对盲肠结扎穿孔大鼠肺损伤的干预作用*
2019-06-20周晓红付洪义范亚敏黄新莉
翟 羽,周晓红,刘 会,付洪义,范亚敏,黄新莉Δ
(1.河北中医学院基础医学院,石家庄 050200;2.河北省胸科医院呼吸内科,石家庄 050048;3.河北医科大学病理生理教研室,石家庄 050017)
内毒素导致的肺损伤是临床常见的并以肺泡—毛细血管膜通透性增加为主要特征的肺部炎症综合征,发病急且凶险,甚至可以引起急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)和多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)等严重后果[1]。尽管目前对其认识和治疗措施有很大进展,但迄今临床上对急性肺损伤(acute lung injury,ALI)尚未有切实有效的防治措施,其死亡率虽有所降低,但发病并未减少。因此,深入探讨其发病机制及防治肺损伤的发生是呼吸科及重症医学乃至整个医学界共同关注并亟待解决的重大课题。
新近,继一氧化氮(NO)、一氧化碳(CO)和硫化氢(H2S)等之后,氢气的生物学效应已引起医学界的关注。人体肠道内的部分细菌可通过发酵未消化的食物产生氢气[2],最近有研究提出氢气可能是人体中与其他气体信号分子(如NO、CO、H2S)作用类似的第四种气体信号分子[3,4]。近年来研究证实,氢气具有丰富的生物学效应,包括选择性抗氧化应激[5]、抗炎[6]、抗凋亡[7]、抗血管增生[8]等作用,对多种疾病具有显著的治疗效果,进而使肺损伤的研究进入了新的阶段。最近本课题组研究证实腹腔注射饱和氢气生理盐水可改善盲肠结扎穿孔(cecal ligation and puncture,CLP)所致的大鼠内毒素性肺损伤[9],但其作用的靶点及具体的作用机制仍值得深入研究。
以往的研究证实,在小鼠盲肠结扎穿孔引起的休克模型中,H2S产生增多并加重休克的程度和此时组织的损伤[10]。有文献报道,H2S产生增多可加重胰腺炎的程度及此时的肺损伤[11]。Collin[12]和Li[13]认为内毒素血症时H2S的增多可致组织损伤,使用CSE抑制剂可改善内毒素休克时的组织损伤。本室以往的研究发现,在通过小剂量LPS气管内滴注复制出的急性肺损伤大鼠模型上,LPS引起的内源性H2S减少与肺损伤的发生密切相关[14,15]。而在大剂量LPS静脉注射复制出的内毒素休克大鼠模型上,LPS刺激引起的大量H2S的产生后导致的过度炎症反应参与了此时肺损伤的发生[16]。上述研究提示饱和氢气生理盐水可能通过干预H2S的产生过程,从而调节改善盲肠结扎穿孔大鼠的肺组织损伤。本实验通过复制CLP大鼠肺损伤和H2S供体硫氢化钠(NaHS)致肺损伤模型,观察H2S在饱和氢气生理盐水改善CLP大鼠肺损伤中的作用。
1 材料与方法
1.1 药物与试剂
NaHS(H2S 供体)、L- 半胱氨酸、5’- 磷酸吡哆醛和 N,N- 二甲基-对苯二胺硫酸盐均购自美国Sigma 公司;大鼠TNF-α、IL-6、IL-10 ELISA检测试剂盒均为法国Diaclone公司产品;RNA酶抑制剂(RNasin)、随机引物、CSE及GAPDH引物由北京赛百盛生物公司合成;dNTP为北京鼎国生物公司产品;丙二醛(malondialdehyde,MDA)、髓过氧化物酶(myeloperoxidase,MPO)活性测定试剂盒购自南京建成生物工程研究所。
1.2 饱和氢气生理盐水的制备
参考孙学军教授[17]的方法,室温下0.4 MPa 压力下将纯氢气在无菌生理盐水中加压 6 h,达到饱和状态。装于铝袋中在常压 4℃ 保存并于 24 h 内使用。每次使用前气相色谱分析仪检测氢气浓度,>0.6 mmol/L方可使用。
1.3 动物模型的复制与分组
本实验采用健康雄性SD大鼠,体重(250±19)g。复制大鼠CLP肺损伤模型,将大鼠用25%乌拉坦溶液麻醉(4 ml/kg,ip)仰卧位固定于手术台上,行下腹正中切口,轻轻牵出盲肠结扎根部,保持回肠-结肠通畅,在与肠系膜相对的盲肠壁浆膜面用18号针头穿刺2个孔,2个孔相距约1 cm,然后将盲肠送回腹腔,逐层关腹。24只大鼠随机分成4组(每组6只):(1)假手术对照组(Sham组)+生理盐水组:盲肠根部穿过丝线,不行结扎和穿孔,手术前10 min腹腔注射生理盐水(10 mg/kg);(2)CLP组+生理盐水组:复制CLP模型,手术前10 min腹腔注射生理盐水(10 mg/kg);(3)Sham+H2组:手术前10 min腹腔注射饱和氢气生理盐水(10 mg/kg);(4)CLP+ H2组:腹腔注射饱和氢气生理盐水(10 mg/kg)。各组于手术后8 h留取肺组织,采用生物化学和RT-PCR的方法,分别检测大鼠肺组织中CSE/H2S体系的变化。
另取32只大鼠,随机分为4组(每组8只):(1)生理盐水组:腹腔注射生理盐水(10 mg/kg);(2)H2S组:腹腔注射H2S供体NaHS(56 μmol/kg),以模拟CLP大鼠肺组织中H2S增多时的状态;(3)H2S+ H2组:腹腔注射NaHS前10 min注射饱和氢气生理盐水(10 mg/kg);(4)H2组:腹腔注射生理盐水前10 min注射饱和氢气生理盐水(10 mg/kg)。各组于给药后8 h进行观察。通过测定肺系数,检测肺组织中MDA含量、MPO活性及细胞因子TNF-α、IL-6和IL-10含量,并观察肺组织形态学变化。
1.4 肺组织中H2S含量检测
参照文献[18],用全自动酶标仪在波长670 nm测定吸光度,根据H2S标准曲线计算溶液中的H2S含量,H2S含量以单位重量的肺组织中H2S的量(nmol/g)表示。
1.5 肺组织中胱硫醚-γ-裂解酶(CSE)活性检测
参照文献[18]报道的方法,用全自动酶标仪在波长670 nm测定吸光度,根据H2S标准曲线计算溶液中H2S浓度,组织中CSE活性以单位重量的肺组织在单位时间内生成H2S的量(nmol·g-1·h-1)表示。
1.6 肺组织中CSE mRNA表达的检测
肺组织总RNA 提取操作按照Trizol试剂说明书进行。琼脂糖凝胶电泳观察28S和18S条带,测260/280吸光度值并定量后于-80℃ 保存。CSE mRNA 水平以GAPDH为内参照,根据逆转录试剂盒步骤逆转录合成cDNA 第一条链。聚合酶链反应体系如下:10 × PCR 缓冲液5 μl,MgCl2(25 mmol/L)3 μl,dNTPs(10 mmol/L)1 μl,上游引物(50 pmol/L)1 μl,下游引物(50 pmol/L)1 μl,模板DNA 1 μg,DNA 聚合酶(5 U/μl)0.5 μl,灭菌双蒸水补至50 μl。反应条件:94℃预变性2 min,随后以94℃变性1 min,50℃退火1 min,72℃延伸1 min,循环30次,最后72℃延伸5 min。CSE引物序列上游为:5′- TCC GGA TGG AGA AAC ACT TC -3′,下游为5′- GCT GCC TTT AAA GCT TGA CC -3′,扩增片段大小为400 bp;GAPDH引物序列上游为5′- CCA TGA CAA CTT TGG CAT C-3′,下游为5′- ATG TCA GAT CCA CAA CGG A -3′,扩增片段大小为262 bp。每份样品的PCR 均重复4次。以灭菌双蒸水代替cDNA作为阴性对照。PCR 产物以2% 琼脂糖凝胶电泳分离和溴化乙锭染色后,凝胶成像照相。用Bandscan 5.0凝胶图像处理软件进行灰度分析,以CSE与GAPDH的扩增产物条带灰度值之比作为反映CSE的 mRNA相对表达量。
1.7 肺组织中MDA含量的检测
采用硫代巴比妥酸比色法,应用MDA检测试剂盒检测各组肺组织匀浆中MDA含量,结果以nmol/(mg·prot)表示。按照试剂盒说明书进行操作。肺组织匀浆蛋白定量采用考马斯亮蓝法。
1.8 肺组织MPO活性测定
应用MPO检测试剂盒检测各组肺组织匀浆中MPO活性,以反映肺组织中中性粒细胞的数目。
1.9 肺组织中TNF-α、IL-6和IL-10含量的检测
采用ELISA法检测肺组织中促炎性细胞因子TNF-α、IL-6和抗炎性细胞因子IL-10的含量。
1.10 肺系数测定
将大鼠经颈动脉插管放血处死,死后迅速开胸联合摘取心肺,去除心脏并仔细分离掉肺脏周围脂肪组织,自气管分叉以上5、6软骨环间剪断气管,用滤纸吸干肺表面血液后称重。肺系数=肺质量(g)/体质量(100 g)。
1.11 肺组织形态学观察
自左肺叶下部取0.5 cm×0.5 cm×0.5 cm左右的肺组织,用10%中性甲醛固定,常规石蜡包埋、切片、HE染色。光镜下观察肺组织形态、结构变化。每组选取6张玻片,每张玻片连续观察10个视野(×200),计算损伤肺泡(肺泡内含有红细胞或/和中性粒细胞2个以上)数占计数肺泡总数百分比,即肺泡损伤数比值,作为肺损伤的组织学定量评价指标(index of quantitative assessment,IQA)
1.12 统计学处理
2 结果
2.1 饱和氢气生理盐水对CLP大鼠肺组织中CSE/H2S体系的影响
结果(表1)显示,CLP术后8 h后,肺组织中H2S含量较Sham组明显增高(P<0.05),与CLP组相比,CLP+ H2组肺组织中H2S含量明显减少降低(P<0.05)。Sham组与H2组相比没有明显差异(P>0.05)。
为了进一步证实H2对CLP大鼠肺组织中CSE/H2S体系的影响,采用生物化学方法检测肺组织中H2S生成的关键酶CSE的活性和mRNA表达情况,结果显示,CLP组CSE活性(表1)和mRNA表达(图1)均较Sham组增高(P均<0.05)。与CLP组相比,H2预处理可抑制肺组织中CSE活性和mRNA表达(P均<0.05),Sham组与H2组相比没有明显差异(P均>0.05,表1,图1)。

Tab. 1 Effects of hydrogen-rich saline on the CSE/H2S system in lungs of rats after sham or cecal ligation and puncture(CLP)operation n=6)
*P<0.05vssham group;#P<0.05vsCLP group


2.2 饱和氢气生理盐水对NaHS诱导的肺组织损伤的影响
为了进一步证实CSE/H2S体系在H2对CLP大鼠肺组织损伤的影响,采用H2S供体硫氢化钠(NaHS)诱导的肺组织损伤动物模型,观察氢饱和生理盐水是否可改善H2S所致的肺组织损伤。结果显示,与control组相比,NaHS组大鼠肺系数明显增大(表2,P<0.05),肺组织MDA含量和MPO活性显著增加(表2,P均<0.05);大鼠肺间质和肺泡中出现PMN的浸润,肺间隔增厚等形态学改变(图2),同时IQA增大(表2,P<0.05)。与NaHS组相比,NaHS+H2组大鼠肺系数明显减小(表2,P<0.05),肺组织MDA含量和MPO活性下降(表2,P均<0.05);大鼠肺间质和肺泡中PMN的浸润程度明显减轻,肺组织形态及IQA接近正常(图2,表2,P<0.05)。H2组与control组相比上述各项指标均没有明显差异(P均>0.05,表2,图2)。

Tab. 2 Effects of hydrogen-rich saline on lung injury induced by NaHS n=8)
MDA:Malondialdehyde;MPO:Myeloperoxidase;IQA:Index of quantitative assessment
*P<0.05vscontrol group;#P<0.05vsNaHS group

Fig.2Hydrogen-rich saline attenuated lung injury induced by NaHS(HE ×200,n=3)
2.3 饱和氢气生理盐水对NaHS诱导的肺组织炎症反应的影响
结果显示,control组及H2组大鼠肺组织中IL-10的含量均低于检测的下限。与control组大鼠相比,NaHS组大鼠肺组织中TNF-α、IL-6和IL-10含量均升高(表3,P均<0.05)。与NaHS组大鼠相比,NaHS+H2组大鼠肺组织中TNF-α和IL-6含量下降而IL-10含量升高(P均<0.05)。H2组与control组相比上述各项指标均没有明显差异(P均>0.05,表3)。
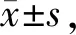
Tab. 3 Effects of hydrogen-rich saline on TNF-α,IL-6 and IL-10 levels in the lung tissue of rats with lung injury induced by NaHS(ng/L, n=8)
*P<0.05vscontrol group;#P<0.05vsNaHS group
3 讨论
脓毒症是临床常见的危重症之一,是由严重感染引起的不可控制的全身炎性反应综合征(systemic inflammatory response syndrome,SIRS),可迅速发展为脓毒性休克和多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。肺因其解剖、组织学特点而成为SIRS损伤的首位靶器官,主要表现为急性肺损伤(ALI),其最严重的阶段为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)。对于内毒素肺损伤的认识已有40余年,已明确内毒素导致的肺损伤不仅可由感染性疾病引起,而且诸如严重创伤和烧伤、休克、缺血/再灌注损伤和急性胰腺炎等凡可引起肠道屏障功能受损导致内毒素入血的多种情况均可诱发肺损伤的发生。本研究仍然采用经典CLP法建立大鼠肺损伤模型,该模型模拟了临床腹膜炎患者肺损伤发病的病程,更贴近临床实际。
迄今为止,已报道了氢气对多种疾病的治疗作用,为氢气医学的建立打下了坚实基础。目前,围绕氢气进行医学研究已经成为一个绝对的国际研究热点。近年来研究证实,氢气具有丰富的生物学效应。已有实验证明吸入2%的氢气或给予氢饱和生理盐水可减轻脂多糖及缺血/再灌注诱导的肺损伤[19,20]而且吸入给氢法在气体混合过程中存在一定风险,且操作复杂,对设备要求也比较高,限制了该方法的应用。2009年孙学军等在国际上首次报道腹腔注射氢饱和生理盐水(0.8 mmol/L)的给药方法[17],并在缺血/再灌注损伤、阿尔茨海默病、一氧化碳中毒迟发性脑病、动脉粥样硬化等多种动物模型上取得了成功[21-24]。本研究室最近对氢治疗肺损伤的研究,初步证实腹腔注射氢饱和生理盐水可改善CLP所致的大鼠内毒素性肺损伤,明显减轻肺组织水肿及白细胞浸润等炎性病理损伤,抑制内毒素刺激引起的促炎细胞因子(TNF-α、IL-1β、IL-6)表达,降低动物死亡率[9]。关于其作用的靶点及具体的作用机制仍值得深入研究。因此本实验在前期研究的基础上,进一步探讨饱和氢气生理盐水改善CLP大鼠肺损伤中作用是否与H2S有关。
本实验结果发现,与Sham组相比,CLP大鼠肺组织中H2S的含量明显增多,肺组织中CSE活性增强,CSE mRNA表达上调。氢饱和生理盐水可抑制CSE/H2S体系,表现为其可抑制CLP大鼠肺组织中CSE mRNA表达及活性,减少大鼠肺组织中H2S的含量。结合以往的实验结果[9],提示CSE/H2S体系上调可能参与CLP大鼠肺损伤的发生,氢饱和生理盐水改善此种肺损伤的发生可能与其抑制CSE/H2S体系有关。为了进一步证实上述推断,本实验采用外源性给予H2S供体NaHS的方法,以模拟CLP大鼠肺组织中H2S增多时的状态。预实验时,选用14,28,56 μmol/kg三个不同的剂量,结果发现,腹腔注射56 μmol/kg的NaHS后大鼠肺组织中H2S含量增高的程度与CLP大鼠相比无明显差异(该数据未在本文列出),同时可引起明显的肺组织损伤。具体表现为大鼠肺系数明显增加,肺组织MDA含量和MPO活性增高,肺泡腔及肺间质弥漫性炎细胞浸润,肺泡间隔增宽,部分区域肺泡隔断裂,肺泡萎陷、甚至结构消失,部分肺泡代偿性气肿,IQA增高。氢饱和生理盐水预处理可明显减轻NaHS所致的上述肺组织损伤。
体内H2S是由多种酶催化分解含硫氨基酸如甲硫氨酸、L-半胱氨酸和同型半胱氨酸的过程中产生的,主要的酶有胱硫醚-β-合成酶(cystathionine β-synthase,CBS)和胱硫醚-γ-裂解酶(cystathionine γ-lyase,CSE),其中肺组织中以CSE的为主[25]。虽然H2S被认为是第三种内源性气体信号分子已有十余年的时间,但目前关于H2S对脓毒症相关肺损伤的影响尚存在争议。如有文献报道,H2S具有减轻脓毒症相关肺损伤的作用[26-28]。但也有文献认为,H2S参与脓毒症相关肺损伤的发生[29-31]。本实验条件下得到的结果与后一种观点相一致。以往的研究和本实验结果提示H2S在不同的动物模型或不同的病理情况下,其在体内的生成量不同,它所发挥的作用可能也不同,但确切原因尚需进一步证实。氢气具有丰富的生物学效应,本实验中初步探讨氢饱和生理盐水改善NaHS所致的肺损伤的机制,结果发现,氢饱和生理盐水预处理可使NaHS导致的肺损伤过程中促炎因子(TNF-α、IL-6)的生成减少,而使抗炎因子(IL-10)的生成增多。结果提示,氢饱和生理盐水的保护作用与其可调节NaHS所致的肺部炎症反应有关。
综上所述,本实验结果表明氢饱和生理盐水抑制CLP大鼠肺组织中CSE/H2S体系,从而减轻NaHS所致的炎症反应,是其发挥改善CLP大鼠肺组织损伤的作用之一。氢饱和生理盐水改善肺损伤的其他作用机制有待进一步探讨。
