丹参酮ⅡA对神经病理性疼痛大鼠的影响*
2019-06-17沈亦萱马玉清马越张红霍斌王晓庆
沈亦萱,马玉清,马越,张红,霍斌,王晓庆
(1.兰州大学第一医院麻醉科,兰州 730000;2.兰州大学第一临床医学院 2015级临床医学1班,兰州 730000)
神经病理性疼痛是神经系统损伤和神经元敏感性改变所致的难治性疼痛,周围神经和中枢神经元敏感化是诱发异常疼痛的原因,阿片类药物治疗效果不佳。新的靶分子导向的止痛剂备受期待。神经损伤后不可避免地激发神经元炎症反应。神经元炎症反应介导神经组织的修复和再生,参与慢性疼痛的发生。研究表明,高迁移率族蛋白B1(high mobility group box 1 protein,HMGB1)是一族含量丰富的非组蛋白核蛋白,氨基酸序列高度保守,可促发神经元炎症反应。通过靶向抑制HMGB1表达可减轻神经性疼痛,阻断HMGB1通路可能是治疗神经性疼痛的有效途径[1]。Toll 样受体4(Toll-like receptor 4,TLR4)是与免疫或炎性疾病密切相关的模式识别受体,与相应受体结合后激活NF-κB(nuclear transcription factor)信号通路,释放细胞因子,引起炎症级联反应。丹参酮 (tanshinone)是中药丹参根的脂溶性成分,含有邻醌或对醌结构。丹参酮ⅡA (tanshinoneⅡA,Tan ⅡA)是丹参酮中含量最高、活性最稳定的成分,有明确的分子结构,有一定的抗炎和抗氧化作用。Tan ⅡA 可通过抑制环氧化酶-2(COX2) 的过表达和胶质细胞活化,抑制神经元炎症反应(2)。笔者在本研究将建立脊神经选择性结扎(spinal nerve ligation,SNL)疼痛模型,在细胞和分子水平探讨HMGB1-TLR4信号通路在神经病理性疼痛的作用机制及Tan ⅡA对疼痛模型大鼠的作用。
1 材料与方法
1.1实验动物 健康成年雄性无特定病原体(SPF) 级 Sprague-Dawley(SD)大鼠,甘肃中医学院动物实验中心提供,实验动物生产许可证号:SCXK(甘)2011-0001,实验动物使用许可证号:SYXK(甘)2011-0001,体质量 200~240 g,动物脊髓取腰( lumbar,L) 4~6(L4~L6)节段。
1.2主要试剂 兔抗大鼠 HMGB1 多克隆抗体(ab 11354)、TLR4 多克隆抗体(ab 22408)和辣根过氧化物酶标记羊抗兔二抗,试剂盒购自Abcam公司;大鼠肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)和白细胞介素10(IL-10)酶联免疫吸附测定(ELISA)试剂盒购自上海源叶生物科技有限公司;丹参酮 ⅡA 磺酸钠注射液(STS,上海第一生化药业有限公司,批号:130408),其辅料为葡萄糖和注射用水;10%水合氯醛溶液(兰州大学第一医院药剂科)。
1.3主要仪器 荧光定量PCR检测系统(CF×96 Touch TM,Bio-Rad 公司);湿转印槽(Bio-Rad 公司);图像分析系统(ChemiDocTMMP Imaging System,Bio-Rad 公司);微显紫外分光光度计(BioMateTM3SSpectrophotometer,美国Thermo scientific公司);BIO-RAD伯乐酶标仪(美国Thermo scientific公司);Von Frey 纤维(美国stoleting 公司);PL-200 热刺痛仪(成都泰盟科技有限公司)。
1.4脊神经结扎疼痛模型(SNL)的建立 参照文献[3]的方法制备 SNL 疼痛模型。腹腔注射10%水合氯醛 300 mg·kg-1麻醉大鼠,大鼠髂棘连线为 L5~L6间隙,在 L4至L1(S1)脊柱中线偏左 0.5 cm 处作长1.5 cm的纵行切口,钝性分离左侧椎旁肌肉,暴露 L6横突和骶骨夹角,去除部分 L6横突,钝性分离 L5、L6脊神经,用 6~0号医用丝线紧紧结扎 L5脊神经,并在线结远端 5 mm 处剪断 L5脊神经[4]。假手术组大鼠操作与手术大鼠相同,只暴露 L5脊神经而不结扎。
1.5动物分组与处理 成年雄性SD大鼠,采用随机数字表法分为 3 组:假手术组、模型对照组和 Tan ⅡA 组,每组根据处死时间分为 3 小组:第3天组、第7天组和第14天组(n=6) 。SNL术毕即刻,Tan ⅡA组腹腔注射 STS 30 mg·kg-1·d-1,连续14 d,而假手术组和模型对照组腹腔注射等体积注射用水。
1.6痛阈测定 参照文献[5]方法,以Von Frey 纤维丝测定大鼠 50% 缩足反应阈值(paw withdrawal threshold,PWT),采用 PL-200热辐射仪测定大鼠的热刺激缩爪潜伏期(paw withdrawal latency,PWL)。
1.7实时荧光定量聚合酶链反应(PCR)检测大鼠腰段脊髓 HMGB 和TLR4mRNA的表达 登录 Genebank,根据大鼠 HMGB1 和 TLR4 全长基因序列,应用 Perkin- Elmer Applied Biosystems 提供的 Primer Express soft ware 设计引物,由上海生物工程有限公司合成,目的基因引物、序列和长度见表1。
表1 目的基因引物、序列和长度
Tab.1Primer,sequenceandlengthoftargetgene

目的基因扩增长度/bp引物序列HMGB1218上游引物5′AGC AAT CTG AAC GTC TGT CC 3′下游引物5′GTT CTT GTG ATA GCC TTC GC 3′TLR4356上游引物5′GCC GGA AAG TTA TTG TGG TGG T 3′下游引物5′ATG GGT TTT AGG CGC AGA GTT T 3′β-actin372上游引物5′GCC ATG TAC GTA GCC ATC CA 3′下游引物5′GAA CCG CTC ATT GCC GAT AG 3′
大鼠腰段脊髓组织(≤30 mg),按 Total RNA Kit 说明书提取总 RNA,测定总 RNA 的浓度和纯度,鉴定 RNA 完整性。以提取的总 RNA 为模板,按照逆转录试剂盒(Transcriptor First Strand cDNA Synthesis Kit) 说明书进行逆转录反应,合成 cDNA 第一链,-20 ℃保存。以制备的 cDNA 为模板,分别扩增β-actin、HMGB1 和 TLR4。cDNA 样品稀释10倍,分别进行实时荧光定量PCR 扩增,荧光染料法(SYBR Green) 实时监测 PCR 产物量,得出荧光曲线,通过cDNA 浓度梯度的对数值对CT 值作图比较两基因扩增效率。反应体系为:95 ℃预变性 15 s,95 ℃变性 3 min,55 ℃退火 1 min,44个循环。采用罗氏公司的 Fast Start Universal SYBR Green Master 试剂盒,在 CF×96 TouchTM荧光定量 PCR 仪上进行目的基因(HMGB1 和TLR4)和内参基因(β-actin)扩增,取 Ct 平均值,用2-ΔΔCt法处理数据[6]。
1.8Western blotting检测大鼠腰段脊髓 HMGB和TLR4 蛋白质的表达 采用 BCA 法蛋白质定量,在50 μg蛋白质/ 泳道中加入等体积 2×SDS 凝胶加样缓冲液,煮沸使蛋白质变性,电泳分离蛋白质;300 mA,1 h 用半干转膜仪将蛋白质转移至聚偏氟乙烯(Polyvinylidene fluoride,PVDF) 膜上。5%脱脂牛奶室温封闭1 h,4 ℃封闭过夜;次日,加入稀释的一抗(anti-HMGB1 mouse IgG,anti-TLR4 mouse IgG,anti-β-actin mouse IgG),4 ℃孵育2 h;TBST 洗膜 10 min×3次;加入辣根过氧化物酶标记的二抗,4 ℃孵育4~8 h;TBST 洗膜10 min×3 次。用 Western blotting 荧光检测试剂显色液,显色1~15 min,显影后终止反应,用凝胶图像成像系统分析。
1.9ELISA 检测大鼠腰段脊髓TNF-α、IL-1β和IL-10蛋白的表达 脊髓组织称定质量后置于匀浆缓冲液中匀浆,4 ℃,2000×g离心30 min,取上清液待用。在波长450 nm处测定标本吸光度(A450值),通过标准品A值绘出标准曲线,按曲线方程式计算各样本浓度,利用曲线方程式算出 TNF-α、IL-1β 和 IL-10 的蛋白含量,每组样品点 3 孔。

2 结果
2.1Tan ⅡA对SNL大鼠痛敏的影响 SNL手术增加大鼠后足对机械性刺激和热刺激的敏感性,与假手术组比较,模型对照组、Tan ⅡA 组PWT 和 PWL 均降低,差异有统计学意义(P<0.01)。模型对照组术后第3天时大鼠 PWT和 PWL 均较术前明显降低(P<0.01)。与模型对照组比较,TanⅡA 组大鼠术后第3天时 PWT和 PWL 升高(P<0.01)。见图1。

与假手术组比较,*1P<0.01;与模型对照组比较,*2P<0.01

Compared with sham-operated group,*1P<0.01;Compared with model control group,*2P<0.01

2.2Tan ⅡA对SNL大鼠腰段脊髓HMGB1和TLR4 mRNA表达的影响 Real-time PCR 检测大鼠脊髓 HMGB1 和 TLR4 mRNA 表达水平结果见图 2。 与假手术组比较,模型对照组大鼠在第3,7和14天脊髓 HMGB1和TLR4 mRNA 表达水平显著升高,均差异有统计学意义(均P<0.05)。与模型对照组比较,Tan ⅡA 组大鼠脊髓 HMGB1 和 TLR4 mRNA 表达水平显著降低,均差异有统计学意义 (均P<0.05)。

与假手术组比较,*1P<0.05;与模型对照组比较,*2P<0.05

Compared with sham-operated group,*1P<0.05;Compared with model control group,*2P<0.05
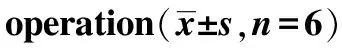
2.3TanⅡA 对SNL大鼠腰段脊髓HMGB1和TLR4 蛋白表达的影响 Western blotting 检测大鼠脊髓 HMGB1 和 TLR4 蛋白表达水平结果见图3,4 。与假手术组比较,模型对照组大鼠在 第3,7和 14天脊髓 HMGB1和TLR4 蛋白表达水平显著增,差异有统计学意义(P<0.05)。与模型对照组比较,Tan ⅡA 组大鼠脊髓 HMGB1和TLR4 蛋白表达水平显著降低,差异有统计学意义(P<0.05)。上述结果提示,模型大鼠痛阈变化可能与 HMGB1、TLR4 高表达有关。
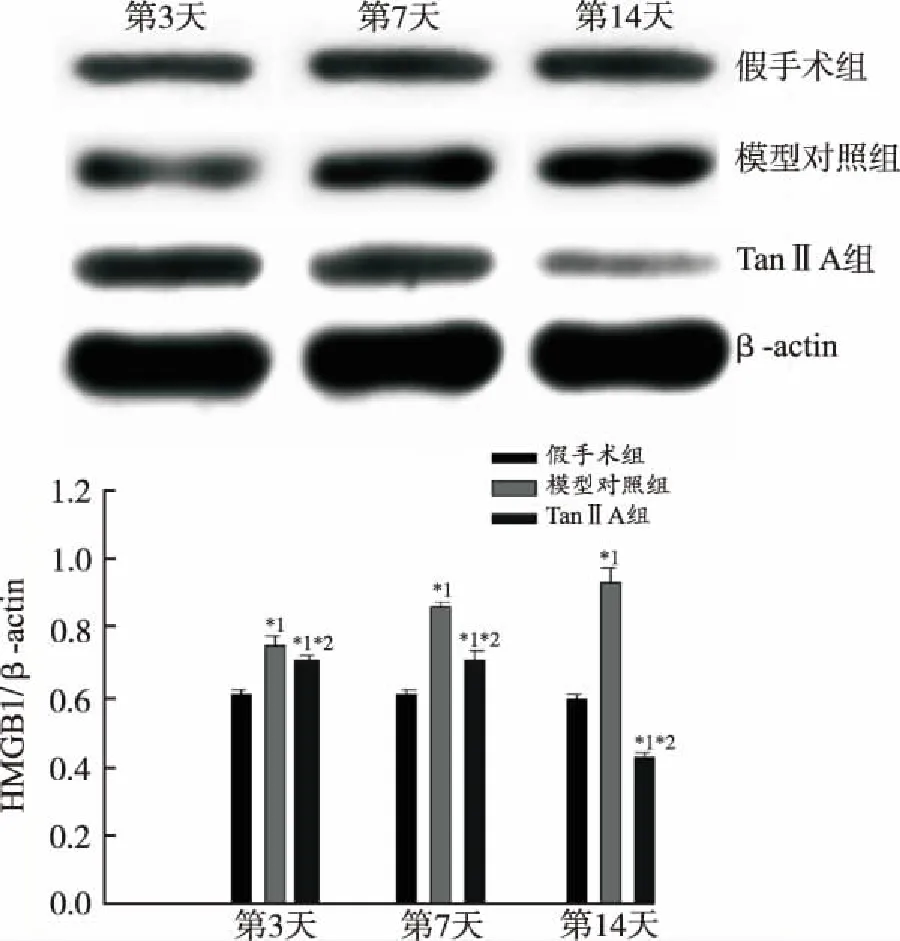
与假手术组比较,*1P<0.05;与模型对照组比较,*2P<0.05
图3 3组大鼠SNL术后不同时间点HMGB1蛋白的表达变化
Compared with sham-operated group,*1P<0.05;Compared with model control group,*2P<0.05
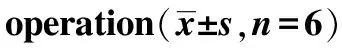
2.4TanⅡA对SNL大鼠脊髓TNF-α、IL-1β和IL-10蛋白表达的影响 ELISA 法检测结果见图5。与假手术组比较,模型对照组、TanⅡA 组大鼠第3,7和14天脊髓TNF-α和IL-1β表达水平增加(P<0.05);与模型对照组比较,TanⅡA 组大鼠第3,7和14天脊髓TNF-α和IL-1β表达水平降低(P<0.05),而IL-10的表达水平显著增加,均差异有统计学意义(P<0.05)。
3 讨论
本研究采用改良的L5SNL模型,参照文献方法制备脊神经选择性结扎切断模型,行为学测试结果显示,SNL术后大鼠后足对机械性和热刺激的敏感性增加,术后第3,7和14天大鼠 PWT和PWL明显降低,表明模型成功。TanⅡA 腹腔注射后大鼠后足机械性和热刺激的敏感性降低,术后第3,7和14天大鼠 PWT和PWL明显升高,镇痛作用明显。
笔者在预实验采用30和 50 mg·kg-1的STS腹腔注射用药,效果无明显区别,但50 mg·kg-1时大鼠出现明显的副作用。因此,根据药量药效学最佳比例,选择实验剂量30 mg·kg-1。Tan ⅡA不易吸收,以水溶性STS 替代以提高生物利用度。
脊髓是调节痛觉信号传导的重要中枢,脊髓水平HMGB1 及其内源性配体在神经病理性疼痛中作用的研究不多。本研究结果显示,假手术组脊髓组织中HMGB1 mRNA 和蛋白质表达极少,SNL 术后 第3天,随着异常痛敏的产生,模型对照组脊髓 HMGB1 mRNA和蛋白质表达均明显升高。推测HMGB1与病理性疼痛时的机械性痛觉超敏和热刺激诱发的痛觉过敏有关。研究表明,大鼠神经受损后,用HMGB1抗体治疗可明显减轻痛觉过敏,说明HMGB1与神经病理性疼痛有关[7]。有研究发现 HMGB1 可延长慢性炎症性疼痛的病理进程,推测原因为脊髓星形胶质细胞和背根神经节细胞中HMGB1表达上调所致[8]。本研究发现,Tan ⅡA 组与 模型对照组比较,大鼠脊髓组织HMGB1的表达明显减少,且该组大鼠的PWT和PWL同时显著减轻。提示腹腔注射 TanⅡA 在产生镇痛效应的同时,也抑制脊髓组织 HMGBl mRNA和蛋白的表达,推测HMGB1表达下调可能是 Tan ⅡA 发挥镇痛作用的机制。假手术组大鼠脊髓的 TLR4 mRNA 和蛋白表达较低,SNL 术后第3天,伴随异常痛敏的出现,模型对照组脊髓TLR4 mRNA和蛋白表达上调并维持在较高水平,推测TLR4与机械痛和热敏痛有关。HMGB 与TLR4结合呈二聚体化,激活 MAPK 和 NF-κB 信号转导通路[9],生成大量的细胞因子TNF-α和IL-1β,产生痛觉过敏和痛觉超敏[10],这与本实验结果一致。TLR位于神经元界面,越来越多的证据表明TLR激活神经胶质细胞(包括小胶质细胞和星形胶质细胞)、感觉神经元和其他细胞的炎症反应,影响痛觉传导,导致疼痛扩大和不易治愈[11]。本实验检测到TLR4的表达量较HMGB1少,因为TLR4不是HMGB1的唯一受体,晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE) 也与可HMGB1受体结合,启动NF-κB信号通路。神经元胶质细胞激活后可释放一系列的炎症细胞因子TNF-α、IL-1β、IL-6 等,产生神经病理性疼痛[12]。本研究还发现,TanⅡA腹腔注射抑制TLR4和下游炎症因子TNF-α和IL-1β的表达,且该组大鼠的PWT和PWL同时显著减轻,提示腹腔注射TanⅡA产生镇痛效应的同时,抑制脊髓组织中TLR4 mRNA 及蛋白的表达,推测TLR4和下游细胞因子TNF-α和IL-1β的表达下调可能是TanⅡA发挥镇痛作用的机制。IL-10可以抑制炎性因子IL-1β、IL-6及脊髓胶质细胞活化所致的疼痛过敏[13]。HMGB1抗体或HMGB1抑制剂对炎性病理性疼痛疗效明显[14]。HMGB1抑制剂(丙酮酸乙酯)可抑制脑损伤模型大鼠的 HMGB1/TLR4/NF-κB 信号转导通路和炎症反应,改善模型大鼠的脑水肿[15]。本实验也观察到,TanⅡA 可抑制SNL大鼠脊髓 HMGB1、TLR4、TNF-α和IL-1β的表达,促进IL-10的表达,逆转SNL所致的热敏痛和机械痛。

与假手术组比较,*1P<0.05;与模型对照组比较,*2P<0.05

Compared with sham-operated group,*1P<0.05;Compared with model control group,*2P<0.05
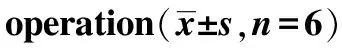

与假手术组比较,*1P<0.05;与模型对照组比较,*2P<0.05
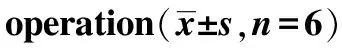
TanⅡA可逆转SNL所致的热敏痛和机械痛,使HMGB1和TLR4 mRNA和蛋白质表达降低,炎症细胞因子TNF-α,IL-1β的表达减少,抗炎因子 IL-10 的表达增加,抑制HMGB1-TLR4信号通路。表明在L5SNL模型中抑制HMGB1-TLR4信号通路有一定的镇痛作用,HMGB1-TLR4信号通路与神经病理性疼痛有关,可作为治疗病理性疼痛的靶点。
