丙型肝炎病毒感染患者血清及PBMC中miR-122、miR-29b的表达
2019-06-17何雪琴王靳琎余飞魏英周青珍向小卫桑明陈琴华
何雪琴,王靳琎,余飞,魏英,周青珍,向小卫,桑明,陈琴华,2
(1湖北医药学院附属东风医院,湖北十堰 442000;2武当特色中药研究湖北省重点实验室)
丙型肝炎(丙肝)是严重威胁人类健康的传染病之一,易转变为慢性潜伏感染,且多数患者可能发展为肝硬化甚至肝癌,全世界范围约有31.1%的肝癌病例由丙型肝炎病毒(HCV)感染所致[1~3]。丙肝起病隐匿,感染初期约80%患者无明显症状,易漏诊。目前诊断HCV感染的“金指标”是HCV-RNA定量,但其与丙肝的严重程度并非绝对相关,多用于评估抗病毒的疗效及判断预后。微小RNA(miRNA)是一类参与基因转录后调控的小分子RNA,参与调控机体的多种生理过程[4,5], 并参与病毒感染和肿瘤的发生发展等病理过程[6]。miR-122为肝脏中特异性表达的miRNA,占肝脏总miRNA的72%,对肝脏生理功能有重要调节作用,在HBV、HCV等嗜肝性病毒感染过程中发挥重要的调控功能[7]。miR-122可作为HCV感染早期诊断和预后判断的潜在生物学标志物。2018年7月,我们检测了HCV感染及HBV感染患者血清和外周血单个核细胞(PBMC)中miR-122和miR-29b表达,探讨二者与HCV感染的关系,为丙肝的预防、诊断和治疗提供新思路。
1 资料与方法
1.1 临床资料 随机选取2016年6月~2018年6月湖北省十堰市国药东风总医院收治的HCV感染者16例(HCV组),男10例、女6例,年龄(48±6)岁。HBV感染者30例(HBV组),男15例、女15例,年龄(47±4)岁。同时感染HCV和HBV者12例(HCV+HBV组),男8例、女4例,年龄(48±4)岁。三组均经血清HCV-RNA、HBV-RNA定量检测明确诊断。另纳入30例查体健康志愿者作为对照组,男15例、女15例,年龄(45±4)岁。各组年龄、性别方面差异均无统计学意义(P均>0.05)。本研究通过我院伦理委员会批准实施,所有研究对象知情同意,并签署知情同意书。
1.2 HCV-RNA及HBV-DNA定量检测 按HCV-RNA定量和HBV-DNA定量检测试剂说明书设置相关仪器参数并操作,试剂盒均购自中山大学达安基因股份有限公司,HCV试剂盒的检测下限为1.0×103IU/mL,HBV试剂盒的检测下限为5.0×102IU/mL。
1.3 RNA提取 采用TRIzol法。所有研究对象采集5 mL EDTA抗凝血用于分离PBMC,同时采集5 mL无添加剂外周血分离血清。每毫升TRIzol加入氯仿200 μL,剧烈振荡15 s,室温静置10 min,离心(12 000 g,15 min,4 ℃);吸取上层水相加等体积异丙醇,颠倒混匀,冰上静置10 min,离心(12 000 g,10 min,4 ℃);弃上清,加1 mL预冷的75%乙醇(DEPC水现配)洗涤,离心(8 000 g, 5 min,4 ℃);弃上清,加入DEPC 20 μL水溶解RNA,测RNA浓度并计算所需RNA体积,每个样品取4 μg的RNA做逆转录,因此每管中需加入的RNA体积为VRNA(μL)=4/CRNA。
1.4 血清和PBMC中miR-122、miR-29b表达检测 miRNA的逆转录及实时荧光定量PCR: 采用Thermo逆转录试剂盒说明书合成cDNA,本次试验以cel-miRNA-39为内参, 扩增反应体系参照相关试剂盒说明书进行。逆转录反应总体系为20 μL。EP管中加入VRNA+V水+1 μL Oligdt (共12 μL),PCR仪70 ℃,反应5 min;取出置于冰上,加入预混液(1 μL RNasin、1 μL rRNasin、4 μL 5×buffer和2 μL dNTP mix)共8 μL,PCR仪42 ℃反应60 min,合成的cDNA用于qRT-PCR。取4 μL逆转录cDNA为模板,以miR-122、miR-29b荧光定量PCR引物进行扩增,荧光定量PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,42个循环;72 ℃ 5 min。以2-△△Ct法进行结果比较分析,△△Ct =(Ct目的基因- Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照组。
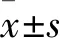
2 结果
2.1 各组血清和PBMC中miR-122表达比较 对照组、HCV组、HBV组、HCV+HBV组血清中miR-122表达分别为(8.2±1.4) ×10-3、(20±4) ×10-3、(9±3) ×10-3、(23±5) ×10-3;PBMC中miR-122表达分别为(1.43±0.29)×10-5、(4.53±0.83)×10-5、(1.67±0.46)×10-5、(4.49±1.14)×10-5。与对照组相比,HCV组、HCV+HBV组血清和PBMC中miR-122表达均升高,其中HCV组血清和PBMC中miR-122表达高于对照组(P均<0.05),HCV+HBV组血清和PBMC中miR-122表达与对照组比较差异无统计学意义(P均>0.05)。
2.2 各组血清和PBMC中miR-29b表达比较 对照组、HCV组、HBV组、HCV+HBV组血清中miR-29b表达分别为(3.35±0.48)×10-5、(2.44±0.517)×10-5、(2.05±0.27)×10-5、(6.87±1.74)×10-5;PBMC中miR-29b表达分别为(4.46±1.17)×10-4、(5.1±3.66)×10-4、(2.59±0.22)×10-4、(0.52±0.5)×10-4。与对照组相比,HCV组、HBV组、HCV+HBV组虽能检测到血清和PBMC中miR-29b表达水平有所下降,但与对照组比较差异均无统计学意义(P均>0.05)。
3 讨论
HCV属于黄病毒科单股正链RNA病毒,HCV感染可引发丙型肝炎,因临床症状隐匿,往往多年不被发现,随着HCV在体内复制可持续损伤细胞,逐步发展为慢性肝炎、肝硬化、肝癌等严重肝病。因此,早期诊断HCV感染性疾病对防控HCV感染及相关疾病的治疗和预后尤为重要。
自2005年Jopling等[8,9]首次报道miR-122可辅助HCV复制,miR-122就成为肝脏-HCV相互作用研究的焦点[10,11]。miR-122是肝脏特异性表达的微小RNA,参与肝脏的功能代谢,其可通过与HCV病毒的5′UTR两个结合位点的相互作用促进病毒复制[12,13];miR-122还可通过在翻译起始阶段增强核糖体与病毒RNA的亲和力促进HCV复制。此外miR-122还可调节肝细胞核因子6、AMP依赖蛋白激酶、过氧化物酶体增殖物活化受体等多种因子,影响肝脏的发育、分化和体内平衡及代谢功能[14]。有研究[15]表明,miR-122是HCV复制必须的宿主因子,HCV的稳定和增殖与肝脏表达的miR-122同HCV基因组功能性相互作用密切相关。本研究结果显示,HCV感染后患者血清及PBMC中miR-122的表达均升高,其中HCV组中miR-122高于对照组,差异有统计学意义,此与Varnoholt等[16]结果一致。同时我们观察到HCV和HBV双重感染的患者血清及PBMC中miR-122表达高于HBV单一感染患者,提示HBV单一感染和HCV合并感染患者中miR-122的复杂相互作用需进一步研究和探索。
miR-122是第一个被证明与HCV复制相关的miRNA,且在肝脏中特异表达,miR-122占肝细胞表达miRNA的72%,参与调控肝细胞中多种代谢通路。抑制miR-122表达可能影响肝细胞代谢,因此其他在HCV与宿主相互作用中起作用的miRNA,亦可能成为抗HCV研究的靶标。目前研究报道了多种可影响HCV感染的miRNA[17],或由于HCV感染而发生改变的miRNA,如miR-29b、miR-196b等可抑制HCV复制[18~21],这些miRNA可作为抗HCV治疗的新靶标,本研究中,单一感染HCV患者的血清及PBMC中miR-29b表达略降低,但与对照组比较差异无统计学意义,其原因可能是miR-29b在肝细胞中表达量较低,提示miR-29b在HCV相关性肝病中的作用有待进一步研究。
此外,我们的研究存在一些局限性。首先,收集大宗病例较困难,这可能导致统计结果不足以完全解决上述问题。其次,没有进行血液标本采集,且并非所有的患者都有可用于病毒学检测的血液样本。因此,本研究无法控制某些因素可能影响miR-122表达或治疗结果。
综上所述,在感染HCV的患者中,血清和PBMC中miR-122表达升高,并且在单一感染HCV的患者中最高,miR-122有望成为HCV相关性肝病新的抗病毒药物靶点或新的诊断生物标志物。
