一株水霉拮抗放线菌FX11 的筛选鉴定及其安全性和抑菌稳定性
2019-06-17王丹生罗永成
王 旭,王丹生,罗永成
(辽东学院农学院,辽东学院海岸带生物技术研究所,辽宁丹东 118003)
水霉病具有高度传染性,发病率及死亡率高,各种淡水成鱼、稚鱼和鱼卵都可发生,是淡水养殖鱼类的世界性病害[1]。该病病原为水霉属真菌[2]。其中,寄生水霉Saprolegnia parasitica 是目前已发现的致病水霉中最为重要的病原菌,其孢子萌发快,侵袭能力强,几乎能够感染包括鲫、斑马鱼、鲟及鲈鱼等在内的所有淡水鱼类及卵[3-6]。孔雀石绿曾是治疗水霉病最有效的化学试剂,但因其强致畸、致癌及高残留,已被禁止使用。目前水霉病防治主要采用抗生素、杀菌剂、中草药和氧化剂等[7-13]。这些方法易造成水霉的耐药性,且存在效果不明显、成本高,使用受限,有效浓度超出安全限量等问题[14]。研究表明,一些微生物来源的活性成分可以抑制真菌的生长和感染,且具有绿色、环保、安全、高效的优点[15-17]。本试验以寄生水霉为靶标菌,通过平板对峙培养筛选对水霉生长具有抑制作用的菌株,并对其安全性和抑菌稳定性进行初步分析,以期为水霉病的生物防治提供优良菌种资源和基础数据。
1 材料与方法
1.1 材料
1.1.1 供试菌株
寄生水霉菌株SMJ-1、SMJ-2、SMJ-3、SMJ-4 分别由笔者分离自辽宁省东港市淡水养殖池塘的散鳞镜鲤Cyprinus carpio var.specularis、彭泽鲫Carassius auratus var.pengze、大鳞副泥鳅Paramisgurnus dabryanus 的发病组织及散鳞镜鲤鱼卵。经纯化、致病性测定和分子鉴定,确定其均为寄生水霉。待筛选菌株为笔者分离自丹东地区淡水养殖池塘周围土壤样品中的21 株放线菌。所有菌株均保存于辽东学院农学院微生物工程实验室。
1.1.2 培养基
PDA 培养基:马铃薯200.0 g、葡萄糖20.0 g、琼脂20.0 g、水1 000 mL,自然pH 值,用于寄生水霉的培养和平板对峙试验;高氏一号培养基:可溶性淀粉20.0 g,硝酸钾1.0 g,氯化钠0.5 g,K2HPO4·3H2O 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,琼脂20.0 g,水1 000 mL,pH 7.2,用于放线菌传代培养;ISP1 培养基:酪蛋白胨5 g,酵母提取物3,pH 6.8~7.2,用于拮抗菌液体培养。
1.1.3 试验用鱼
试验用散鳞镜鲤、彭泽鲫和大鳞副泥鳅稚鱼由丹东市水产科学研究所提供。其中,散鳞镜鲤平均体长4.45±0.75 cm、体质量2.08±0.43 g,彭泽鲫平均体长4.82±0.57 cm、体质量1.64±0.36 g,大鳞副泥鳅平均体长9.54±0.52 cm、体质量8.33±1.51 g。
1.1.4 主要试剂
Lysis Buffer for Microorganism to Direct PCR、Premix Taq Version 2.0 (Loading dye mix)、DNA Marker(DL-2000)购自宝生物工程(大连)有限公司,引物1492R/27F(1492R:5’-TAC GGY TAC CTT GTT ACG ACT T-3’;27F:5’-AGA GTT TGA TCM TGG CTC AG-3’)由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 拮抗菌筛选
采用平板对峙法进行初筛,将活化后的寄生水霉用直径0.6 cm 的无菌打孔器制备菌饼,接种于PDA平板中央,18 ℃培养24 h 后,采用十字交叉法,在距离靶标菌饼2 cm 处对称接种待筛选菌株,以不接菌一侧为对照。置于18 ℃培养箱中培养,至对照一侧长满平板后测量抑菌带宽度,确定待筛菌株的抑菌效果。
采用发酵液抑菌试验确定其抑菌率,将初筛所得拮抗菌接种于装量为40%的ISP1 液体培养基中,28 ℃发酵72 h。发酵液经微孔滤膜(孔径0.22 μm)过滤后,按照1 :5 的比例与55 ℃的PDA 培养基混合均匀,制备平板。冷却后,在平板中央接种寄生水霉菌饼,设无菌水为对照,每个处理3 次重复,于18 ℃培养至对照长满平板后,测量各处理的菌落直径,计算抑菌率。抑菌率(%)=(对照菌落生长直径-处理菌落生长直径/对照菌落生长直径)×100。
1.2.2 拮抗菌鉴定
拮抗菌形态特征测定参照文献[18-19]的方法进行。拮抗菌16S rRNA 基因序列分析方法如下:将待测菌株接种在高氏一号平板培养基上,28 ℃培养3 d,用灭菌的枪头刮取适量菌体置于50 μL 菌体裂解液Lysis Buffer for Microorganism to Direct PCR 中,80 ℃水浴15 min,5 000 r·min-1离心5 min,取上清液作为PCR 模板。选用通用引物27F:5’-AGA GTT TGA TCM TGG CTC AG-3’和1492R:5’-TAC GGY TAC CTT GTT ACG ACT T-3’进行16SrRNA 基因扩增。扩增体系为:1×Taq PCR Master Mix 25 μL,DNA 模板2 μL (1~10 ng),引物(10 μmol·L-1)各1 μL,ddH2O 21 μL。PCR 反应程序为:94 ℃,4 min;94 ℃,30 s,55 ℃,30 s,72 ℃,2 min,30 个循环;72 ℃,10 min,4 ℃终止反应。扩增产物经电泳检测后,由生工生物工程(上海)有限公司进行纯化、测序拼接。获得的基因序列在NCBI (https://www.ncbi.nlm.nih.gov)进行Blast 检测,下载同源性较高的菌种序列,用Clustal X 2.0 程序进行多重序列比对,利用MEGA 7.0 软件的邻接法(Neighbor-joining method)进行1 000 次步长计算,构建系统发育树[20]。
1.2.3 拮抗菌安全性测定
拮抗菌发酵滤液的制备方法同1.2.1。试验用鱼室内暂养7 d 后进行试验。每种鱼分别设置实验组和对照组,每组设置3 个重复,每个重复选取30 尾稚鱼。实验组加入拮抗菌发酵滤液原液(与水体体积比为1 :10),对照组加入等量灭菌的ISP1 培养基。试验期间水温(24±2) ℃,充气使溶解氧不低于6 mg·L-1,氨氮和亚硝酸盐浓度不高于0.1 mg·L-1,光周期为自然周期,7 d 后统计稚鱼存活率,根据稚鱼存活率分析拮抗菌的安全性。
1.2.4 拮抗菌传代稳定性测定
拮抗菌株于高氏一号培养基上传代培养,每48 h 转接1 次,连续传代10 次,每个处理3 次重复。平板对峙试验测定出发菌株与传代菌株对寄生水霉的抑菌效果,根据抑菌带宽度变化分析传代对拮抗菌抑菌效果的影响。
1.2.5 拮抗菌发酵液热稳定性测定
拮抗菌发酵采用ISP1 液体培养基,以5%的接种量,将拮抗菌菌液接种于装量为40%的500 mL 三角瓶中,28 ℃,120 r·min-1,培养72 h。发酵液采用微孔滤膜(孔径0.22 μm)过滤,滤液4 ℃冷藏备用。
各取发酵滤液15 mL 分别加入到20 mL 直口离心管中,置于10 ℃、20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃下处理2 h。之后按照1 :5 的比例,将处理后的发酵滤液分别与灭菌后冷却至55 ℃的PDA 培养基混合均匀制备平板。每个平板中央接种寄生水霉菌饼,每个处理重复3 次,设无菌水为对照18 ℃培养至对照长满平板后,测量各处理菌落直径,计算抑菌率,分析不同温度处理对试验菌株发酵滤液抑菌活性的影响。
1.2.6 拮抗菌发酵液酸碱稳定性测定
拮抗菌发酵滤液的制备方法同1.2.5。各取发酵滤液15 mL 分别加入到20 mL 直口离心管中,用1 mol·L-1HCl 和1 mol·L-1NaOH 分别调整pH 至5.0、6.0、7.0、8.0、9.0,室温静置24 h 后,将各管中的pH调回至未经处理的发酵滤液pH 6.8。之后按照1 :5 的比例,将处理后的发酵滤液分别与灭菌后冷却至55 ℃的PDA 培养基混合均匀制备平板。每个平板中央接种寄生水霉菌饼,每个处理重复3 次,18 ℃培养至对照长满平板后,测量各处理菌落直径,计算抑菌率,分析不同pH 处理对试验菌株发酵液抑菌活性的影响。
2 结果与分析
2.1 拮抗菌筛选
平板对峙试验结果显示,菌株FX11 对4 株不同来源的寄生水霉菌株SMJ-1、SMJ-2、SMJ-3、SMJ-4均表现出明显拮抗作用,其中抑菌带平均宽度最大为18.30±1.52 mm,见图1。发酵液抑菌试验结果显示,菌株FX11 的抑菌率为68.40%。
2.2 拮抗菌鉴定
2.2.1 拮抗菌FX11 的形态特征
菌株FX11 在高氏一号培养基上菌落微黄色、干燥,基内菌丝浅黄色,气生菌丝黄白色,无可溶性色素,见图2。孢子丝直、长。分生孢子柱形或卵圆形,表面光滑,见图3、4。对照《放线菌的分类与鉴定》和《链霉菌鉴定手册》,菌株FX11 的形态与链霉菌属Streptomyces 特征一致。
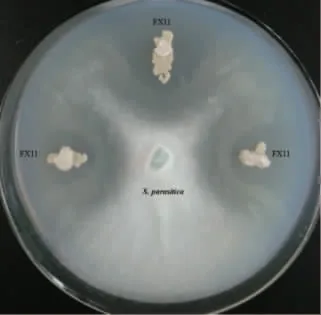
图1 菌株FX11 对寄生水霉的拮抗作用Fig.1 Antagonistic activity of strain FX11 against S.parasitica
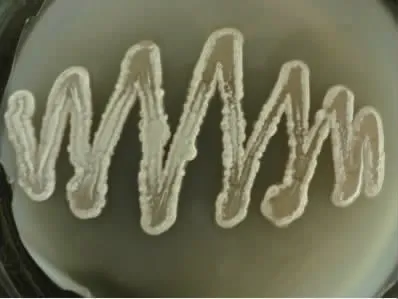
图2 菌株FX11 的菌落形态Fig.2 Colony morphology of strain FX11

图3 菌株FX11 的孢子丝(×1000)Fig.3 Spore hypha of strain FX11 (×1000)
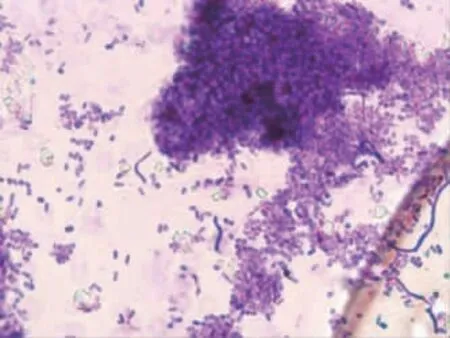
图4 菌株FX11 的分生孢子(×1000)Fig.4 Conidiospore of strain FX11 (×1000)
2.2.2 拮抗菌FX11 的16S rRNA 基因序列分析
以菌株FX11 的基因组DNA 为模板,1492R/27F为通用引物,经PCR 扩增、测序获得长度为1 183 bp的碱基序列(GenBank accession number:MN759326)。所测序列在NCBI 数据库中进行Blast 检索,结果显示该菌株与Streptomyces polychromogenes 的16S rRNA 基因序列相似性为98%。选取并下载典型菌株序列,以小单孢菌属种类Micromonospora viridifaciens为外群构建系统发育树。结果如图5 所示,菌株FX11 与Streptomyces polychromogenes 聚类在一个分支上,结合其形态结构特征的初步鉴定结果,菌株FX11 鉴定为Streptomyces polychromogenes。
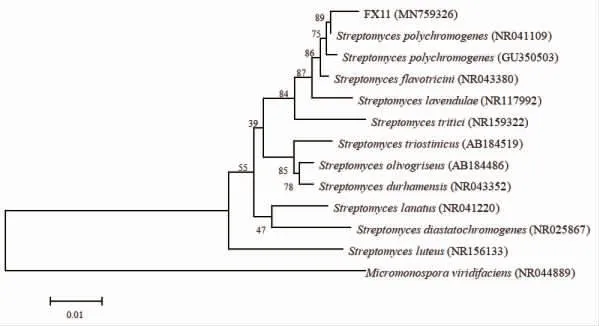
图5 基于菌株FX11 的16S rRNA 基因序列构建的系统发育树Fig.5 Phylogenetic tree based on 16S rRNA gene sequence of strain FX11 and related species
2.3 拮抗菌FX11 的安全性测定
拮抗菌FX11 的发酵滤液与散鳞镜鲤、彭泽鲫、大鳞副泥鳅稚鱼共同培养7 d 后,统计存活率。结果显示,3 种稚鱼的实验组和对照组存活率均无显著差异(P>0.05),可见拮抗菌FX11 的发酵产物对试验用鱼没有毒性,具有良好的安全性,见图6。
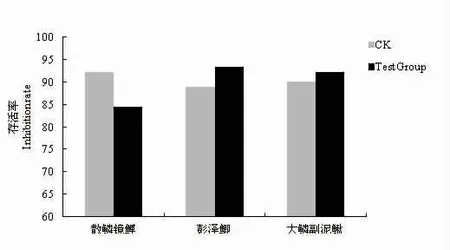
图6 菌株FX11 的发酵滤液对试验用鱼存活率的影响Fig.6 Effects of fermentation filtrate of strain FX11 on survival rate
2.4 拮抗菌传代稳定性测定
拮抗菌株FX11 和其传代菌株分别与寄生水霉进行平板对峙培养,结果见表1,拮抗菌FX11 继代培养菌株与出发菌株之间抑菌效果差异不显著(P>0.05),可见该拮抗菌抑菌效果传代稳定。

表1 FX11 及其继代培养菌株对寄生水霉的抑制作用Tab.1 Inhibitory effect of FX11 and its subculture strains on S.parasitica
2.5 温度变化对拮抗菌发酵液抑菌活性的影响
温度变化对菌株FX11 发酵液抑菌稳定性的影响结果见图7,10~70 ℃范围内处理的样品其抑菌活性无显著性差异(P>0.05),表明温度变化对菌株FX11 发酵液中的抑菌物质的活性没有影响,该菌株发酵液对温度变化具有良好的耐受性。
2.6 拮抗菌发酵液酸碱稳定性
pH 变化对FX11 发酵液抑菌活性的影响结果见图8,试验菌株发酵滤液的抑菌活性对酸碱度变化较为敏感,pH 值低于6.0 或高于8.0,抑菌率显著下降,仅在Ph 6.0~8.0 范围内抑菌活性较为稳定,表明菌株FX11 发酵液中抑菌物质的活性受pH 影响较大,在pH 6.0~8.0 范围内抑菌作用稳定。
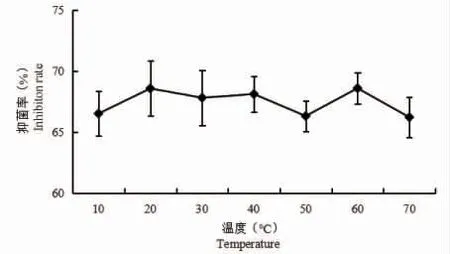
图7 不同温度处理对拮抗菌FX11 发酵液抑菌活性的影响Fig.7 Effects of different temperature treatments on antibacterial activity of FX11 fermentation broth
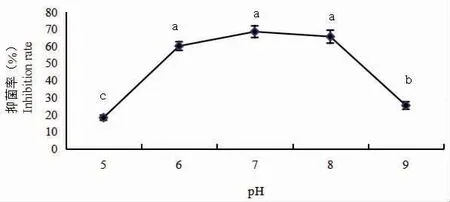
图8 不同酸碱度处理对拮抗菌FX11 发酵液抑菌活性的影响Fig.8 Effects of different pH treatments on antibacterial activity of FX11 fermentation broth
3 讨论
以化学药物、抗生素、疫苗及中草药等方法防治水霉病存在各自的缺点和不足。利用拮抗菌及其发酵产物对水霉病进行防治具有绿色、环保、安全、高效的优点,已成为水霉病防控研究的主流方向[3]。研究表明,一些细菌如芽孢杆菌Bacillus 和放线菌Actinomyces 对水霉菌具有良好的抑制作用。张书俊等[21]筛选获得一株对水霉菌菌丝体生长与孢子萌发具有明显抑制作用的粘质沙雷氏菌Serratia marcescens 菌株LD038。贺凤等[22]从海底沉积物中分离、筛选水霉拮抗菌株海洋链霉菌Streptomyces sp.S26,其产生的活性物质对病原水霉真菌有较强的抑制作用,并对外界环境变化有较强的适应能力。梁永增、申慧等等[23-24]筛选的芽孢杆菌Bacillus sp.菌株JL04 和短小芽孢杆菌Bacillus pumilus JL50 对水霉菌均具有显著抑制作用,2 株拮抗菌对鱼体没有毒性,且传代稳定。本研究从实验室分离保存的21 株放线菌中筛选获得一株对寄生水霉具有显著拮抗作用的链霉菌菌株FX11,试验结果表明该菌株对不同来源的多株寄生水霉均显示出明显的抑制作用。经过对其形态学特征及16S rRNA 基因序列比对分析,可知菌株FX11 为链霉菌属Streptomyces polychromogenes。该结果是Streptomyces polychromogenes 对水霉菌具有拮抗作用的首次报道。
Streptomyces polychromogenes FX11 的发酵滤液对供试稚鱼无毒性。该菌株经传代培养后,对水霉菌拮抗作用稳定,表明其具有良好的传代稳定性。该菌发酵滤液经10~70 ℃低温及高温处理后,抑菌活性稳定。淡水养殖水体的温度变化范围一般为0~34.6 ℃[25],试验表明菌株FX11 发酵产物表现出对养殖环境温度变化的良好适应性。该菌的发酵产物抑菌活性对环境的pH 波动较为敏感,仅在pH 6~8 范围内具有显著的抑菌效果。一般来说,淡水养殖水体的pH 变化范围为6.8~8.5[26],可见该菌的发酵产物在淡水养殖水体中应用具有较好的酸碱适应性。本次试验为进一步研究开发水霉病生防菌剂提供了优质菌种资源和基础研究数据,后续试验还将对该菌株的防治效果进行测定,以期为该菌开发为新型生物菌剂奠定基础。
