三磷腺苷合酶抑制因子1基因敲除对小鼠巨噬细胞线粒体功能和三磷腺苷水平的影响
2019-06-14于晓晴钟根深熊熙文梁银明章小英叶建平
于晓晴,钟根深,熊熙文,梁银明,王 辉,章小英,叶建平
(1.新乡医学院医学检验学院,河南 新乡 453003;2.河南省分子诊断与医学检验技术协同创新中心,河南 新乡 453003;3.新乡医学院医学法医学院,河南 新乡 453003;4.上海交通大学第六人民医院中心实验室,上海 201306)
细胞内三磷腺苷(adenosine triphosphate,ATP)主要在线粒体内合成,是细胞维持多种生命活动的能源[1-2]。线粒体合成ATP依赖三羧酸循环和氧化磷酸化(oxidative phosphorylation,OXPHOS)。三羧酸循环是葡萄糖和脂肪酸释放能量的关键步骤,糖酵解产生的丙酮酸和脂肪酸经β氧化产生的乙酰辅酶A均需经过三羧酸循环为呼吸链提供电子,推动OXPHOS反应,合成ATP[1]。线粒体呼吸链的H+-ATP合酶具有合成和水解ATP 2种活性,参与细胞内ATP水平的调节。在心肌细胞和肝脏细胞中,H+-ATP合酶活性受线粒体ATP酶抑制因子1(ATPase inhibitory factor 1,ATPIF1)的调节,其分子机制是ATPIF1作用于H+-ATP合酶的F1区域,抑制ATP合酶的合成和水解功能[3-4]。这种调节的生物学意义是既防止ATP过度合成,也避免ATP过度水解消耗,从而维持细胞内ATP的动态平衡。在转基因小鼠肝细胞中,通过过表达ATPIF1基因增加ATPIF1基因的活性,引起H+-ATP合酶活性减弱,细胞内ATP水平降低[5]。此外,ATPIF1通过抑制ATP合成,可增加活性氧(reactive oxygen species,ROS)的产生,触发细胞应激反应[6-8]。但是,ATPIF1的这些作用在巨噬细胞中还未见报道。本课题组前期研究结果表明,ATPIF1基因敲除增加了转基因小鼠成纤维细胞中的ATP水平,也促进成纤维细胞向脂肪细胞的分化[9],但ATPIF1基因敲除对巨噬细胞代谢的影响尚不清楚。本实验通过检测细胞内ATP水平、氧耗量、三羧酸循环基因表达等指标,比较ATPIF1基因敲除小鼠和野生型(wide type,WT)小鼠巨噬细胞氧化磷酸化相关指标的区别,探讨ATPIF1基因敲除对小鼠骨髓来源巨噬细胞(bone marrow derived macrophages,BMDM)内ATP水平的影响及调节机制,确定ATPIF1基因调节巨噬细胞能量代谢的作用。
1 材料与方法
1.1 实验动物WT雄性C57BL/6健康小鼠5只(WT组),8~10周龄,体质量25~27 g;雄性ATPIF1基因敲除小鼠5只(KO组),8~10周龄,体质量26~31 g。小鼠均由新乡医学院动物实验中心提供。小鼠饲养在无特定病原体级环境中,12 h 明暗交替,环境温度22~26 ℃,湿度40%~60%,低脂饲料喂养,自由摄食和饮水。
1.2 主要试剂与仪器达尔伯克改良伊戈尔培养基(Dulbecco′s modified Eagle medium,DMEM)购自美国HyClone公司,胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)购自美国PepTech公司,脂多糖(lipopolysaccharides,LPS)干粉购自美国Sigma公司,红细胞裂解液、ATP检测试剂盒购自上海碧云天生物技术有限公司,线粒体压力试剂盒购自美国安捷伦科技有限公司,TRIzol、反转录试剂盒和SYBR green荧光染料购自大连宝生物工程有限公司;酶标仪购自美国Bio-Rad公司,4 ℃低温离心机购自美国Eppendorff公司,Seahorse XFe24细胞能量代谢分析仪购自美国安捷伦科技有限公司。
1.3 小鼠BMDM的获取与培养2组小鼠均使用100 g·L-1水合氯醛麻醉,脱颈处死,取双侧股骨与胫骨,在超净台内用体积分数75%乙醇浸泡3 min,小心剔除肌肉组织,完整暴露骨质,用磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗干净。切断骨质两端暴露骨髓腔,用1 mL注射器吸取低糖型DMEM冲洗出骨髓。获得的骨髓冲洗液经 1 000 r·min-1离心5 min,弃上清液,用3 mL 1×红细胞裂解液重悬细胞,冰上孵育5 min,每分钟摇晃1次离心管,去掉红细胞。加入10 mL PBS终止去红细胞反应,经1 000 r·min-1离心5 min,弃上清液,获得纯化的骨髓细胞。用含1 g·L-1低糖DMEM、 10 μg·L-1M-CSF、体积分数10%FBS和体积分数1%双抗的低糖完全培养基重悬细胞,并转移至培养皿中,在体积分数5%CO2、37 ℃环境下培养,分别在第3、5天更换新鲜培养基,第7天获得成熟的BMDM。
1.4 细胞处理成熟的BMDM用含4.5 g·L-1葡萄糖DMEM、体积分数10%FBS和体积分数1%双抗的高糖完全培养基在6孔细胞培养板中培养,每孔使用2.5 mL高糖完全培养基,培养24 h后,留取未经LPS刺激的细胞作为基础状态组,其余每孔加入25 μL浓度为 100 mg·mL-1的LPS分别刺激细胞2、4 h,用于进行下一步实验。
1.5 BMDM内ATP水平检测将6孔细胞培养板置于冰上,用预冷的PBS洗2次,每孔加入80 μL预冷的细胞裂解液,用细胞刮收集巨噬细胞,转至1.5 mL的EP管中,置于冰上继续裂解30 min,4 ℃ 12 000 r·min-1离心10 min,取上清液,采用ATP检测试剂盒检测上清液中ATP水平,操作步骤严格按照试剂盒说明书进行。
1.6 线粒体氧消耗率(oxygen consumption rate,OCR)检测在荧光探针传感器板中,每孔加入 1 mL 海马仪水化液,置于37 ℃无CO2的培养箱孵育过夜;并将诱导成熟的BMDM按照每孔5×105个细胞铺在Seahorse细胞板中,置于细胞培养箱中培养过夜。实验开始前将细胞板中培养基换为上机检测液,于37 ℃无CO2的培养箱中培养30 min。取出活化好的荧光探针传感器板,在加药仓中加入相应所需药物:A孔每孔加入 10 μmol·L-1寡霉素 56 μL,B孔每孔加入20 μmol·L-1解偶联剂即三氟甲氧基苯腙羰基氰化物[carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone,FCCP]62 μL。加药以后将荧光探针传感器板放入Seahorse YFe24细胞能量代谢分析仪中,通过荧光探针传感器板先平衡好机器的温度和pH。平衡完成后,用已经处理好的海马细胞培养板替换下探针板,按照试剂盒说明书操作步骤检测线粒体的氧耗率。加入寡霉素后检测结果为细胞的基础氧耗量;加入寡霉素后减少的氧耗量为机体用于ATP合成的氧耗量;加入FCCP后的氧耗量为线粒体的最大氧耗量。
1.7 实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)检测三羧酸循环相关酶mRNA表达水平根据试剂盒说明书,用TRIzol试剂从细胞中提取和纯化总RNA。利用反转录试剂盒,将1 μg RNA反转录成cDNA,随后用SYBR Green qPCR Master Mix进行qRT-PCR反应,检测丙酮酸激酶(pyruvate kinase,PKm)、异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)、柠檬酸合酶 (citrate synthase,CS)、α-酮戊二酸脱氢酶(α-oxoglutarate dehydrogenase complex,OGDC)mRNA表达;反应体系为20 μL,体系包括SYBR Green Master Mix、cDNA模板、配对引物和无RNA酶H2O。磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)上游引物序列为5′-GACGGCCGCATCTTCTTGT-3′,下游引物序列为5′-CACACCGACCTTCACCATTTT-3′;PKm上游引物序列为5′-CTCTGGGCTTTGCTT-CTGTA-3′,下游引物序列为5′-AGTCAGGAGACA-AAAGA-3′;IDH上游引物序列为5′-CTCCTGTGAC-CCAGCCTAA-3′,下游引物序列为5′-ACCGTTT-GGATTTCTGCTGA-3′;CS上游引物序列为5′-GTCCTCTCTCAGCAGGTC-3′,下游引物序列为5′-ACTATCTTCTGACCTTGG-3′;OGDC上游引物序列为5′-GAACAGAACCCTATGTGGCT-3′,下游引物序列为5′-AGGAGTAGTTTCATCTTGCTA-3′。以GAPDH为内参,WT组基础表达量为参照值“1”,使用2-△△Ct法计算目的基因相对表达量。

2 结果
2.1 2组小鼠BMDM内ATP水平比较结果见表1。在基础状态下,KO组小鼠BMDM内ATP水平显著高于WT组,差异有统计学意义(P<0.05);LPS刺激2、4 h后,KO组小鼠BMDM内ATP水平显著高于WT组,差异有统计学意义(P<0.05)。
表1 WT组和KO组小鼠BMDM内ATP水平比较


nATP/(μmol·L-1)LPS2 hLPS4 hWT533.52±0.343.04±0.208.40±0.54KO544.55±1.7222.84±1.4628.87±1.85t-1.870-2.761-2.481P0.0470.0110.017
2.2 2组小鼠BMDM内OCR比较结果见表2。基础状态下,KO组小鼠BMDM内基础氧耗量、用于ATP合成的氧耗量和最大氧耗量均显著高于WT组,差异有统计学意义(P<0.01);LPS刺激2、4 h,KO组小鼠BMDM内基础氧耗量、用于ATP合成的氧耗量和最大氧耗量均显著高于WT组,差异有统计学意义(P<0.01)。
表2 WT组和KO组小鼠BMDM内OCR比较

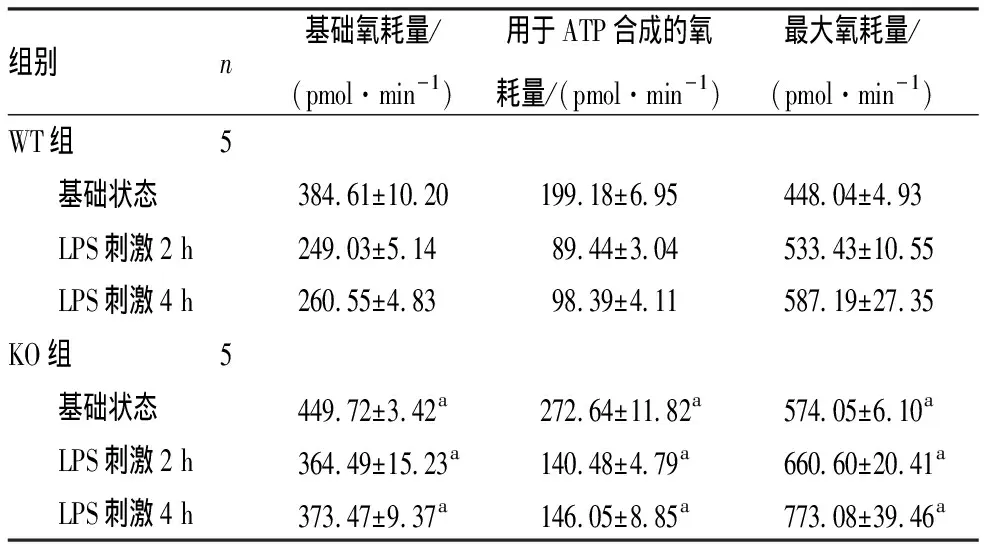
n/(pmol·min-1)ATP/(pmol·min-1)/(pmol·min-1)WT5 384.61±10.20199.18±6.95448.04±4.93 LPS2 h249.03±5.1489.44±3.04533.43±10.55 LPS4 h260.55±4.8398.39±4.11587.19±27.35KO5 449.72±3.42a272.64±11.82a574.05±6.10a LPS2 h364.49±15.23a140.48±4.79a660.60±20.41a LPS4 h373.47±9.37a146.05±8.85a773.08±39.46a
注:与WT组比较aP<0.05。
2.3 2组小鼠BMDM内三羧酸循环相关酶的mRNA相对表达量比较结果见表3。在基础状态下,KO组小鼠BMDM内三羧酸循环相关酶PKm、IDH、CS、OGDC mRNA相对表达量均高于WT组,差异有统计学意义(P<0.01)。LPS诱导2、4 h后,KO组小鼠CS、OGDC mRNA相对表达量高于WT组,差异有统计学意义(P<0.05);PKm、IDH mRNA相对表达量与WT组比较差异无统计学意义(P>0.05)。
表3 WT组和KO组小鼠BMDM内三羧酸循环相关酶mRNA相对表达量比较

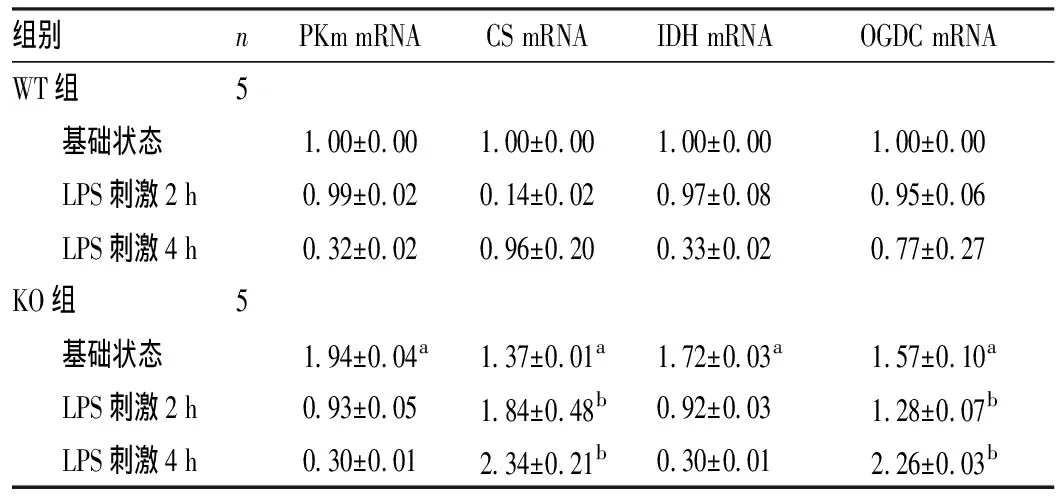
nPKm mRNACS mRNAIDH mRNAOGDC mRNAWT5 1.00±0.001.00±0.001.00±0.001.00±0.00 LPS2 h0.99±0.020.14±0.020.97±0.080.95±0.06 LPS4 h0.32±0.020.96±0.200.33±0.020.77±0.27KO5 1.94±0.04a1.37±0.01a1.72±0.03a1.57±0.10a LPS2 h0.93±0.051.84±0.48b0.92±0.031.28±0.07b LPS4 h0.30±0.012.34±0.21b0.30±0.012.26±0.03b
注:与WT组比较aP<0.01,bP<0.05。
3 讨论
ATPIF1是线粒体H+-ATP合酶的主要调节蛋白,其活性受磷酸化修饰调节[10-11]。研究表明,在小鼠心肌细胞和神经细胞中,ATP需求增加时,ATPIF1蛋白磷酸化水平增加,蛋白活性降低,从而提高H+-ATP合酶催化功能,线粒体产生ATP增加[3]。cAMP依赖蛋白激酶(protein kinase A,PKA)是目前已知唯一的ATPIF1磷酸化酶,在细胞能量需求增加时被激活,通过磷酸化ATPIF1提高H+-ATP合酶的催化作用[12]。在能量需求低时,ATPIF1蛋白磷酸化水平降低,蛋白活性增加,从而减少线粒体合成ATP。ATPIF1也过表达于结肠癌、乳腺癌、肺癌等大多数常见肿瘤中,肿瘤中高表达的ATPIF1处于去磷酸化活跃状态,可以抑制三羧酸循环并增强糖酵解,减少ATP的合成,促进肿瘤发生、发展[13-14]。ATPIF1通过抑制H+-ATP合酶的合成和分解,在细胞应激条件下加剧线粒体损伤,促进细胞凋亡。当呼吸链活动下降时,如药物毒性引起的细胞反应,会导致线粒体膜电位下降,这时,H+-ATP合酶可通过水解ATP,维持线粒体膜电位,保护细胞[12,15]。如果ATPIF1被激活,可降低H+-ATP合酶的这种保护作用,从而增加细胞损伤。文献提示,ATPIF1在肌肉、神经和肿瘤细胞中通过调控线粒体功能来调节ATP水平[3,13-14],但其在巨噬细胞中的功能还不清楚。本研究通过对ATPIF1基因敲除小鼠BMDM的分析发现,ATPIF1基因敲除后BMDM内ATP水平明显升高,提示ATPIF1在巨噬细胞中也发挥调节作用。
有文献报道,在肿瘤细胞和转基因小鼠中,过表达ATPIF1基因可降低肿瘤细胞和神经细胞内ATP水平[7,15]。本课题组的前期研究发现,ATPIF1基因敲除小鼠成纤维细胞内ATP水平升高,并促进其向脂肪细胞分化,分化过程中细胞内三酰甘油含量明显增加[9]。本研究结果显示,在基础状态和LPS刺激下KO组小鼠BMDM内ATP水平、基础氧耗量和最大氧耗量均高于WT组。在基础状态下,KO组三羧酸循环功能提高,表现为CS、OGDC、PKm、IDH mRNA相对表达量高于WT组。在LPS诱导2、4 h时,KO组小鼠BMDM内CS和OGDC mRNA相对表达量高于WT组。这些结果表明,在基础状态和LPS刺激的应激状态下,ATPIF1基因敲除提高了巨噬细胞内ATP水平,其作用机制是增加线粒体功能,包括提高三羧酸循环和呼吸链运转水平,增加ATP合成。
LPS会引发促炎性免疫反应,这不仅能够清除入侵的致病原,还会导致线粒体功能障碍,对宿主组织造成损伤,因此,在必要时抑制LPS诱导的过激炎症反应是很重要的[16]。ATPIF1基因敲除对巨噬细胞免疫功能的影响还未见报道,本研究结果显示,在基础状态和应激状态下,ATPIF1基因敲除小鼠BMDM内ATP水平均高于WT组,而ATP能参与调节炎症过程,这已经在免疫细胞和非免疫细胞中被证实[17-19]。ATP被释放到细胞外后,成为细胞外ATP(extracellular adenosine triphosphate,eATP),通过与细胞膜上的特异腺苷受体相互作用,调节细胞因子分泌[16]。在巨噬细胞中,eATP通过介导NLRP3的活化,促进炎症小体的聚集和炎性因子(白细胞介素-1和白细胞介素-18)的释放[20]。本课题组前期研究结果表明,细胞内ATP(intracellular adenosine triphosphate,iATP)可通过激活丝氨酸激酶诱导细胞因子表达[19]。本研究结果表明,在基础状态和LPS刺激2、4 h,KO组小鼠BMDM内基础氧耗量、用于ATP合成的氧耗量和最大氧耗量均高于WT组,提示ATPIF1基因敲除可提高巨噬细胞线粒体抵抗LPS毒性的能力。
综上所述,ATPIF1基因敲除可通过促进小鼠巨噬细胞中三羧酸循环活动,提高线粒体合成ATP水平和线粒体OXPHOS水平,增强巨噬细胞功能。
