高糖诱导内皮-脂肪细胞转分化的机制探讨
2019-06-11倪利华宋凯云朱冬冬王立婷张玉霞汪晓晨刘必成汤日宁
倪利华 宋凯云 朱冬冬 王立婷 张玉霞 汪晓晨 刘必成 汤日宁*
1.东南大学附属中大医院,东南大学附属中大医院溧水分院肾内科,江苏 南京 210009 2.上海长海医院,上海 200000
糖尿病(diabetes mellitus,DM)是全身系统性疾病,据国际糖尿病联盟统计,2014年全球糖尿病患者已达3.8亿,其中80%在发展中国家,中国位列第一[1]。骨质疏松症是DM的常见并发症,表现为骨量减少,骨折风险增加,影响骨的修复和再生[2]。流行病学研究发现,DM患者骨折风险较非糖尿病人群显著增加,尤其1型糖尿病患者髋骨骨折风险是正常人群的10倍[3-4]。因此,深入探讨DM骨质疏松的发生机制,对于积极防治DM骨折等并发症具有十分重要的意义。越来越多证据表明骨髓脂肪组织在DM骨质疏松发生发展中起着关键作用[5-7]。最新研究发现,一定条件下内皮细胞(endothelial cells,ECs)可发生内皮-间充质转分化(endothelial-to-mesenchymal transition,EndMT),可进一步分化为脂肪细胞,即内皮-脂肪细胞转分化[8]。本课题前期研究发现,高糖能诱导内皮细胞发生EndMT[9-11]。因此,本研究拟通过动物和细胞实验,探讨高糖能否刺激ECs发生EndMT并进一步转化为脂肪细胞,参与DM骨质疏松的形成和发展。
1 材料与方法
1.1 实验动物、细胞及材料
1.1.1动物:8周龄SPF级SD雄性大鼠,体重180~220 g,购于上海莱斯克公司。
1.1.2细胞:原代人主动脉ECs(美国ScienCell公司)。
1.1.3材料:内皮细胞培养基(美国ScienCell公司);诱导成脂细胞培养基(美国ScienCell公司);葡萄糖(美国sigma公司);油红O工作液(中国武汉塞维尔生物公司);CD31抗体(sc-376764,美国Santa Cruz公司);FSP1抗体(ab-197896,美国Abcam公司);PPAR-γ抗体(ab-209350,美国Abcam公司);光学显微镜、激光共聚焦显微镜(日本Olympus公司);micro-CT(德国Bruker公司);双能X线骨密度检测仪(美国HOLOGIC公司)。
1.2 方法
1.2.1动物模型制备:SD大鼠适应性喂养1周,禁食12 h,链脲佐菌素58 mg/kg一次性腹腔注射制备DM模型,72 h后尾静脉采血测定血糖,血糖>16.7 mmol/L为造模成功。随机分为2组:对照组(control,CTL)和糖尿病组(DM),各10只。继续喂养24周后处死大鼠,留取血尿、骨骼样本。
1.2.2细胞培养和分组:ECs置于含10%FBS和1%青链霉素的内皮细胞培养基中,于37 ℃,5% CO2细胞培养箱中培养。选择第2~5代细胞进行实验。使用高糖(high glucose,HG,30 mmol/L)或正常糖(normal glucose,NG,5.5 mmol/L)干预ECs 48 h,继而更换培养基为诱导成脂分化培养基培养1周。
1.2.3骨组织HE染色、免疫荧光:分离各组大鼠左侧股骨,于4%多聚甲醛中固定48 h、10% EDTA脱钙、常规脱水、透明、浸蜡、包埋、切片,贴附于载玻片上,HE染色,在普通光学显微镜下观察脂肪细胞(空泡结构)的数量;将3 μm股骨石蜡切片脱蜡、水化、抗normal glucose,原修复,内源性过氧化酶阻断剂(福州迈新)阻断,加入相应一抗,4 ℃过夜。次日加入相应荧光二抗(避光,室温孵育2 h),DAPI染细胞核5 min。激光共聚焦显微镜下观察各蛋白的表达。
1.2.4Western印迹检测:取骨骼及细胞组织,加适量裂解液匀浆,离心取上清液,提取蛋白,BCA检测蛋白浓度。取20 μg蛋白变性后SDS-PAGE凝胶电泳,湿法转入PVDF膜,5% BSA封闭1 h后加入相应一抗,4 ℃过夜。次日洗膜后加入相应二抗,室温孵育1 h,洗膜,ECL化学发光法曝光。
1.2.5油红O染色:4%多聚甲醛固定细胞20 min,水洗后加入油红O工作液5 min,水洗后苏木素染细胞核1 min,水洗后尽快光镜下观察,拍照。
1.2.6双能X线检测:双能X线骨密度检测各组大鼠腰椎和股骨的骨密度。使用双能X线骨密度仪(检测地址为南京中大医院影像科)进行骨扫描,计算机自动分析骨密度。
1.2.7micro-CT检测:使用micro-CT对大鼠股骨进行扫描(检测地址为南京医科大学江苏省医药动物实验基地)。扫描结束后将原始扫描图像导入microCT系统自带的NRecon重建软件中,对重建图像进行分析,使用CtAnalyser(SkyScan 软件)分析骨相关参数。
1.3 统计学分析
2 结果
2.1 各组大鼠体重、生化参数等变化
DM组与CTL组相比,血糖、血肌酐、尿素氮、24 h尿蛋白升高,体重降低,P值均 < 0.05;两组大鼠血钙和血磷未见明显变化(P>0.05)。见表1。
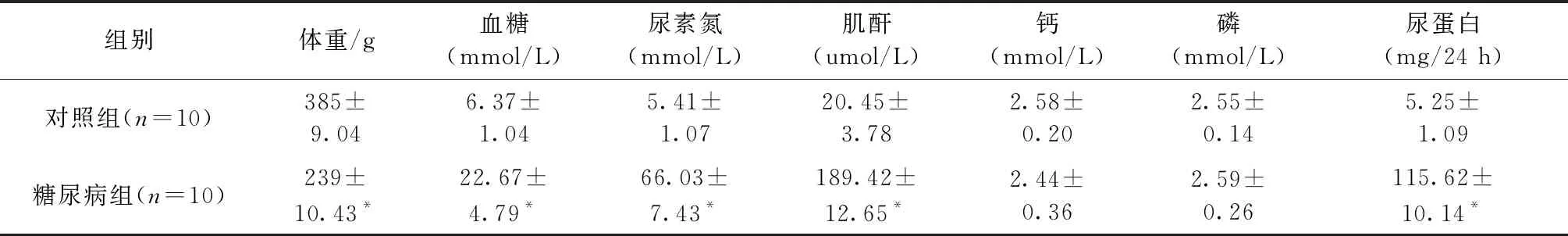
表1 各组大鼠的一般资料Table 1 The general parameters of rats in each group
注:与对照组相比,*P<0.05。
2.2 各组大鼠骨骼参数变化
双能X线骨密度检测示,DM组大鼠腰椎和股骨骨密度均低于CTL组(P<0.05)。见表2。股骨micro-CT扫描示,DM组远端股骨骨体积分数和骨小梁数目减少,骨小梁离散度增加(P<0.05);股骨干皮质骨厚度、皮质骨面积无明显改变(P>0.05)。见表3。
表2各组大鼠的骨密度检测(g/cm2)
Table2Bone mineral density tests of rats in each group(g/cm2)
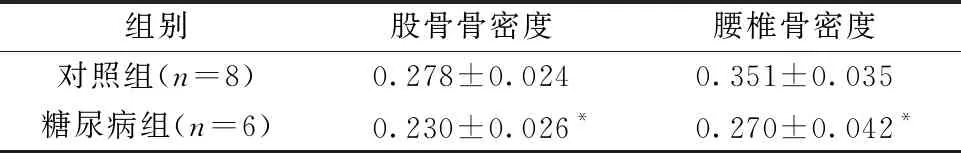
组别股骨骨密度腰椎骨密度对照组(n=8)0.278±0.0240.351±0.035糖尿病组(n=6)0.230±0.026*0.270±0.042*
注:与对照组相比,*P<0.05。

表3 各组大鼠的micro-CT检测Table 3 Micro-CT analysis of rats in each group
注:与对照组相比,*P<0.05。
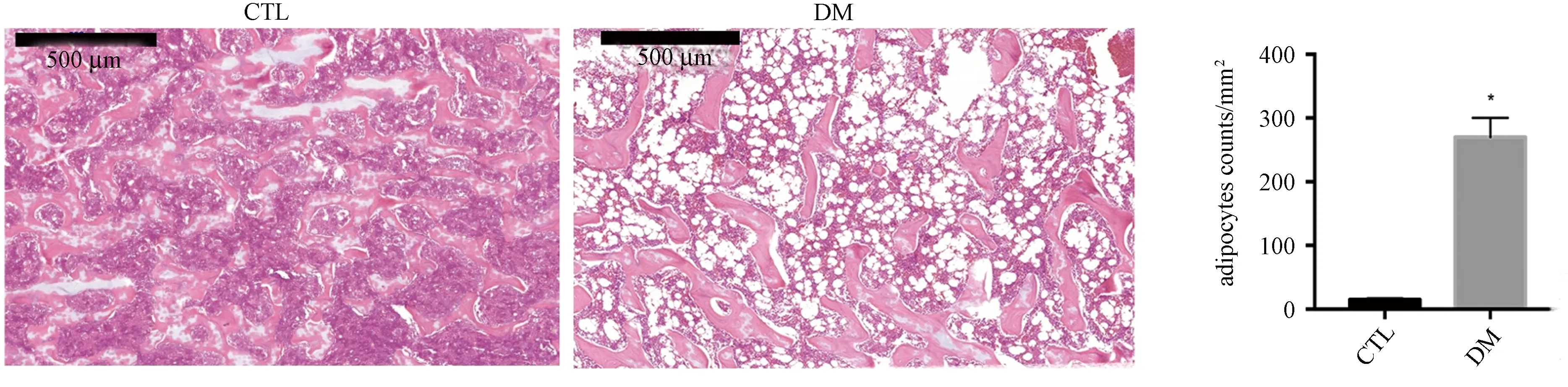
图1 各组大鼠胫骨HE染色及脂肪含量分析(HE染色的骨髓空泡结构为脂肪细胞)Fig.1 HE staining of the tibias and quantification of the bone fat(bone marrow vacuoles with H&E stain indicated adipocytes)
2.3 各组大鼠骨髓脂肪组织变化
骨组织HE染色时骨髓空泡结构示脂肪细胞。如图1所示,DM组大鼠骨髓腔内充满脂肪细胞,其脂肪组织含量较CTL组显著增多(P<0.05)。
2.4 各组大鼠骨髓ECs EndMT的影响
以内皮标记物CD31和间充质标志物FSP1作为检测EndMT的指标。Western印迹示,与CTL组相比,DM组CD31表达减少,FSP1表达增多(P>0.05);骨组织荧光结果示,DM组骨髓CD31和FSP1存在表达重叠。见图2。
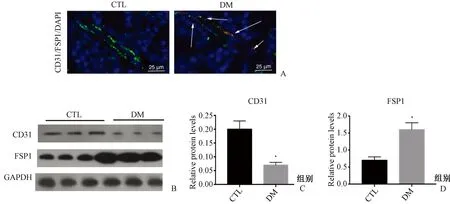
图2 各组大鼠骨髓CD31和FSP1的表达情况 A:大鼠骨组织共聚焦显微镜检测免疫荧光,白色箭示骨髓CD31和FSP1存在共表达情况;B~D:CD31和FSP1蛋白的表达(Western印迹)。Fig.2 The protein expression of bone marrow CD31 and FSP1 of rats in each group. A: Immunofluorescence was detected by confocal microscopy in rat bone tissues. White arrow showed co-expression of CD31 and FSP1 in bone marrow. B-D: The protein expression of CD31 and FSP1 (Western blotting).
2.5 体外高糖干预对ECs EndMT的影响
NG(5.5 mmol/L)和HG(30 mmol/L)分别干预ECs 48 h。Western印迹示,与NG组相比,HG组CD31蛋白表达减少,FSP1蛋白表达增加(P<0.05);激光共聚焦显微镜结果示,HG组细胞CD31表达减少,并获得性表达FSP1。见图3。
2.6 体外高糖干预可促进ECs进一部分化为脂肪细胞
ECs分别给予NG或HG干预48 h,继而使用脂肪细胞培养基诱导分化1周。Western印迹结果示,HG组脂肪细胞标志物PPAR-γ蛋白表达显著高于NG组(P<0.05),油红O染色阳性,见图4。
3 讨论
研究发现,异常升高的血糖水平是DM骨质疏松发生的独立危险因素,降低血糖治疗能显著改善患者骨代谢情况[12]。DM往往伴随一定程度的骨质疏松,制约患者的生活质量,但是潜在机制仍不十分清楚。
既往人们普遍认为,DM骨质疏松与高糖、氧化应激、晚期糖基化产物形成、炎症因子释放等有关[6]。近年来研究表明,骨髓脂肪组织参与了DM骨质疏松的形成和发展[5-7]。异常增多的骨髓脂肪细胞能引起骨质疏松,可能与以下3个方面有关[13]:(1)骨髓脂肪细胞能分泌一些细胞因子,影响成骨细胞和破骨细胞功能;(2)骨髓脂肪细胞和成骨细胞均主要来源于骨髓间充质干细胞,脂肪细胞的增多必然导致骨髓成骨细胞合成减少;(3)脂肪因子(如瘦素、脂联素等)通过交感神经系统调控骨的形成。研究证实[14-15],减少骨髓脂肪组织合成的靶向治疗能促进骨形成。本研究发现,相较于CTL组,DM组大鼠存在明显的骨质疏松,并伴随骨髓脂肪细胞显著增多。故探讨异常增多的骨髓脂肪细胞来源成为深入理解DM骨质疏松机制的关键。
目前,关于骨髓脂肪组织来源的研究主要集中在骨髓间充质干细胞[16]。随着研究的深入,人们逐渐发现内皮细胞一定条件下也能转化为脂肪细胞,成为骨髓脂肪细胞的重要来源[8]。2010年,Medici等[8]使用BMP-2和BMP-4干预脐静脉内皮细胞48 h,内皮细胞发生EndMT,且获得间充质干细胞特性,继而在脂肪诱导环境下表达脂肪细胞表型。这提示ECs可能通过EndMT形成脂肪细胞,直接参与了骨质疏松的过程。其后Horwits等[17]也指出ALK2能刺激ECs发生EndMT,可进一步诱导形成软骨和成骨细胞,参与骨再生和重建。Lin等[18]发现BMP4能促进内皮-成骨细胞转分化,参与前列腺癌骨转移。笔者前期研究[9]发现,高糖可诱导ECs发生EndMT,表现为内皮细胞标志物CD31表达减少,间充质标志物FSP1表达增加。本研究发现,DM组大鼠较CTL组骨髓CD31蛋白表达减少,FSP1蛋白表达增加(P<0.05);骨组织荧光可见DM组骨髓CD31和FSP1表达重叠,这些均提示DM大鼠骨髓EndMT的发生;进一步体外高糖干预ECs 48 h,与NG组相比,HG组CD31蛋白表达减少,FSP1蛋白表达增加(P<0.05);对高糖刺激的ECs诱导成脂分化1周发现,HG组细胞脂肪细胞标志物PPAR-γ蛋白表达增加(P<0.05),油红O染色阳性,以上提示发生EndMT的ECs能够进一步分化为脂肪细胞(内皮-脂肪细胞转分化),促进脂肪样细胞在骨髓堆积,介导DM骨质疏松。
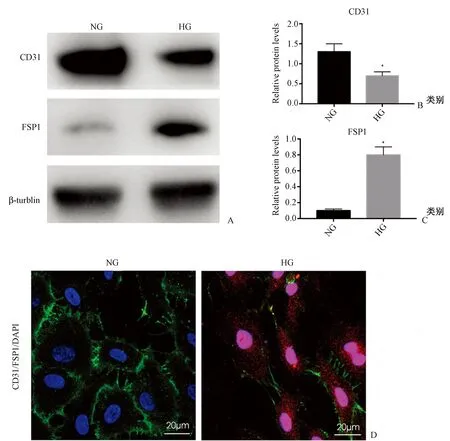
图3 高糖干预ECs的CD31、FSP1蛋白表达变化 A~C:CD31和FSP1蛋白的表达(Western 印迹);D:细胞共聚焦免疫荧光双染(1000倍)Fig.3 The protein expression of CD31 and FSP1 in cultured ECs after high glucose stimulation. A-C: CD31 and FSP1 protein expression (Western blotting); D: immunoflurescence double staining observed with confocal scanning microscope (1000 times).
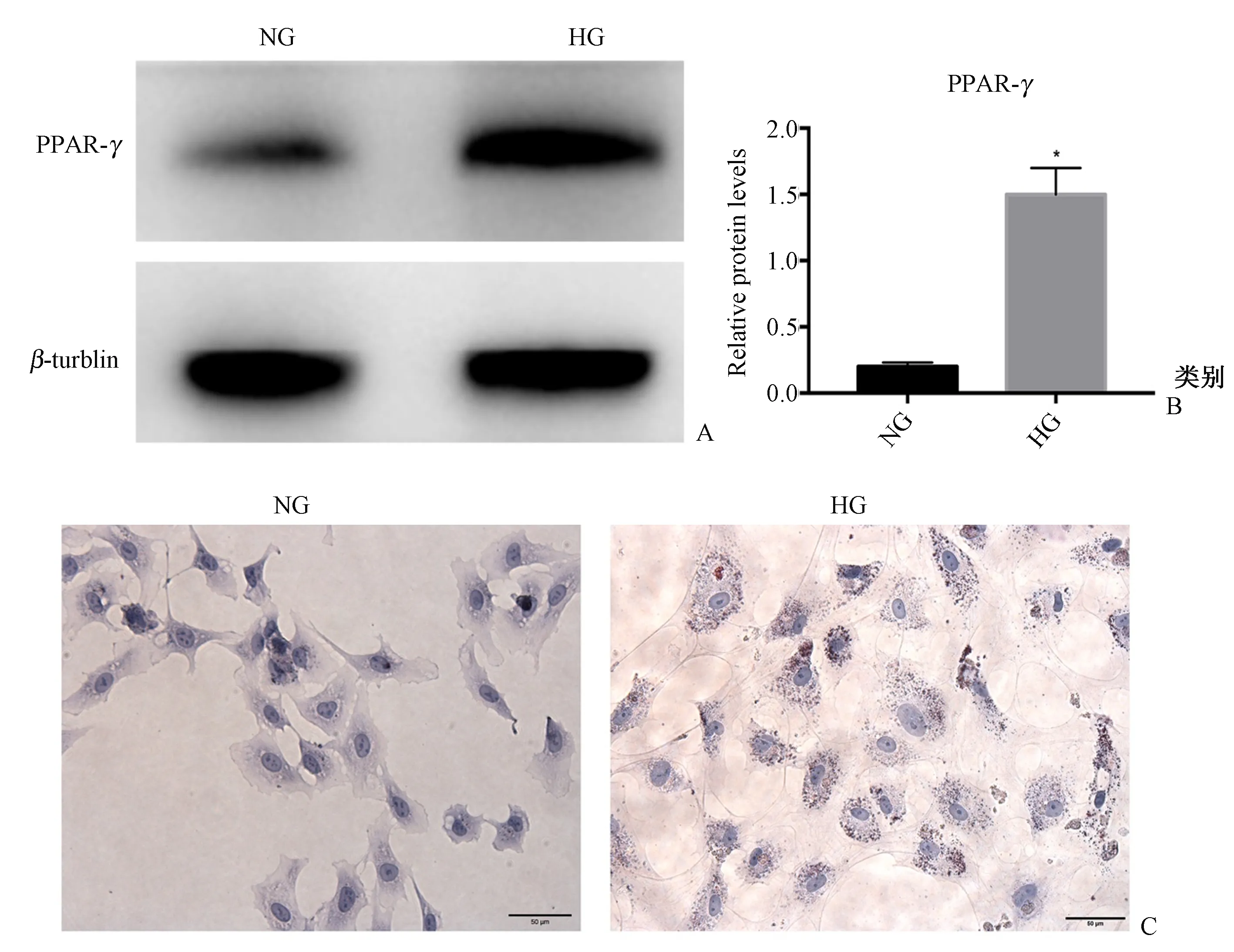
图4 经脂肪细胞培养基培养1周后ECs向脂肪细胞转分化 A、B:PPAR-γ蛋白的表达(Western印迹);C:细胞油红O染色(200倍)Fig.4 The ECs were transformed into adipocytes after cultured in adipogenic medium for one week. A, B:Expression of PPAR-γ protein (Western blotting); C: Oil red O staining (200 times).
总而言之,本研究结果证实,高糖可诱导ECs发生EndMT,可进一步诱导分化为脂肪细胞(内皮-脂肪细胞转分化),参与DM骨质疏松的发生和发展。
