不同月龄肉羊肌内结缔组织中Ⅴ型胶原蛋白的特性
2019-06-10薛文俊曹欣宇吴琼云月英乌日罕贺喜格包旺山格日勒图
薛文俊 曹欣宇 吴琼 云月英 乌日罕 贺喜格 包旺山 格日勒图

摘 要:采用自然放牧条件下的6、9、12、18 月龄乌珠穆沁羊,取其半腱肌(Semitendinosus,ST)和背最长肌(Longissimus dorsi,LD),提取并分离纯化肌内结缔组织中的Ⅴ型胶原蛋白。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、热变性温度和氨基酸组成分析,比较各月龄段肉羊不同部位中Ⅴ型胶原蛋白的特性。结果表明:Ⅴ型胶原蛋白主要由α1(Ⅴ)、α2(Ⅴ)、α3(Ⅴ) 3 种亚基组成;ST和LD肌内结缔组织中Ⅴ型胶原蛋白的含量随着月龄的增长而增加,且各月龄间差异显著(P<0.05);在同一月龄段,ST肌内结缔组织中Ⅴ型胶原蛋白的含量高于LD;FTIR分析表明,各月龄段ST和LD肌内结缔组织中的Ⅴ型胶原蛋白均出现了主要吸收峰酰胺A、B及酰胺Ⅰ、Ⅱ、Ⅲ;ST肌内结缔组织中Ⅴ型胶原蛋白的热变性温度随着月龄的增长而显著升高(P<0.05),但9、12 月龄间无显著差异(P>0.05);LD肌内结缔组织中Ⅴ型胶原蛋白的热变性温度随着月龄的增长而升高,但9、12 月龄及12、18 月龄间无显著差异(P>0.05),其他月龄均差异显著(P<0.05);氨基酸组成分析结果表明,Ⅴ型胶原蛋白的总氨基酸、亚氨基酸及羟脯氨酸含量随着月龄的增长而呈上升趋势,且各月龄间有显著差異(P<0.05)。本研究解释了随着肉羊月龄的增加,其骨骼肌肌内结缔组织中Ⅴ型胶原蛋白的特性变化。
关键词:乌珠穆沁羊;Ⅴ型胶原蛋白;变性温度;氨基酸
Abstract: A comparative characterization of the type Ⅴ collagens extracted from the intramuscular connective tissues of Semitendinosus (ST) and Longissimus dorsi (LD) muscles in naturally grazed Ujimqin sheep aged 6, 9, 12 and 18 months was performed by sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE), Fourier transform infrared spectroscopy (FTIR), thermal denaturation temperature and amino acid composition analysis. The results showed that the type Ⅴ collagens consisted of three different subunits (α1(Ⅴ), α2(Ⅴ) and α3(Ⅴ)). For both muscles, the content of type Ⅴ collagen was increased significantly (P < 0.05) with age. At each age group, the content of type Ⅴ collagen in ST was higher than in LD. FTIR analysis showed the amide A, B, Ⅰ, Ⅱ and Ⅲ absorption bands of the type Ⅴ collagens in ST and LD muscles at each age group. The denaturation temperature of type V collagen in ST was significantly increased with age(P < 0.05), although no significant difference (P > 0.05) was observed between 9- and 12- month-old sheep. The Td of type Ⅴ collagen in LD was increased with age (P > 0.05), except that there was no significant difference between 9 and 12 months and between 12 and 18 months of age. Amino acid analysis indicated that total amino acid content and imino acid contents (hydroxyproline and proline) were significantly increased with age (P < 0.05). This study provides a theoretical foundation for explaining the effect of collagen on meat quality.
Keywords: Ujimqin sheep; type Ⅴ collagen; thermal denaturation temperature; amino acidDOI:10.7506/rlyj1001-8123-20190117-015
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2019)03-0007-07
引文格式:
薛文俊, 曹欣宇, 吴琼, 等. 不同月龄肉羊肌内结缔组织中Ⅴ型胶原蛋白的特性[J]. 肉类研究, 2019, 33(3): 7-13. DOI:10.7506/rlyj1001-8123-20190117-015. http://www.rlyj.net.cn
XUE Wenjun, CAO Xinyu, WU Qiong, et al. Characteristics of type Ⅴ collagens in intramuscular connective tissue from sheep of different ages[J]. Meat Research, 2019, 33(3): 7-13. DOI:10.7506/rlyj1001-8123-20190117-015. http://www.rlyj.net.cn
家畜肌肉硬度有固有硬度和尸僵硬度,其中固有硬度主要来自于骨骼肌肌内结缔组织(intramuscular connective tissue,IMCT)的胶原蛋白[1]。不同品种、甚至同一品种不同年龄阶段的家畜肌肉组织中胶原蛋白的含量、热稳定性、胶原蛋白分子内和分子间的交联程度等均有很大差距。IMCT的热稳定性和机械稳定性随动物的生长而增加,这与胶原蛋白分子间共价交联的化学性质和胶原蛋白的氨基酸组成有关[2]。在幼龄动物的结缔组织中,大多数交联以不稳定的席夫碱形式存在,对酸和热不稳定,容易受到胶原蛋白酶和离子强度的变化及温度的作用而降解[3]。隨着动物的生长,可还原交联被转化为更稳定的非还原交联,结缔组织对酸和热的敏感性降低,加热后的胶原蛋白可溶性下降,降低了肌肉的嫩度[4]。研究发现,骨骼肌IMCT中主要有Ⅰ、Ⅲ、Ⅳ、Ⅴ型胶原蛋白,其中含量较多的是Ⅰ、Ⅲ型胶原蛋白[5],因此对于不同品种骨骼肌中Ⅰ、Ⅲ型胶原蛋白的研究较多[6-7],
但对于含量较少、提取过程较为复杂的Ⅴ型胶原蛋白特性的研究报道较少。Ⅴ型胶原蛋白和Ⅰ、Ⅲ型胶原蛋白均属于纤维状胶原蛋白,纤维状胶原蛋白的共同结构特征是中心有一个长的胶原结构域,含有1 000多个氨基酸,由Gly-Xaa-Yaa重复序列组成,其中Xaa和Yaa位置是任一种氨基酸(或亚氨基酸)残基[8]。当Xaa位和Yaa位均为亚氨基酸时(Gly-Pro-Pro、Gly-Pro-Hyp),胶原蛋白的热稳定性最高[9]。分析胶原蛋白氨基酸组成发现,甘氨酸含量最高,其含量随着来源的不同在28.6%~35.6%之间变化,不含色氨酸,亚氨基酸(脯氨酸和羟脯氨酸)含量较高,羟脯氨酸含量是衡量胶原蛋白热稳定性的重要指标,其含量越高,胶原蛋白的热稳定性越高[10]。本研究采用放牧饲养的不同月龄(6、9、12、18 月)的乌珠穆沁羊,提取半腱肌(Semitendinosus,ST)和背最长肌(Longissimus dorsi,LD)中Ⅴ型胶原蛋白,对其进行蛋白质含量、热变性温度、氨基酸组成及傅里叶红外光谱分析,解析骨骼肌肌内结缔组织Ⅴ型胶原蛋白的特性。这对胶原蛋白特性与肉品质的关系研究具有重要意义。
1 材料与方法
1.1 材料与试剂
样品来自内蒙古自治区锡林郭勒盟东乌珠穆沁旗,选取6、9、12、18 月龄乌珠穆沁羊,所选的各月龄肉羊是同一个羊群中年龄相同的去势公羊,每个月龄选取6 只羊作为平行。将肉羊屠宰后取半腱肌和背最长肌,适当分割后于液氮中速冻,然后存放于-80 ℃冰箱,冷冻保存备用。胃蛋白酶(1∶10 000)、N-马来乙酰胺、苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、对二甲基苯甲醛 北京索莱宝科技有限公司;三羟基氨基甲烷(Tris碱)、过硫酸铵(ammonium sulfate,APS)、四甲基乙二胺(N,N,N,N-tetramethylethylenediamine,TEMED) 美国Sigma公司;乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA) 天津市科盟化工工贸有限公司;氯胺T 国药集团化学试剂有限公司;L-羟脯氨酸 北京酷来搏科技有限公司;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
XHF-DY高速分散器 宁波新芝生物科技股份有限公司;CP-100超速离心机、L-8900全自动氨基酸分析仪 日本Hitachi公司;BG-Power电泳仪 北京白晶生物技术有限公司;DZ-3335差示扫描量热仪(differential scanning calorimeter,DSC) 南京大展机电技术有限公司;IRAffinity-1傅里叶红外光谱仪 日本Shimadzu公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限公司。
1.3 方法
1.3.1 Ⅴ型胶原蛋白的提取
参考Chandra[11]、永井裕[12]等的方法,并做适当调整。整个提取过程均在4 ℃条件下进行。样品在4 ℃条件下解冻,称取150 g骨骼肌组织,剔除肌外膜和脂肪后切碎,加入10 倍量的匀浆液(用5 mmol/L Tris-HCl缓冲液(pH 7.4)配制的10 g/100 mL NaCl),在3 000 r/min条件下匀浆30 s,此步骤重复3 次;搅拌之后离心(10 000×g,5 min),去除脂肪等其他组织,取沉淀加入10 倍量的洗净液(含10 mmol/L EDTA、10 mmol/L PMSF、12.5 μg/mL N-马来酰胺),反复冲洗5 次;10 000×g离心15 min,取沉淀加入胃蛋白酶(胃蛋白酶质量∶样品湿质量=1.5∶1),15 ℃消化48 h,100 000×g离心1 h,取上清液,加NaCl至浓度为0.7 mol/L,搅拌过夜;100 000×g离心1 h,取上清液,加NaCl至浓度为0.5 mol/L,搅拌过夜;100 000×g离心1 h,取沉淀,沉淀溶解于用0.05 mol/L Tris-HCl缓冲液(pH 7.4)配制的1.0 mol/L NaCl中;100 000×g离心1 h,取上清液,加入NaCl至浓度为4.5 mol/L,搅拌过夜;100 000×g离心1 h,取沉淀,沉淀溶解于0.1 mol/L的Hac,加NaCl至浓度为1.2 mol/L,搅拌过夜;100 000×g离心1 h,取沉淀,沉淀溶解于用0.05 mol/L Tris-HCl缓冲液(pH 7.4)配制的1.0 mol/L NaCl中,在同一个缓冲液中进行透析,100 000×g离心1 h取沉淀,沉淀即为Ⅴ型胶原蛋白。冷冻干燥后-20 ℃保存备用。
1.3.2 Ⅴ型胶原蛋白十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)分析
参考Leammli[13]的方法。采用不连续Tris-HCl/甘氨酸缓冲系统、8%的分离胶和5%的浓缩胶,称取一定量的冷冻干燥Ⅴ型胶原蛋白待测样,溶解于0.5 mol/L醋酸,與5×上样缓冲液(1 mol/L pH 6.8 Tris-HCl,50%丙三醇,β-巯基乙醇,1%溴酚蓝,10% SDS)以4∶1的比例混合,使Ⅴ型胶原蛋白的质量浓度为1 mg/mL,100 ℃水浴5 min;在10 000 r/min转速下离心10 min后取上清液,抽取15 μL分别加入加样孔,以同样的量取Marker加入样品孔,100 V恒压电泳,待指示液移到离边缘约1 cm处,停止电泳;凝胶用0.1%考马斯亮蓝R-250(含60 mL无水乙醇、14 mL冰乙酸、0.14 g考马斯亮蓝R-250、60 mL蒸馏水)进行染色,染色结束后在醋酸脱色液(含100 mL无水乙醇、30 mL冰乙酸和270 mL蒸馏水)中进行脱色,凝胶成像仪扫描分析。
1.3.3 Ⅴ型胶原蛋白含量的测定
参考Bergman等[14]的方法,并稍作调整。准确称取冷冻干燥的Ⅴ型胶原蛋白待测样30 mg置于具塞试管中,加入6 mol/L HCl,115 ℃水解12 h后加入2 mL氧化剂(含7 g/100 mL氯胺T、74% 26%异丙醇、0.629 mol/L NaOH、0.14 mol/L柠檬酸、0.453 mol/L乙酸钠和0.112 mol/L冰乙酸)充分混合,静置20 min,加入30 mL对二甲基苯甲醛(将2 g对二甲基苯甲醛溶解于3 mL 60%高氯酸,与异丙醇按3∶13的比例混合),65 ℃水浴20 min,冷却后采用紫外分光光度计于558 nm波长处测定吸光度。
1.3.4 傅里叶红外光谱检测
将2 mg冷冻干燥的Ⅴ型胶原蛋白待测样与2 mg KBr混合,研磨成粉并压制成薄片,置于傅里叶红外光谱仪内,在400~4 000 cm-1频率范围内进行扫描,分辨率为4 cm-1,扫描信号累加200 次[15]。
1.3.5 Ⅴ型胶原蛋白热变性温度的测定
准确称取冷冻干燥的Ⅴ型胶原蛋白待测样10 mg,置于铝坩埚并压实密封后以相同质量的铝坩埚为空白组,置于差式扫描热量仪内,在20~150 ℃温度范围内以1 ℃/min的速率进行测定[16]。
1.3.6 Ⅴ型胶原蛋白氨基酸组成分析
参考GB/T 5009.124—2003《食品中氨基酸的测定》[17]。将80 mg冷冻干燥的Ⅴ型胶原蛋白待测样置于具塞试管内,加入6 mol/L HCl至15 mL,抽真空封管,110 ℃水解24 h后,过滤,定容至50 mL;取1 mL减压蒸干后,加入0.02 mol/L的盐酸溶解,利用氨基酸自动分析仪测定胶原蛋白氨基酸组成。实验条件为:4.6 mm×60 mm分析柱,2622#树脂;柱温57 ℃;反应温度135 ℃。其中以柠檬酸-柠檬酸钠作为缓冲液,以茚三酮作为显色液。
1.4 数据处理
实验数据用平均值±标准差(n=3)表示。2 组间比较采用T-test检验,P<0.05表示有显著差异。采用SPSS软件对数据进行分析,傅里叶红外光谱图线采用Origin 7.0软件进行分析。
2 结果与分析
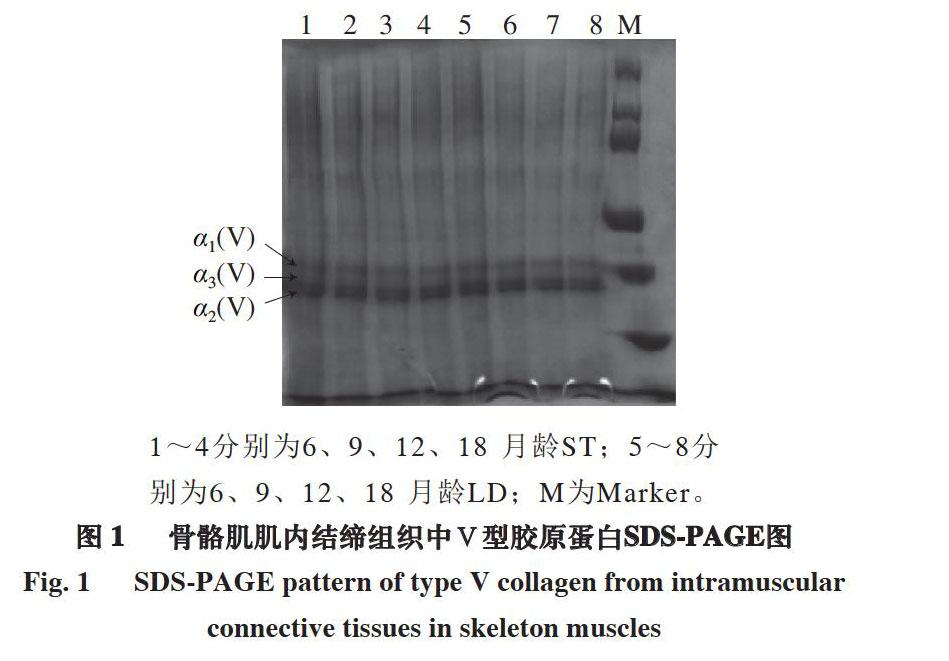
2.1 SDS-PAGE结果1~4分别为6、9、12、18 月龄ST;5~8分别为6、9、12、18 月龄LD;M为Marker。
由图1可知,Ⅴ型胶原蛋白条带清晰,均出现了3 条肽链,推测其亚基组成为α1(Ⅴ)、α2(Ⅴ)、α3(Ⅴ),符合Ⅴ型胶原蛋白的结构特征,是Ⅴ型胶原蛋白常见的一种亚型。研究发现,Ⅴ型胶原是一种含量较少、组织分布广的纤维型胶原,并且至少有4 种同分异构体,包括2α1(Ⅴ)α2(Ⅴ)、α1(Ⅴ)α2(Ⅴ)α3(Ⅴ)、3α3(Ⅴ)、Ⅴ型胶原蛋白α链和Ⅺ型胶原蛋白α链的混合[18]。不同月龄、不同骨骼肌中Ⅴ型胶原蛋白3 种肽链呈现出相同的分子质量,条带及其颜色深浅差别不大。
2.2 骨骼肌肌内结缔组织中Ⅴ型胶原蛋白的含量
大写字母不同,表示同一肌肉部位、不同月龄间差异显著(P<0.05);*. 同一月龄、不同肌肉部位间差异显著(P<0.05)。图7同。
由图2可知:ST和LD肌内结缔组织中的Ⅴ型胶原蛋白含量随着月龄的增长而增加,且各月龄间差异显著(P<0.05);同一月龄,ST肌内Ⅴ型胶原蛋白的含量均高于LD;6 月龄和9 月龄ST和LD中肌内Ⅴ型胶原蛋白的含量没有显著差异(P>0.05),12 月龄和18 月龄时差异显著(P<0.05)。研究表明,胶原蛋白的含量受肌肉运动量的影响,与运动量较少的肌肉相比,经常运动的肌肉中肌束膜由更多胶原纤维束组成且较发达[19],胶原蛋白含量较高,肌束较粗,肉质较硬。各部位肉中所含胶原蛋白的含量不同,其嫩度也不同。Dubost等[20]的研究发现,股二头肌内胶原蛋白含量最高,其次是ST和LD。
2.3 Ⅴ型胶原蛋白的二级结构分析
a、b、c、d分别为6、9、12、18 月龄乌珠穆沁羊ST肌内结缔组织Ⅴ型胶原蛋白。图5同。
采用傅里叶红外光谱分别分析6、9、12、18 月龄乌珠穆沁羊ST和LD肌内结缔组织中Ⅴ型胶原蛋白的二级结构(三股螺旋结构)。由图3~4可知,各月龄乌珠穆沁羊骨骼肌肌内结缔组织中Ⅴ型胶原蛋白的红外光谱特征基本一致,均具有Ⅴ型胶原蛋白的特征红外吸收峰。
