花生发芽过程中基础成分变化及白藜芦醇的诱导富集
2019-06-08詹玉婷赵文瑞陈志刚
詹玉婷 赵文瑞 陈志刚
(南京农业大学食品科技学院,南京 210095)
花生(ArachishypogaeaL.),豆科落花生属植物,因其种植范围广、品质优良而成为世界重要的经济作物之一[1]。花生营养丰富,营养素较为全面,不仅含有大量的脂质,蛋白质,糖类等基本的营养物质,同时含有多种维生素,无机盐等,同时,花生中含有的白藜芦醇、精氨酸、酚酸、黄酮类和植物甾醇等生物活性物质也是其他杂粮所少有的[2, 3]。花生的高油,高蛋白,高营养特性,使其成为继大豆后又一国际植物资源研究开发的新热点。
白藜芦醇(Resveratrol,以下简称Res),非黄酮类多酚化合物,学名3,4,5-三羟基二苯乙烯,又名芪三酚,广泛存在于虎杖、葡萄、花生等多种植物中[4]。由于其具有抗氧化、抗病毒、抗炎保肝、预防心血管疾病等生物活性[5-7],在食品、医药、植物生理等领域受到国内外学者的广泛关注。花生作为天然Res的重要来源之一,因其价格低廉,种植方便而成为热门的研究原料。在植物体内,白藜芦醇是其受到病原菌侵染或其他环境因子刺激时诱导产生的天然活性成分,因此外界的刺激诱导是提高植物中Res含量的有效手段,近些年,国内外学者开展了大量关于白藜芦醇诱导方式的研究。诱导方式可分为生物诱导和非生物诱导,其中,非生物诱导处理简单快速,主要有超声、紫外等物理损伤处理和添加苯丙氨酸、水杨酸等化学诱导剂处理。超声因空化效应而具有强大的外力冲击,这可以增加植物细胞次生代谢产物的生物合成,膜渗透性,并改变细胞形态。超声处理使红豆杉细胞培养中紫杉醇含量增加3倍[8],Yu等[9]发现超声处理后发芽3d反式白藜芦醇含量能高达对照组的3.34倍。紫外能够提高植物体内促进刺激次生代谢物的酶含量[10],Cho等[11]发现紫外能将葡萄中白藜芦醇的含量从8.99μg/g提高到10.56μg/g。信号分子水杨酸在植物响应外界刺激过程中起着重要作用,是植物获得性抗性反应基因的诱导因子[12]。Chung等[12]研究中发现花生叶浸入无菌水杨酸后,白藜芦醇的含量增加3倍。苯丙氨酸是白藜芦醇合成反应的前体物质,姜丰[13]研究发现一定浓度的苯丙氨酸能将葡萄皮愈伤组织中白藜芦醇的含量提高至对照组的2.1倍。另外,低温也是植物体常见的环境损伤,植物受到低温刺激后可以积累体内调节物质如脱落酸来提高自身的抗性[14],但目前没有关于低温胁迫对植物体体内白藜芦醇的含量影响。同时,关于上述几种诱导方式对多种花生品种富集效果的比较研究也较少。
发芽是一种能改善种子营养品质和生物利用率的有效手段,在生活和科研中都得以广泛利用[15, 16]。在发芽过程中种子休眠状态被打破、各种内源酶被激活、花生中的营养物质含量也发生改变[17-19]。因此,本研究主要探究发芽过程中花生种子营养成分和活性成分Res的变化,并合理选取营养含量均衡、Res含量较高的花生品种,进一步考察比较低温、超声、紫外、添加苯丙氨酸和水杨酸对多种花生种粒中白藜芦醇的富集效果,为富含白藜芦醇的功能性花生产品的开发生产提供依据。
1 材料与方法
1.1 实验材料与仪器
花生种子:市售,HY22:花育22;HY23:花育23;HY25:花育25;HY33:花育33;HY36:花育36;HY39:花育39;HY50:花育50;HN12:河南开封自种种子;反式Res标品(纯度≥98%,EP);石油醚(沸程30~60℃,AR)。
SZF-06A型脂肪测定仪;FD-2KW可调封闭电炉;马弗炉(KSW-4D-11型电阻炉温度控制器和SX2-1-10型高温箱形电炉);Hanon K1160型全自动凯氏定氮仪;UV BlueStar A型紫外可见分光光度计;UP型超声清洗仪;岛津LC-20A型高效液相色谱。
1.2 花生种子发芽工艺
挑选大小一致、成熟饱满的花生种子,用蒸馏水洗去表面浮尘,0.5%的次氯酸钠浸泡消毒15min后,用灭菌后的去离子水反复冲洗3遍,25℃恒温浸泡8h,置于植物生长箱中避光发芽4d,发芽温度30℃,湿度为100%,每隔24h取样,每隔12h换水,鲜样用于测定芽长和基础成分,用作Res测定的样品储藏在-20℃。
1.3 基础成分的测定方法
芽长的测定:用软尺测量并记录;发芽率的测定:每隔24h计数并记录(SN/T0800.14—1999);根据AACC测定方法,粗脂肪、粗灰分、粗蛋白的测定分别采用索氏抽提法、灼烧法、凯氏定氮法;可溶性蛋白、游离氨基酸、总糖的测定分别采用考马斯亮蓝法,茚三酮法,苯酚硫酸法[20]。基础成分含量均以干重计量。
1.4 白藜芦醇的提取测定
1.4.1白藜芦醇的提取
准确称取冻干脱脂后的样品5g,加入80%乙醇50mL,在50℃超声辅助提取时间40min,冷却后离心(6000r/min,10min,4℃),收集离心后上清液于烧瓶中,沉淀按上述操作再重复提取后,合并上清液,50℃真空浓缩至干,加入甲醇溶液后超声辅助溶解,提取液定容至5mL。所有实验操作均在避光下进行。
1.4.2色谱条件
参照Lee等[21]的方法并加以改进,色谱柱:150mm×4.6mm,5μm;流动相:乙睛∶水=1∶2(含0.09%冰醋酸),通过0.45μm的滤膜并脱气;流速:1mL/min;紫外检测器:波长306nm;柱温:35℃;进样量:20μL。Res含量以干重计。
1.5 诱导处理
对照组:按1.2所述进行正常发芽培养。低温诱导:花生样品在浸泡过程中每隔4h放置在4℃环境中1h,在发芽过程中每隔24h放置低温下1h。超声诱导:花生在浸泡过程中每隔4h超声(240W,25℃)30min,发芽过程中每24h超声诱导30min。紫外诱导:花生在浸泡过程中每隔4h分别紫外灯(UV-C)下照射20min,发芽过程中每24h紫外照射20min。水杨酸诱导:在浸泡以及发芽过程中用2mmol/L水杨酸代替蒸馏水。苯丙氨酸诱导:在浸泡以及发芽过程中用0.4mmol/L苯丙氨酸代替蒸馏水。
1.6 数据统计分析
各组实验均设3组重复,实验结果均以均值±标准差表示,采用Microsoft Excel对数据进行整理计算,采用Origin8.0对实验结果进行统计分析。
2 结果与分析
2.1 花生发芽过程中发芽率和芽长的变化
在发芽4d的过程中,记录各品种的发芽率和芽长,结果表明,发芽率和芽苗长度均随着发芽时间的延长而迅速增加(表1,表2)。在发芽1d时,所有品种的发芽率都能达到70%以上,芽苗长度均能达到0.3cm以上,而发芽4d时,所有品种的发芽率均能超过75%,芽苗长度均能超过2cm。由不同品种间发芽率以及芽苗长度的显著性差异分析可以看出,HN12、HY23、HY39、HY25生长状况相对较好,在发芽1d时发芽率均达到90%以上,芽苗长度分别为0.65、0.64、0.56、0.55cm,而发芽4d时发芽率均能达到95%以上,芽苗长度分别为3.07、3.02、2.79、2.91cm。
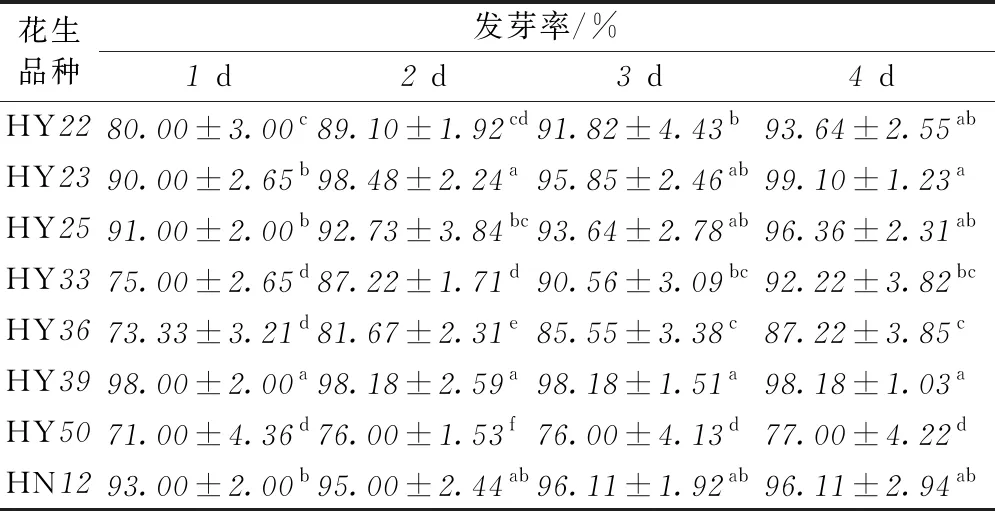
表1 各品种发芽4 d的发芽率变化
注:同一列中字母不同代表有显著性差异,P<0.05,余同。
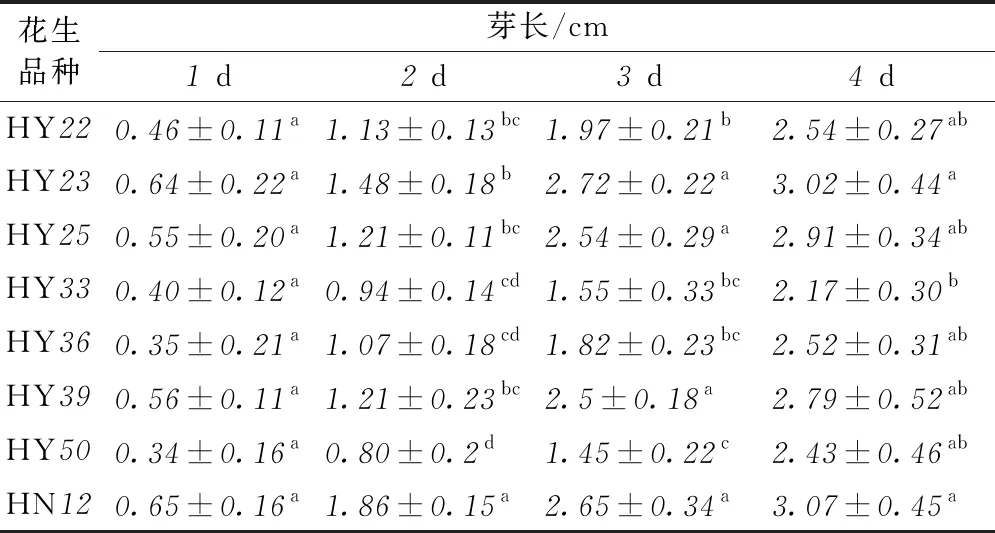
表2 各品种发芽4 d的芽长变化
2.2 花生发芽过程中基础成分含量的变化
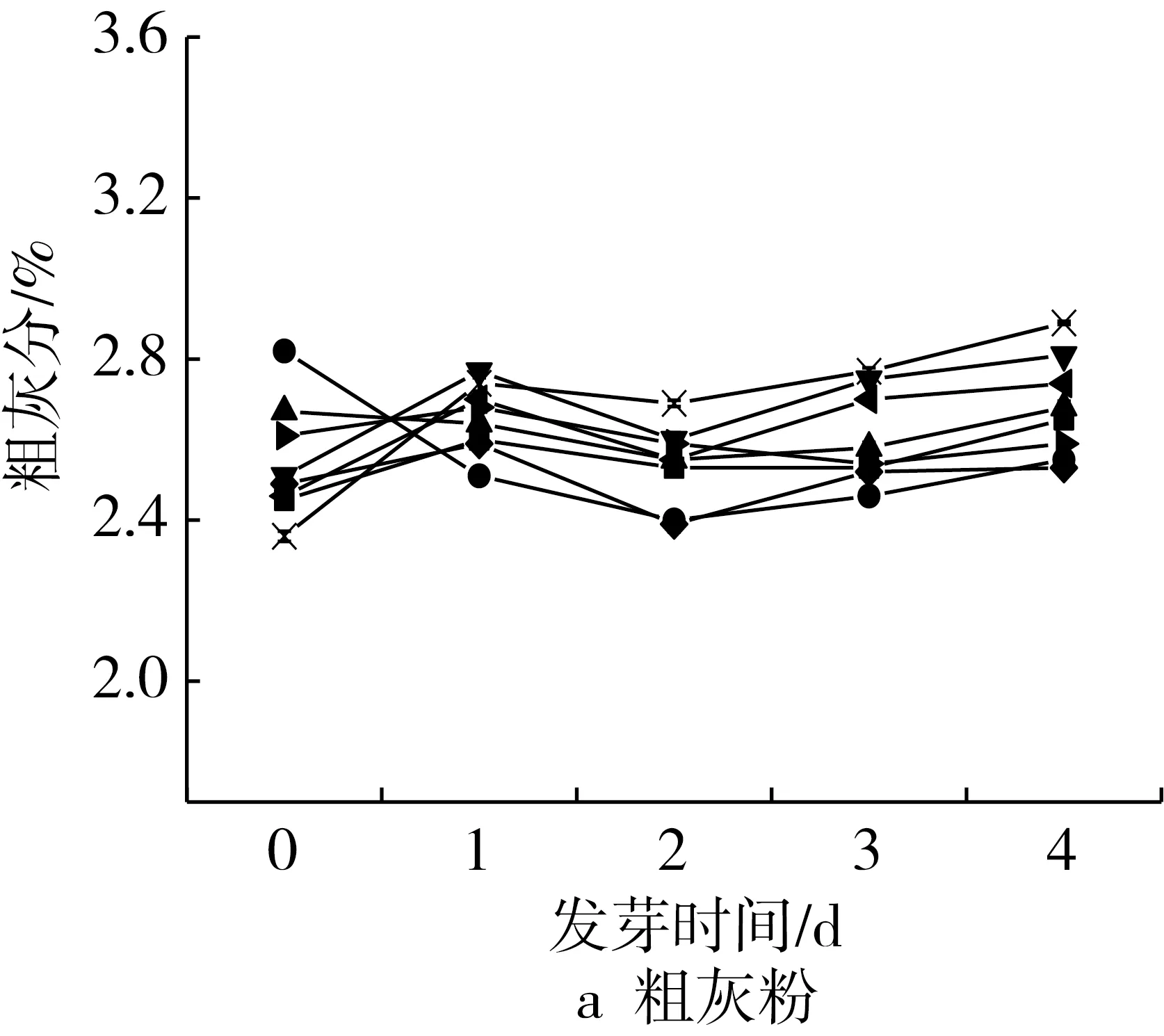
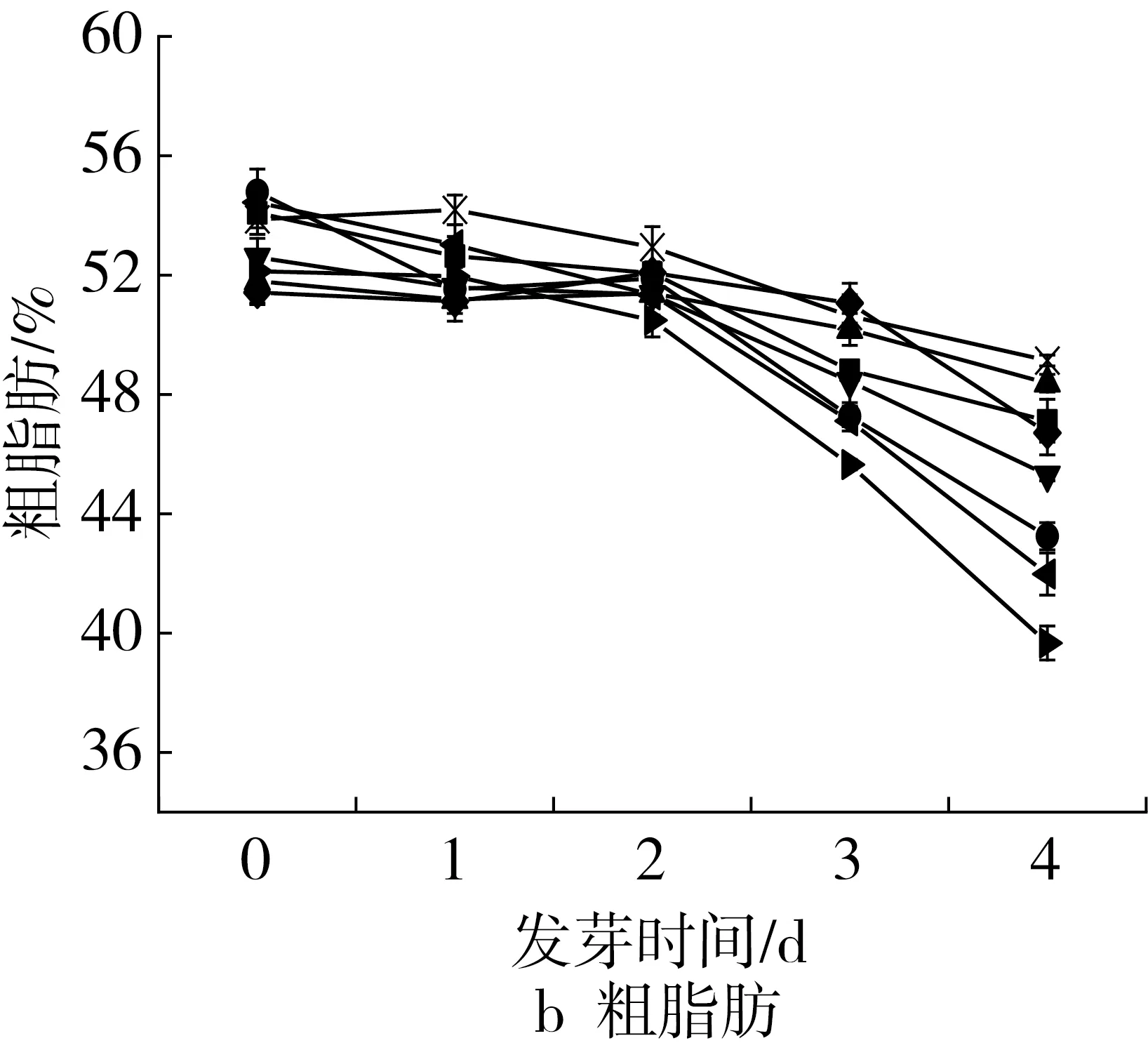
对不同品种花发芽过程中营养成分的变化情况进行探究,结果表明,各品种营养成分在发芽过程中的含量有所差异,但发芽过程中的变化趋势一致(图1)。
各个品种在发芽过程中的灰分含量基本保持不变,集中在2.3%~2.6%之间,说明发芽对花生中的矿物质含量基本不产生影响(图1a)。
各个品种的粗脂肪含量在发芽过程中均呈明显的降低趋势(图1b),未发芽时,含量集中在50%~55%之间,发芽1~2d时,脂肪含量降低缓慢,发芽3~4d,大部分品种的脂肪含量降低迅速,发芽4d后各品种花生脂肪含量降低了65%~23%。这可能是由于花生在发芽过程中,脂肪酶被激活[22],种子中贮藏的脂肪开始降解,生成的脂肪酸等物质参与油料种子萌发时活跃的乙醛酸循环,为芽苗的生长发育提供物质和能量基础[23, 24]。在其他种子如大豆[25]、芝麻[26]发芽过程中脂肪含量也存在逐渐降低的变化规律。
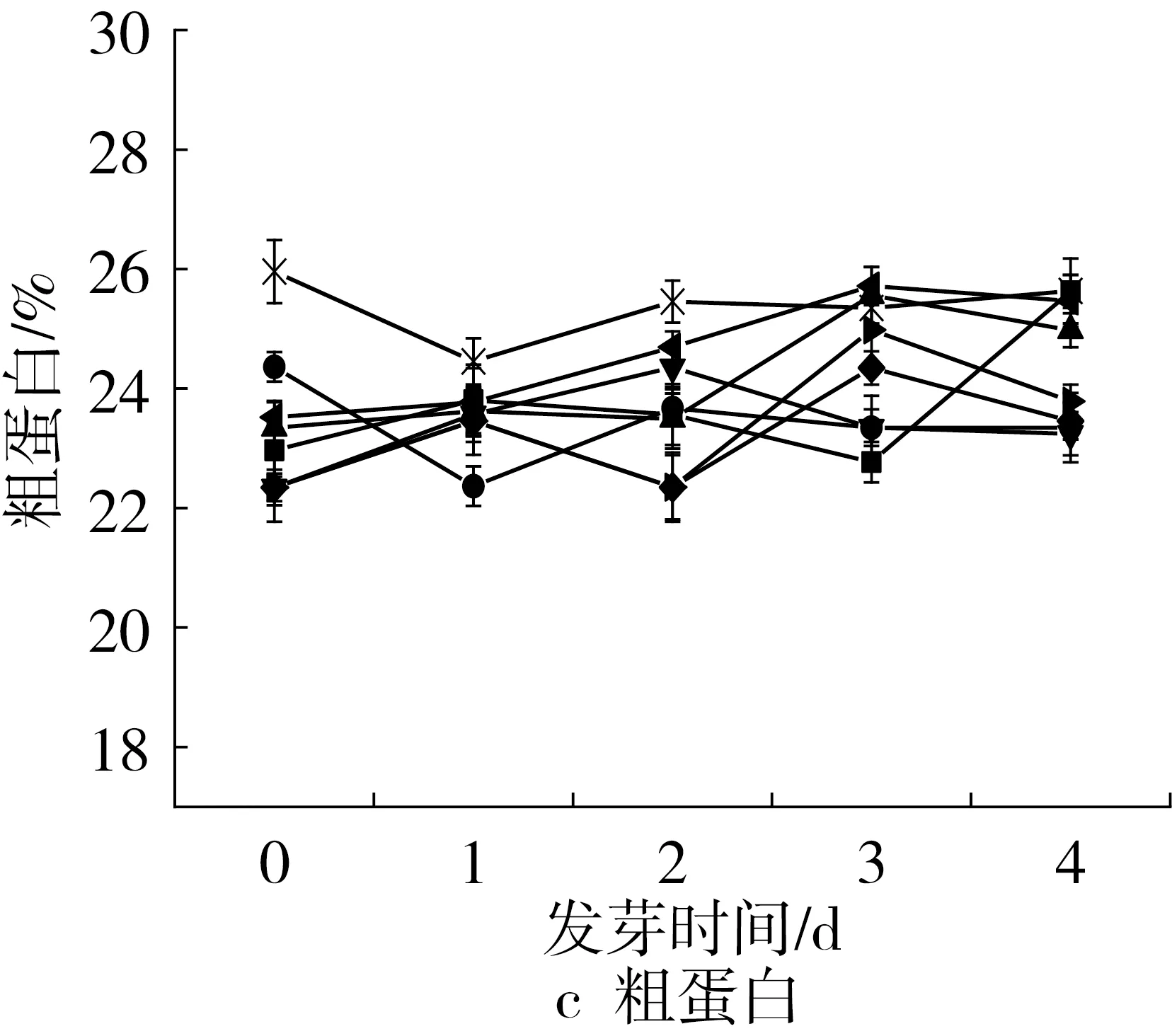
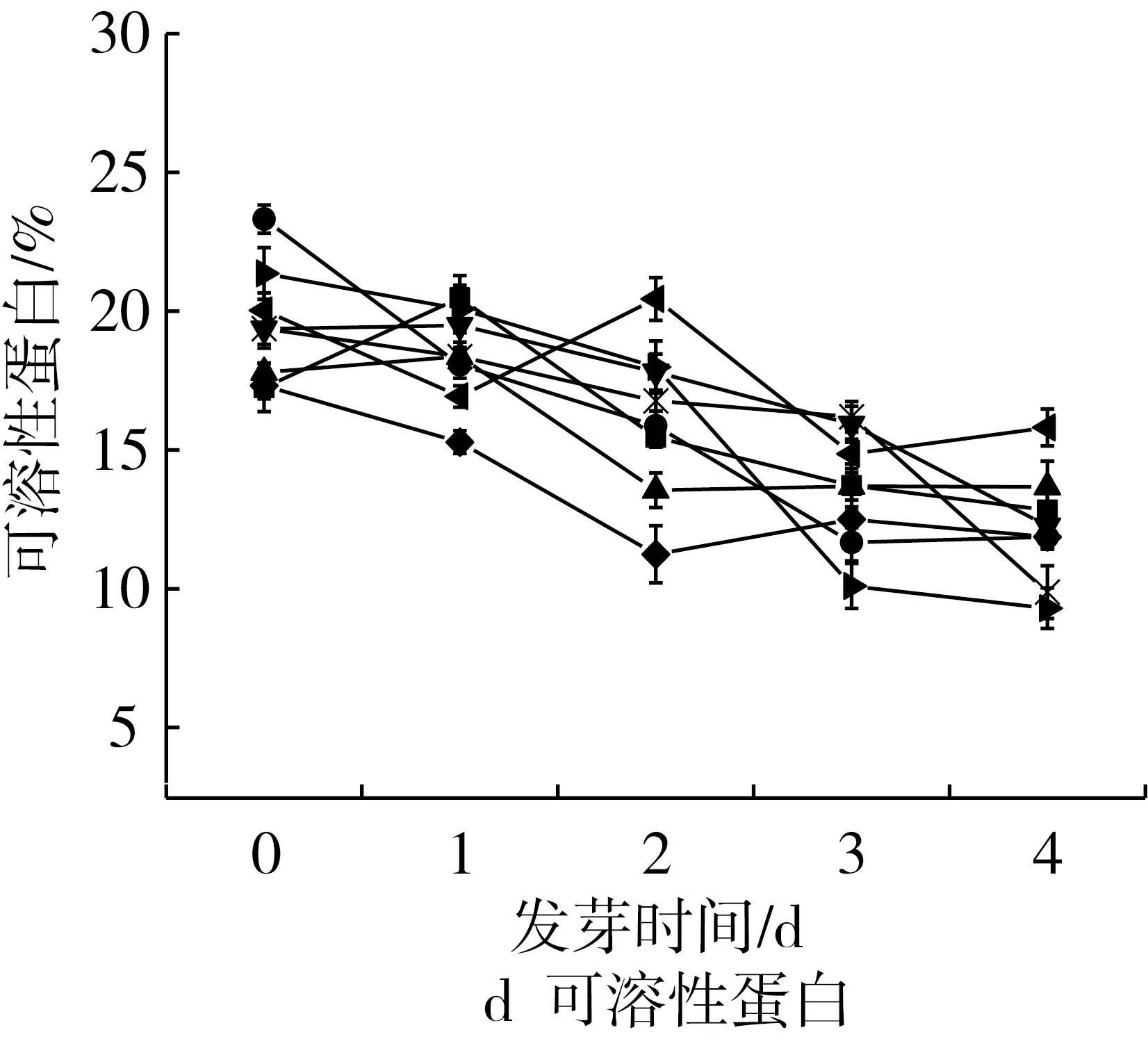
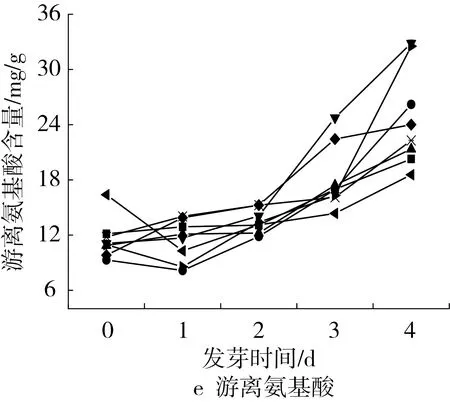
通过研究各个品种花生发芽4d过程中粗蛋白,可溶性蛋白,游离氨基酸的含量变化可以观察到各品种发芽过程中蛋白质的变化规律。发芽过程中,各品种的粗蛋白含量基本维持不变,可溶性蛋白含量呈总体呈降低趋势,游离氨基酸含量呈明显的升高趋势(图1c~图1e)。其中,总蛋白质含量较高的HY50,未发芽时蛋白质质量分数为25.96%,可溶性蛋白含量为19.37%,游离氨基酸含量为11.79mg/g,发芽4d后蛋白质质量分数为25.63%,可溶性蛋白质量分数为9.88%,游离氨基酸含量为22.09mg/g。粗蛋白是以含氮化合物为基础进行测定的,粗蛋白含量变化幅度不大说明发芽过程中总的氮物质含量基本保持不变,可溶性蛋白含量降低,游离氨基酸含量不断升高可能是因为蛋白酶在发芽过程中被激活[27],可溶性蛋白逐渐被分解为小分子的氨基酸[28, 29],从而发芽花生中的可溶性蛋白含量减少,游离氨基酸含量增多。
在花生发芽过程中,总糖含量变化幅度均较小,质量分数维持在10%~15%,变化趋势因品种不同而有所差异(图1f)。
2.3 花生发芽过程中白藜芦醇含量的变化
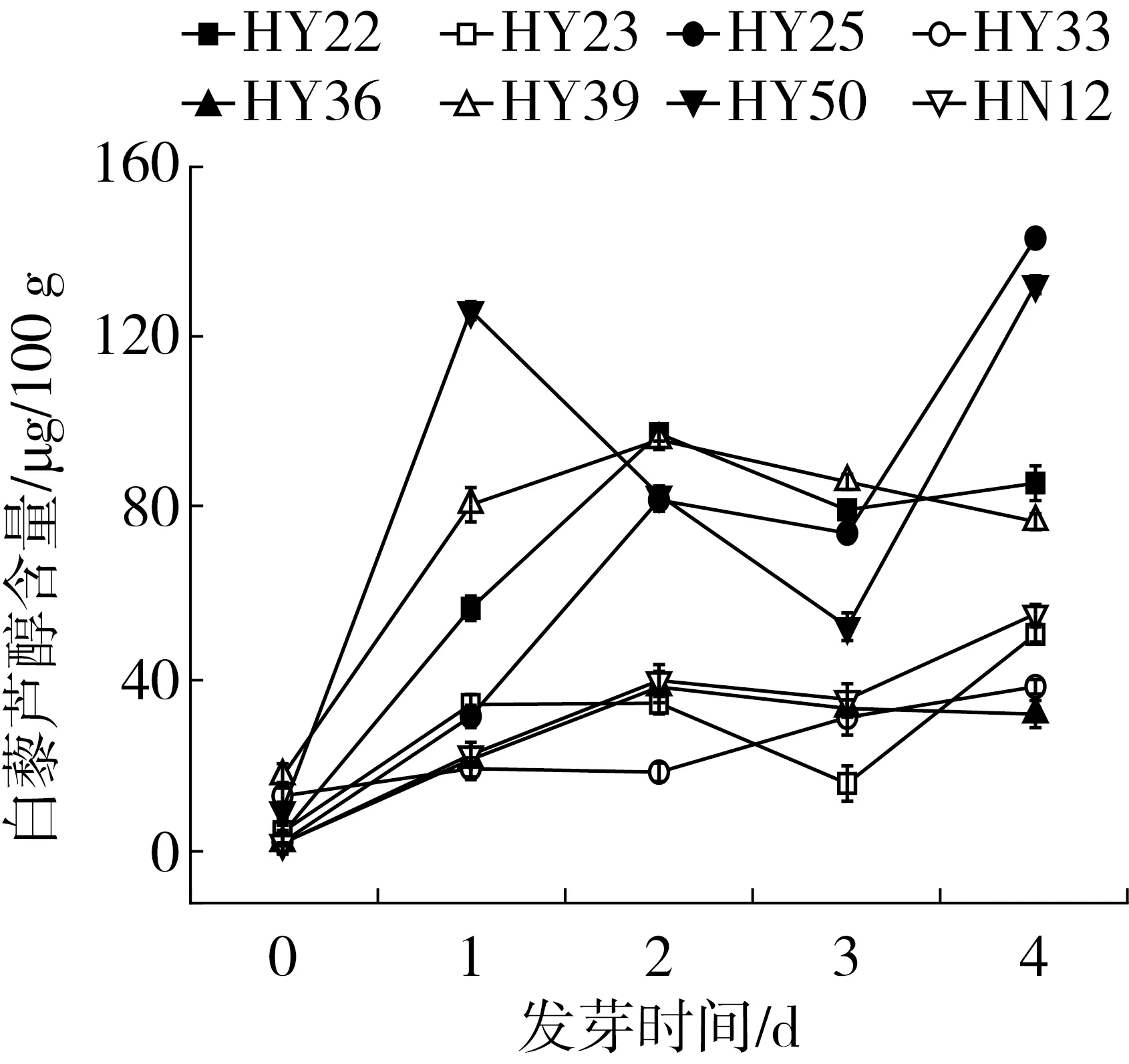
图2 花生发芽4 d过程中白藜芦醇含量的变化
各个样品在发芽前的Res含量很低, 均在4.42~20.01μg /100g之间(图2)。发芽后,各品种的Res含量显著增加,Res含量总体呈上升趋势,但各品种的变化趋势不同。其中,HY22、HY23、HY25、HY50、HN12在发芽4d的过程中呈先升高后降低再升高的趋势,HY22在发芽第2d Res的含量达到峰值,是未发芽的15.1倍。HY23、HY25、HY50、HN12在发芽第4d Res的含量达到峰值,分别为未发芽的7.5、31.1、11.1、13.0倍。HY36、HY39Res的含量先增加后降低,并分别于第2d达到峰值,分别是未发芽的9.1、4.9倍。HY33的变化呈波动的趋势,但Res的含量总体上显著增加,并在第4d达到最大值,是未发芽的2.7倍。由此可见,发芽能显著增加花生中Res的含量,而Res的变化规律因品种不同会有较大的差异。有研究表明,植物可以在一系列酶的作用下,通过苯丙烷途径合成Res,在此过程中,苯丙氨酸解氨酶(PAL)和Res合成酶(RS)发挥了最重要的作用[6]。在本研究中,所有品种的Res含量均显著高于未发芽时的样品,这可能是因为种子萌发是一个激活内源酶的过程,在发芽过程中RS或PAL可能被激活,更多的Res被合成。
2.4 不同诱导方式对花生中白藜芦醇含量的影响
由图2知,各品种花生中的Res在发芽2d已经达到较高的含量,因此,在本研究中,结合发芽过程中各花生品种的生长状况、基础成分含量、Res含量的变化,选取生长较好、营养均衡、Res含量相对较高的3个品种HY22、HY25、HY50,在发芽的基础上,进一步采用不同诱导方式进行处理,研究发芽2d时对Res的富集效果(图3)。
各处理方式对白藜芦醇的富集效果因品种而异,未进行诱导处理时,HY22、HY25、HY50中发芽2d时Res的含量分别为99.36、66.16、80.24μg/100g,超声处理对3个品种的Res的富集作用最为明显,超声处理后,HY22、HY25、HY50Res含量分别是对照组的1.3、2.0、1.7倍。紫外处理后,HY22、HY25、HY50Res含量分别是未处理组的1.3、2.2、1.4倍。低温处理仅对HY25的Res有一定的富集效果,处理后Res含量是对照组的1.4倍,而低温处理后HY22、HY50的Res含量明显比未处理组低。经过化学诱导剂苯丙氨酸处理后,发芽2d的HY22、HY25、HY50的含量分别是对照组的1.2、1.6、1.7倍。添加水杨酸处理仅对HY50中的Res有一定的富集效果,添加水杨酸后的HY50中的Res的含量是对照组的1.4倍,而HY22、HY25Res的含量明显降低。由此可见,在发芽过程中,超声、紫外以及添加苯丙氨酸对3个品种中Res的含量均有较好的富集效果,可能是因为在发芽基础上中,超声、紫外和苯丙氨酸均能提升3个品种花生内部PAL和RS的活性[30-32]。
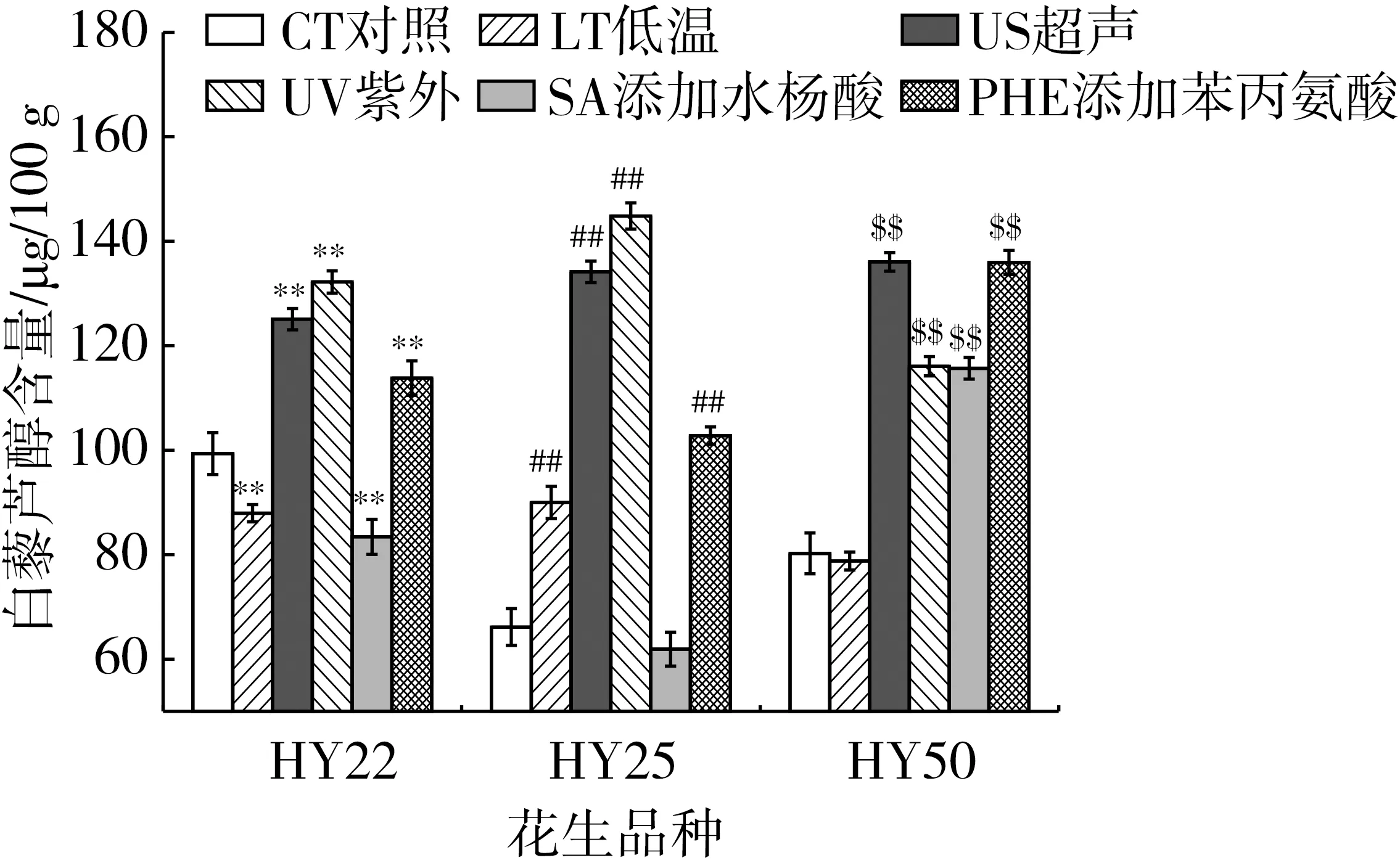
注:P<0.01。
3 结论
花生芽作为一种营养全面的新型健康食品,相对于花生种子本身不仅在口感上发生了明显的改变,在营养品质上也有了显著的改善,在发芽过程中,随着芽苗的生长,大分子营养物质脂肪、可溶性蛋白减少,小分子的游离氨基酸含量增加,对人体有益的活性成分Res含量增加,粗蛋白含量、总糖含量和灰分含量没有发生显著变化。在发芽基础上,采取超声、紫外以及添加化学诱导剂苯丙氨酸3种方式对筛选出的HY22、HY25、HY50花生中的Res均有较好的诱导富集作用,且诱导效果因品种不同而异,超声、紫外诱导的方式对HY25的诱导效果最好,化学诱导剂苯丙氨酸对HY50的诱导效果最好。
