聚焦滴定法在中学化学中的考查
2019-06-06刘宇
刘 宇
(四川省泸州市泸县二中 646106)
环境问题越来越受到大众的关注,水污染是其中一个重要的问题.近年的高考试题中针对水溶液中某些离子的检验层出不穷,滴定法是定量分析电解质溶液中离子浓度的重要方法之一.滴定法是根据指示剂的颜色变化指示滴定终点,然后目测标准溶液消耗体积,计算分析结果.文章通过几例分析滴定法的不同类型及考查形式.
一、酸碱中和滴定
例1现用物质的量浓度为amol·L-1的标准NaOH溶液去滴定VmL盐酸的物质的量浓度,请填写下列空白:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是____.
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入____(填“甲”或“乙”)中.

(3)右图是碱式滴定管中液面在滴定前后的读数,c(HCl)=____mol·L-1.
解析(1)碱式滴定管水洗后应用标准NaOH溶液润洗2~3次,每次润洗液都要从尖嘴处排出.
(2)NaOH为强碱,应将NaOH溶液注入碱式滴定管中,故选乙.

考点透析酸碱中滴定作为化学实验题,考查一般设置有实验仪器的识别(名称、使用方法等)、化学实验基本操作方法(滴定步骤操作)、实验现象的描述(滴定终点的判断等)、化学计算以及误差分析等等.
二、氧化还原滴定
例2 酸性KMnO4溶液能与草酸(H2C2O4)溶液反应.某探究小组用浓度为0.1000 mol·L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的化学方程式为____.
(2)滴定过程中操作滴定管的图示正确的是____.

(3)滴定到达终点的判定标准是____.
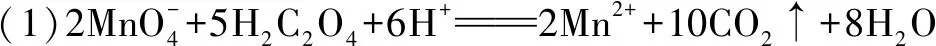
(2)A
(3)当最后第一酸性KMnO4溶液滴入时,溶液由无色变为浅红色,且半分钟内不褪色,即说明达到滴定终点.

(2)酸性高锰酸钾氧化性强,所以在该实验中选择酸式滴定管,滴定时用左手的大拇指、食指、中指旋转滴定管的旋塞,A项正确;
(3)锥形瓶中位置浓度的草酸溶液呈无色,开始滴入酸性KMnO4溶液时,滴入即能发生化学反应,溶液仍为无色,当滴定达终点时,多加入的酸性KMnO4溶液呈浅红色.
能力提升滴定法的种类多,但他们之间的差异在于化学反应原理的区别,只要明晰化学反应原理,了解待测液和标准液之间的关系,所有分析相同,仅仅在数据分析时计算原理稍作调整.
三、沉淀滴定
例3 利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行.已知:
步骤1 移取xmL一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤2 移取ymL BaCl2溶液于锥形瓶中,加入xmL与步骤1相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的(填“上方”或“下方”).BaCl2溶液的浓度为mol·L-1,若步骤2中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将(填“偏大”或“偏小”).
技巧点拨滴定到达终点的判断依据可以固化,即加入最后一滴指示剂时,溶液由原色变化为新色,且半分钟内不恢复原色.其中需要特别关注的是,原溶液的颜色,同时清晰加入指示剂反应会使得颜色发生变化,到达终点(或者多加入一滴指示剂),颜色会发生明显变化.
四、转化滴定
例4 草酸铁晶体Fe2(C2O4)3·xH2O通过相关处理后可溶于水,且能做净水剂,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
步骤1:称量4.66 g草酸铁晶体进行处理后,配制成250 mL一定物质的量浓度的溶液.
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200 mol·L-1KMnO4溶液为V2、V3mL.
记录数据如下表:

实验编号KMnO4溶液的浓度mol·L-1KMnO4溶液滴入的体积/mL10.0200V1=20.0220.0200V2=20.1230.0200V3=19.98
请回答下列问题:
(1)草酸铁溶液能做净水剂的原因____(用离子方程式表示)
(2)该实验步骤1和步骤3中使用的仪器除托盘天平、铁架台、滴定管夹、烧杯、玻璃棒外,一定需用下列仪器中的____(填序号)
A.酸式滴定管 B.碱式滴定管
C.量筒(10 mL) D.锥形瓶
E.胶头滴管 F.漏斗 G.250 mL容量瓶
(3)加入锌粉的目的是____.
(4)步骤3滴定时是否选择指示剂____(是或否);说明理由____,写出步骤3中发生反应的离子方程式____.
(5)在步骤2中,若加入的KMnO4溶液的量不够,则测得的铁含量____(填“偏低”、“偏高”或“不变”);实验测得该晶体中结晶水的个数x为____.

(2)A、D、E、G
(3)将Fe3+还原为Fe2+
(4)否 因为KMnO4被还原剂还原成Mn2+,紫红色褪去,所以不需要指示剂
(5)偏高 5
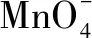
(1)草酸铁溶液中Fe2(C2O4)3电离出Fe3+,水解生成Fe(OH)3(胶体)可净水;
(2)步骤1和步骤3分别是配制一定物质的量浓度溶液和滴定,直接分析所需仪器;
(3)结合分析,加入锌粉是将将Fe3+还原为Fe2+;
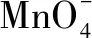
数据处理对于计算类的实验,均会存在误差,为了将误差降低到最低,采用多次(一般3次以上)实验就算平均值,数据的处理也就是几次的平均值,但如果有一次的实验数据偏差过大,应该先弃去偏差较大的一组数据再就平均值.
五、反滴定

试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少____.
(2)滴定操作时,左手控制滴定管,右手____,眼睛要注视____.

(4)水中溶解氧的计算式是____(以g/L为单位).
(5)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果____(填“偏高”“偏低”或“无影响”,下同).
答案(1)锥形瓶、烧杯


(1)结合滴定实验,可知缺少锥形瓶、烧杯;
(2)结合实验步骤,滴定操作时,左手控制滴定管,右手不断振荡锥形瓶,眼睛要注视锥形瓶内溶液颜色的变化;

(5)若滴定管经蒸馏水洗涤后未润洗,标准液浓度下降,标准液的体积偏大,结合计算式可知测定结果偏高.
思路点拨反滴定是指溶液中的粒子不能直接进行测定,可先将溶液中的被捡粒子转化成其他粒子,再通过滴定的方法进行定量测定.那么进行化学计算时可通过关系式法确定多个粒子之间的物质的量之间的关系,再进一步完成计算.
