金属指示剂相关问题的探讨
2019-11-19徐会君杜庆洋赵云霞苗志超白佳海
徐会君,杜庆洋,艾 兵,赵云霞,苗志超,白佳海,张 天
(1.山东理工大学 化学化工学院,山东 淄博 255049;2.山东理工大学 材料科学与工程学院,山东 淄博 255049)
尽管仪器分析方法随着材料和技术日臻完美,制造的仪器更加精密、先进,能进行科学而精准的测定。但是,滴定分析方法因方式简便、成本低廉就能够得到准确的结果,在常量组分分析中依然占据着无法替代的地位。选择滴定分析方法要考虑的一个非常重要的因素就是终点误差。在目视终点法中,指示剂变色点是决定终点误差的一个非常关键的因素,因此,熟悉并掌握终点指示剂变色的相关知识尤为重要。在四大滴定方法中,配位滴定过程复杂,溶液pH值和各种副反应都影响指示剂的变色点[1-2],准确掌握指示剂变色点的影响因素及正确确定变色点是减小终点误差,提高配位滴定结果准确度的方法之一。目前通用教材中关于金属指示剂变色现象和对应变色点的阐述不够全面,使学习者使容易产生疑问。为将这部分内容补充完整,本文从金属指示剂的分类、具备的条件、作用原理三个方面进行总结,着重探讨关于指示剂变色的影响因素及变色点的计算,以飨读者。
1 金属指示剂的种类
与其它滴定方法一样,配位滴定判断终点方式有电化学方法,光化学方法(光度滴定)等多种方式,最常用的还是目视终点指示法。配位滴定所使用的终点指示剂是通过颜色的变化来指示溶液中金属离子浓度,因而称为金属指示剂。
目视终点指示剂的研究应用,提供了大量的金属指示剂,从根本上推动了配位滴定的发展,这些金属指示剂按照性能可以分为如下几类[3-4]:
1.1 直接的金属指示剂
(1)金属显色指示剂:通常为有机染料,这些指示剂与金属所形成的螯合物颜色与游离指示剂颜色色差明显,对于低浓度的金属离子非常灵敏。大多为双色指示剂,即我们现在通常所说的金属指示剂。
(2)单色金属指示剂:为无色物质,通常能与被滴定的金属生成深色的简单配合物或螯合物(与金属显色指示剂相比,颜色较浅)。未被配位的指示剂颜色对滴定不产生干扰,如有必要,可以使用较高浓度的指示剂。大多数的无色指示剂,其灵敏度不及金属显色指示剂。
1.2 间接的金属指示剂
一种指示剂若能在不同程度上有选择地与某一金属离子反应,那么它往往还可以用于其它金属离子的配位滴定。如铬黑T与少量的Mg-EDTA是间接方式指示钙离子含量的指示剂。铬黑T作为钙的指示剂时,由于KCa-EBT太小而不能得到满意的结果,加入少许Mg-EDTA,由于KCaY>KMgY,KCa-EBT>KMg-EBT,可以得到十分敏锐的颜色变化现象。这样就可以间接的指示滴定终点,起到间接指示剂的作用。
1.3 其它类型指示剂
(1)氧化还原指示剂:当被滴定金属离子是某氧化还原体系的一部分,可以选择在化学计量点附近变色的氧化-还原指示剂。该方法仅能适用于某些特殊体系,而且许多指示剂反应缓慢,所以这种指示方法有其局限性。
(2)沉淀指示剂:配位滴定的终点,还可以根据观测沉淀出现的方法进行确定。如用硝酸银滴定一种氰化物溶液,直至形成氰化银沉淀为止。反应式为:
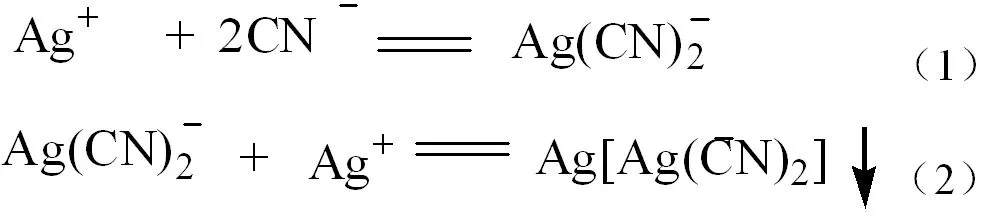
2 金属指示剂所具备的条件
典型的金属指示剂,应需具备以下条件:
(1) 在配位滴定的酸度范围内,游离指示剂与指示剂-金属离子配合物两者的色差显著,这样才能在到达滴定终点时,溶液颜色变化明显,易于判断。
EDTA与金属离子形成配合物颜色具有无色金属离子生成的配合物无色,有色金属离子生成配合物的颜色加深的特点。据此,对某些有色金属离子的配位滴定,若滴定时金属离子的浓度过大,配合物颜色将干扰终点颜色的观察。当金属离子与EDTA形成的配合物颜色太深,只能用电位法来确定终点,如Cr3+的测定。有色金属离子滴定至终点时,常看到的是金属离子-EDTA配合物和游离指示剂的混合色。如用PAN作指示剂滴定Cu2+时,终点呈现指示剂(黄色)和Cu-EDTA络合物(蓝色)的混合色(绿色)。
(2) 指示剂与金属离子形成的配合物要有适当的稳定性。即MIn的稳定性要比MY的稳定性稍低,当滴定达到化学计量点附近时,稍过量的滴定剂才能夺取MIn中的M,使溶液发生颜色的变化。也曾有明确的规定指出[5],指示剂与金属离子形成的配合物MIn的稳定性要弱于EDTA与金属离子形成的配合物MY稳定性,稳定常数值至少要相差100倍以上,这样,EDTA才能在稍过计量点时将指示剂从配合物中置换出来,使溶液改变颜色。如果MIn比MY更稳定,则会发生指示剂封闭现象,如果MIn的稳定性比MY的稳定性低得很多,则会使终点提早到达,且将看到一个较长的颜色渐变过程,变色不敏锐,终点难以判断。
(3) 指示剂与金属离子的反应迅速,有良好的可逆性。
(4) 指示剂性质应较稳定,方便保存和使用。有些指示剂见光易分解,与空气中的物质发生反应,另有一些指示剂的水溶液不稳定。配制铬黑T时,常配成固体混合物是为了克服指示剂不稳定而采取的措施。
3 金属指示剂的作用原理
3.1 金属指示剂的作用原理[3]
滴定前,指示剂与被滴定金属离子结合形成与In颜色明显不同配合物MIn,如式(3)。
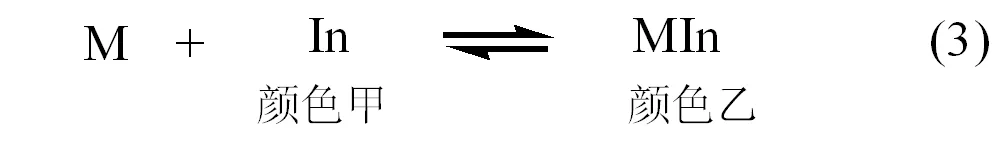
滴定开始,随着滴定剂Y的滴入,金属离子逐步被配位,当接近化学计量点时,滴定剂置换出指示剂配位的金属离子,释放出指示剂,溶液颜色变化,如(4)式。
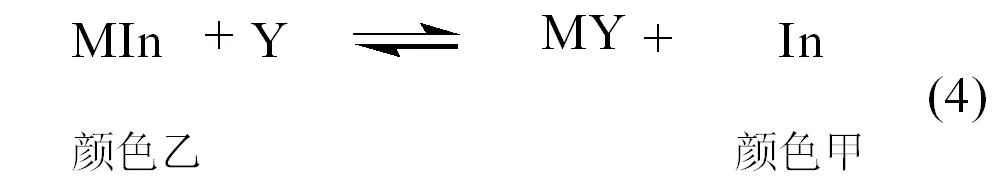
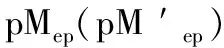
3.2 金属指示剂的变色点和变色范围
被滴定的金属离子和指示剂形成有色配合物MIn,它在溶液中有反应式(5)对应的解离平衡,
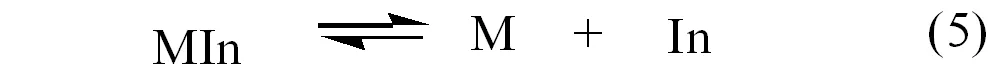
金属指示剂通常具有酸碱性,在水溶液中存在酸效应,如果M没有参与任何副反应,就可以得到式(6)、(7)。
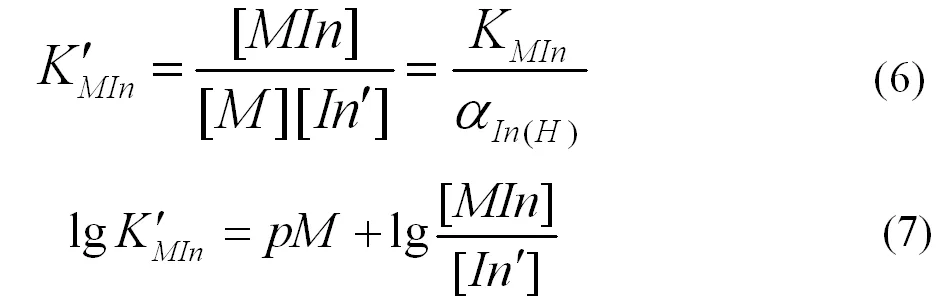
[In]表示未与金属离子配位的指示剂的浓度,当[MIn]=[In ′ ]时溶液呈现混合色,颜色发生改变,则变色点pM的计算方式如式(8)、(9)。

变色点随溶液的pH值而改变。因此,金属指示剂变色点不是一个确定的数值,而是随溶液的酸度变化[1]。
如果金属离子参与某种副反应,就应该考虑到主反应中金属离子副反应系数αM对变色点的影响,依据金属离子与指示剂形成螯合物的条件平衡常数计算式(10)、(11)。
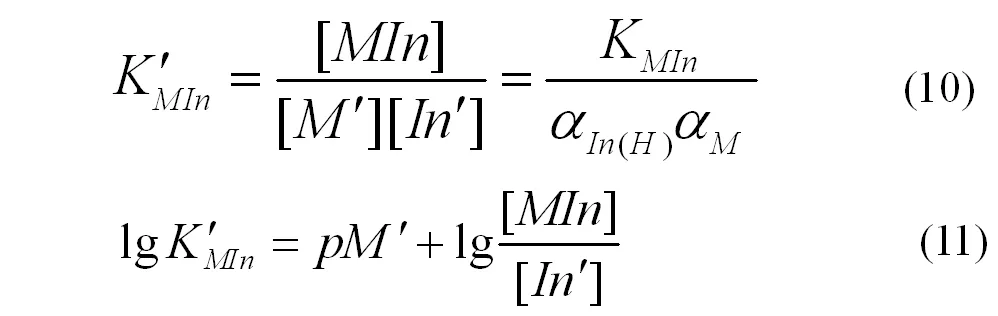
[M ′ ]表示未与滴定剂配位的金属离子浓度,则此时金属离子指示剂的变色点pM ′ 计算式为(12)或(13)。
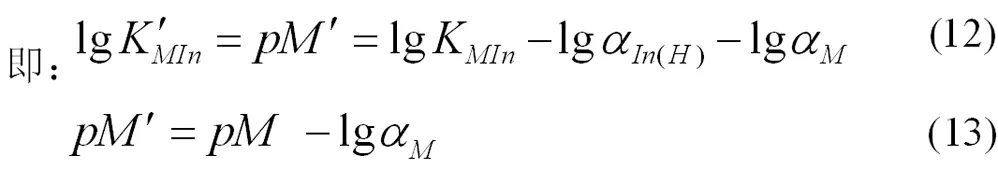
这种方式得到的指示剂变色点pM ′ 的计算式,将滴定剂和金属离子的副反应都考虑到了,滴定终点更加准确。由于金属离子与指示剂之间的反应是主反应的竞争反应,所以计算金属离子的副反应系数时,可忽略指示剂影响。
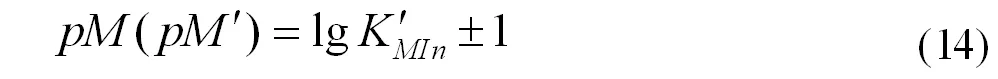
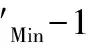
4 结束语
本文以目前高等学校通用的综合性分析化学教材为主体,结合有关金属指示剂的相关知识,总结了金属指示剂的类型,详细阐述了溶液的pH值和各种副反应对金属指示剂终点的影响及计算方式,指明了金属指示剂颜色改变现象对应的滴定终点,进而更加精准的估计方法的终点误差,以期对学习者和相关的工作者提供一些有益的帮助。
