双去甲氧基姜黄素对四氯化碳致小鼠急性肝损伤的保护作用及机制
2019-06-05矫春丽宋艳芹杜源卢永颖张雷明
矫春丽,宋艳芹,杜源,卢永颖,张雷明
(1.烟台大学药学院,山东 烟台 264005;2.烟台市食品药品检验检测中心,山东 烟台 264000)
肝损伤是临床上的常见病,各种物理和化学因素均可导致急慢性肝损伤,严重或持续的肝损伤最终可导致急性肝功能衰竭,危及患者生命[1-2]。实验性肝损伤包括化学性肝损伤、免疫性肝损伤、酒精性肝损伤及药物性肝损伤等多种类型,其中四氯化碳(CCl4)是经典的诱导肝损伤动物模型的化学物质,当肝脏持续受到CCl4作用时,肝细胞内的多种酶大量释放入血,包括谷丙转氨酶(alanine transferase,ALT)、谷草转氨酶(aspartate transferase,AST)及环氧化物酶-2等,其能促进炎症反应的发生,最终导致肝纤维化[3-4]。细胞色素P450酶系(CYP450)将CCl4转化为有毒的代谢产物,损伤细胞DNA和生物膜[5]。另外,肝细胞还能分泌大量的炎症因子,其中肿瘤坏死因子α(tumor necrosis factor α,TNF-α)能刺激免疫相关细胞产生大量细胞因子,引起局部或全身炎症反应,还可激活细胞内相关死亡区域的蛋白,激活半胱氨酸蛋白酶(caspase)家族,最终诱导细胞凋亡[6]。
双去甲氧基姜黄素(Bisdemethoxycurcumin,BDMC)、去甲氧基姜黄素和姜黄素统属姜黄素类化合物,是从植物姜黄根茎中提取的一种植物色素,这3种成分结构简单且相近,易于合成,具有多种相似的药理活性,如抗炎、抗氧化、抗肿瘤等,无明显的毒副作用[7]。过去姜黄素的药理作用研究较多,但其稳定性较差,而三者中BDMC稳定性最好[8],且抗炎活性较显著。因此,我们拟采用CCl4诱导小鼠急性肝损伤(acute liver injury,ALI),通过观察小鼠血清中相关指标的变化及肝细胞凋亡情况,考察BDMC对肝损伤的预防作用,并初步考察其作用机制,为BDMC防治急性肝炎的临床应用提供实验依据。
1 材料与方法
1.1 药品与试剂 BDMC(规格25 g/瓶,批号:B3347,东京化成工业株式会社);联苯双酯滴丸(规格250丸/瓶,万邦德制药集团股份有限公司,批号:A02J180304);CCl4(国药集团化学试剂有限公司,批号:20130426);羧甲基纤维素钠(天津市科密欧化学试剂有限公司,批号:20110809)。谷氨酸转氨酶(ALT)、谷草转氨酶(AST)试剂盒和肿瘤坏死因子α(TNF- α)、白细胞介素1β(IL-1β)ELISA试剂盒(南京建成生物工程研究所);兔抗cleaved-caspase-3、bcl-2、bax(凋亡相关蛋白)、β-肌动蛋白(β-actin)一抗和山羊抗兔二抗(万类生物技术有限公司)。
1.2 实验动物 SPF级昆明小鼠,雄性,体重18~22 g,由济南朋悦实验动物繁育公司提供,动物生产许可证号:SYXK(鲁)20140007。自由摄食和饮水,饲养环境温度22~24 ℃,相对湿度为40%~60%。
1.3 方法 72只KM小鼠随机均分为对照组,模型组,联苯双酯100 mg·kg-1剂量(biphenyldimethy dicarboxylate,BDD100)组,BDMC 12.5、25及50 mg·kg-1剂量(BDMC12.5、BDMC25及BDMC50)组,每组12只。除对照组及模型组给予空白溶媒(0.5%羧甲基纤维素钠),其余各组每天灌胃给药1次,连续给药7 d,给药体积20 mL·kg-1。末次给药1 h后,除对照组(给予纯橄榄油)外,其余小鼠腹腔注射1%CCl4橄榄油溶液诱导急性肝损伤。
1.4 血清ALT、AST、TNF-α、IL-1β水平的检测 造模24 h后,摘眼球取血并分离血清。各项指标的检测按照对应试剂盒说明书进行。
1.5 小鼠肝组织cleaved caspase-3、bax及bcl-2表达检测 造模24 h后处死动物,将小鼠脱颈椎处死取肝,称取20 mg肝组织加入250 μL RIPA裂解液于冰上匀浆,4 ℃下12 000 rpm 离心5 min,收集上清液,测定蛋白浓度。随即将上清液加入5X上样缓冲液,煮沸10 min。10% SDS-PAGE凝胶电泳后进行转膜,随即5%脱脂奶粉溶液封闭2 h,加入cleaved caspase-3、bax及bcl-2一抗于4 ℃过夜孵育。TBST洗膜10 min × 3 次,加入二抗常温孵育1 h,同法洗膜,放入凝胶成像系统,曝光拍照。图像分析用ImageQuant LAS 4000软件计算吸光度值(A)。

2 结果
2.1 BDMC对ALI小鼠血清ALT及AST活力的影响 如表1所示,与对照组相比,模型组小鼠血清ALT及AST活力明显升高(P<0.01)。与模型组相比,BDD100、BDMC12.5、BDMC25及BDMC50组小鼠血清ALT及AST活力明显降低(P<0.05,P<0.01)。结果表明肝损伤小鼠血清ALT及AST活力明显增加;而给药后小鼠血清ALT及AST活力明显减少,说明BDMC对CCl4诱导的肝损伤有明显的保护作用。

表1 BDMC对ALI小鼠血清ALT及AST活力的影响(U·L-1)
注:与对照组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01
2.2 BDMC对ALI小鼠血清TNF-α及IL-1β水平的影响 结果如图2所示,与对照组相比,模型组小鼠血清TNF-α水平明显增加(P<0.01)。与模型组相比,BDD100、BDMC25及BDMC50组小鼠血清TNF-α水平明显降低(P<0.05,P<0.01)。与对照组相比,模型组小鼠血清IL-1β水平明显增加(P<0.01)(见图2A)。与模型组相比,BDD100、BDMC25及BDMC50组小鼠血清IL-1β水平明显降低(P<0.05,P<0.01)(见图2B)。结果表明ALI小鼠血清TNF-α及IL-1β水平明显增加,而BDMC可明显下调ALI小鼠血清TNF-α及IL-1β水平,说明BDMC对CCl4诱导的肝损伤有明显的抗炎作用。
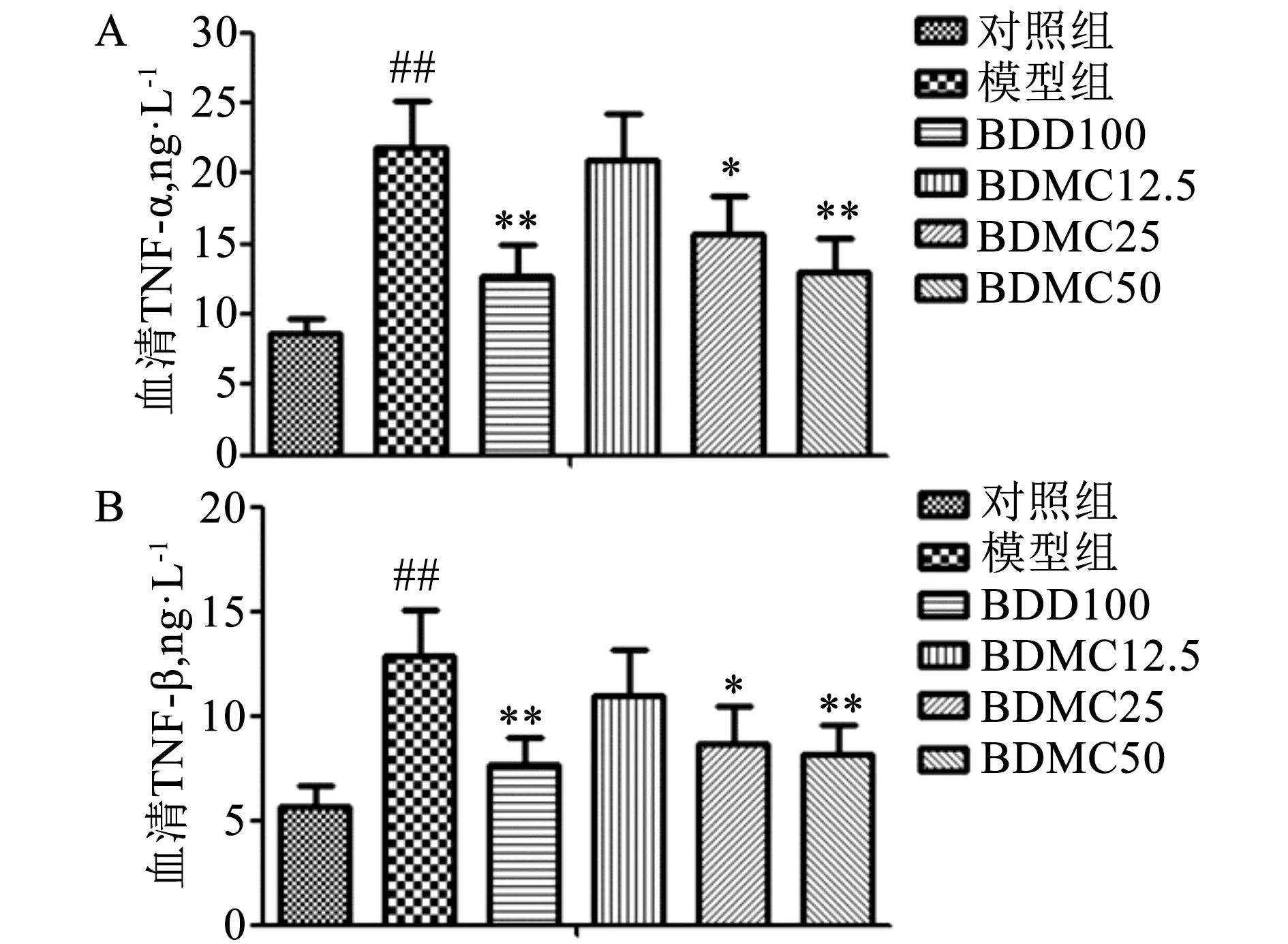
A.血清TNF-α水平;B.血清IL-1β水平图2 BDMC对ALI小鼠血清TNF-α及IL-1β水平的影响(n=12) 注:与对照组相比, #P<0.05;与模型组相比,*P<0.05,**P<0.01
2.3 BDMC对ALI小鼠肝组织bax/bcl-2及cleaved caspase-3表达的影响 结果如图3所示。与对照组相比,模型组小鼠肝组织bax/bcl-2比值明显升高(P<0.01);与模型组相比,BDMC12.5、BDMC25及BDMC50组小鼠bax/bcl-2比值均明显降低(P<0.01)(见图3A)。与对照组相比,模型组小鼠肝组织cleaved caspase-3表达明显升高(P<0.05);与模型组相比,BDMC12.5、BDMC25及BDMC50组小鼠cleaved caspase-3表达均明显降低(P<0.05)(见图3B)。结果表明ALI小鼠肝组织发生凋亡;而BDMC低、中及高剂量均能明显抑制ALI小鼠肝组织的凋亡。

A.bax/bcl-2;B.cleaved caspase-3表达图3 BDMC对ALI小鼠肝组织bax/bcl-2及cleaved caspase-3表达的影响 注:与对照组相比, #P < 0.05,##P<0.01;与模型组相比,*P < 0.05,**P<0.01
3 讨论
肝损伤的发病机制非常复杂,其中涉及多种因素和多种基因及其表达产物的调控,包括凋亡因子、炎症介质的释放等[9]。CCl4诱导的肝损伤模型是经典的实验性肝损伤模型之一,此模型制备方便、易用且重复性好,成为研究肝损伤疾病的首选模型,可用于研究肝损伤的发病机制、治疗和预防[10]。因此本研究采用CCl4诱导的小鼠急性肝损伤模型评价BDMC对急性肝损伤的影响。
CCl4经CYP450分解活化,会生成三氯甲基自由基和氯自由基,导致肝细胞脂质过氧化,细胞膜通透性增高,ALT及AST大量释放入血,血清中ALT和AST活性显著升高,因此ALT和AST活力常被用来作为检测急性肝损伤的指标[11-12]。本研究发现,BDD及BDMC均能明显降低ALI小鼠血清的ALT和AST活力。因此,BDMC对CCl4致小鼠急性肝损伤模型具有明显的保护作用。联苯双酯滴丸为临床治疗肝炎的降酶药物[13],在本研究中其作为阳性药物。
急性肝损伤中免疫细胞可被大量激活,导致TNF-α、IL-1β等多种促炎细胞因子大量释放,进而引起炎症级联反应[14-15]。TNF-α与机体的炎症严重程度呈典型正相关。IL-1β是是炎症级联反应激活的一个重要标志,可导致炎症效应不断放大[16-17]。本研究结果显示,模型组血清TNF-α和IL-1β水平明显增高,BDMC能明显降低肝损伤小鼠血清TNF-α和IL-1β水平。提示BDMC可通过抑制炎症反应减轻肝损伤。
细胞凋亡是一种程序性的细胞主动死亡,但凋亡过度则会引起细胞损伤,进而导致组织功能障碍[18-19]。线粒体凋亡体系中,bcl-2、bax是bcl-2家族与凋亡关系最密切的蛋白[20]。bax位于细胞线粒体膜上,促进细胞凋亡。bcl-2与bax作用相反,其位于细胞线粒体外膜上,通过减轻细胞内钙超载、阻止线粒体PT孔的开放等抑制细胞凋亡[21]。bax高度表达可形成bax/bax同源二聚体来加速细胞凋亡的发生[22]。而bcl-2高表达时,bax与bcl-2可形成异源二聚体来抑制细胞凋亡,因此bax与bcl-2表达的相对失衡导致了细胞凋亡[23]。caspase-3被称为“死亡执行蛋白酶”,cleaved caspase-3是裂解的caspase-3,是多种凋亡途径的共同下游效应部分,切割特异性底物[24]。同时,bax、bcl-2可作为caspase-3的上游调控机制,还可作为其直接底物作用于下游,二者在细胞凋亡传导过程中既相互联系又相互制约[25]。本研究发现,此外,BDMC可上调肝细胞bcl-2的表达,下调cleaved caspase-3和bax的表达,减少bax/bcl-2的比值,提示BDMC可能通过抑制肝细胞凋亡从而发挥其保肝作用。
综上,BDMC对CCl4致小鼠肝损伤模型具有明显的保护作用。肝损伤小鼠炎症因子及凋亡相关蛋白水平的变化说明,BDMC对ALI小鼠模型的保护作用可能是通过抗炎及抗凋亡等机制来实现的。
