冻融循环对亚高山森林土壤微生物生物量及群落结构的影响
2019-05-31谌亚贾雨桥王欣宇杨万勤吴福忠张丽卫芯宇陈子豪杨玉莲谭波
谌亚 ,贾雨桥,王欣宇,杨万勤,吴福忠,张丽,卫芯宇 ,陈子豪,杨玉莲 ,谭波*
1. 四川农业大学生态林业研究所/长江上游林业生态工程四川省重点实验室/高山森林生态系统定位研究站/水土保持与荒漠化防治省级重点实验室,四川 成都 611130;
2. 绵阳师范学院/生态安全与保护四川省重点实验室,四川 绵阳 621000
土壤微生物是土壤生态系统中重要的组成部分,其主要以地上和地下凋落物、根系分泌物、木质残体以及动物残骸为碳源,在森林凋落物的分解、土壤肥力的形成与维持、养分循环与碳氮周转等生态过程中发挥着重要作用(Schloter et al.,2003;Green et al.,2004)。土壤微生物对外界环境的变化极为敏感,其生物量和群落结构变化是土壤特征变化的早期响应指标(Zelles et al.,1992),被认为是比土壤总有机质更可信的环境变化指示因子(Chen et al.,2008)。
土壤的季节性冻融是全球中、高纬度或高海拔地区生态系统的普遍现象(孙辉等,2008),短期的冻融循环更是季节性冻融过程中重要组成部分,其对土壤微生物的影响可能更为明显。冻融过程会改变土壤结构、破坏土壤团聚体和凋落物中微生物及动植物残体细胞,但其释放出的底物和养分又为存活的土壤微生物提供了有效基质(Groffman et al.,2001;Herrmann et al.,2002)。普遍认为,冻融循环对土壤微生物群落的作用机制可能包括两方面,(1)冻融的致死作用。冬季土壤冻结和冻融循环作用能降低土壤微生物活性甚至将其致死(Urakawa et al.,2014)。(2)养分供应不足。随着冻融循环次数的增加,从土壤团聚体和凋落物中释放出来的可溶性养分下降,导致微生物生物群落发生变化(Cleveland et al.,2014;Herrmann et al.,2002)。因此,冻融期间强烈的环境变化可能极大地影响着土壤微生物群落的组成和结构。
川西亚高山森林是中国西部高山林区的主体,在气候调节、水土保持、水源涵养、生物多样性保育和全球碳循环等方面具有不可替代的作用和地位(Yang et al.,2005)。受青藏高原隆起影响,该区森林土壤每年具有明显的季节性冻融过程(Yang et al.,2007)。冻融循环研究对于预测全球气候变化背景下,土壤生态系统对冻融特征格局变化的反馈有非常重要的科学意义,但作为全球气候变化的敏感区域,目前有关亚高山森林土壤微生物对冻融循环变化响应的研究还较少,这不仅限制了对亚高山森林土壤微生物群落及亚高山森林生态系统物质循环和能量转换过程的了解,还很难满足全球变化与区域响应研究的需要。因此,以受季节性冻融影响明显的川西亚高山森林土壤为研究对象,采用微缩实验,模拟冻融循环对亚高山森林土壤微生物的影响,以期为深入理解全球变暖背景下亚高山森林生态系统过程对季节性冻融变化的响应提供参考。
1 材料与方法
1.1 研究区域概况
研究区域位于四川省西部,绵阳市平武县王朗国家级自然保护区(32°49′-33°02′N,103°55′-104°10′E,海拔2300-4980 m),地处青藏高原与四川盆地的过渡地带。该区域属丹巴-松潘半湿润季风气候,干湿季节差异明显,年降水量 801-825 mm,主要集中在5-8月,年平均温度为2.9 ℃,土壤季节性冻融期长达 5-6个月。研究区域内优势乔木为岷江冷杉(Abies faxoniana)、川西云杉(Picea balfouriana)、白桦(Betula platyphylla)、红桦(Betula albo-sinensis)等,优势灌木为康定柳(Salix paraplesia)、高山杜鹃(Rhododendron lapponicum)、缺苞箭竹(Fargesia denudata)等,土壤为棕壤和暗棕壤(Yang et al.,2005;卫芯宇等,2018)。
1.2 试验设计
2017年5月采集供试土壤,在王朗国家级自然保护区的针阔混交林、针叶林以及阔叶林内分别选取3个坡向、坡度相近的样地(表1)。在每个样地内随机布设1个5 m × 5 m的样方,收集各样地内的凋落叶,土壤采样时,先将土壤表面的凋落物及苔藓等地被物清理干净,通过5点取样法,以长宽各为30 cm的方形采集0-10 cm土壤,各林型分别取得 15份样品,混合均匀后取部分样品带回实验室,剔除根系和杂质,一部分用于测定土壤理化性质,另一部分过2 mm筛,存于4 ℃冰箱待用。对应收集各样地的凋落叶,风干备用,同时取一部分凋落叶测定其理化性质。土壤及凋落叶的理化性质详见卫芯宇等(2018)。
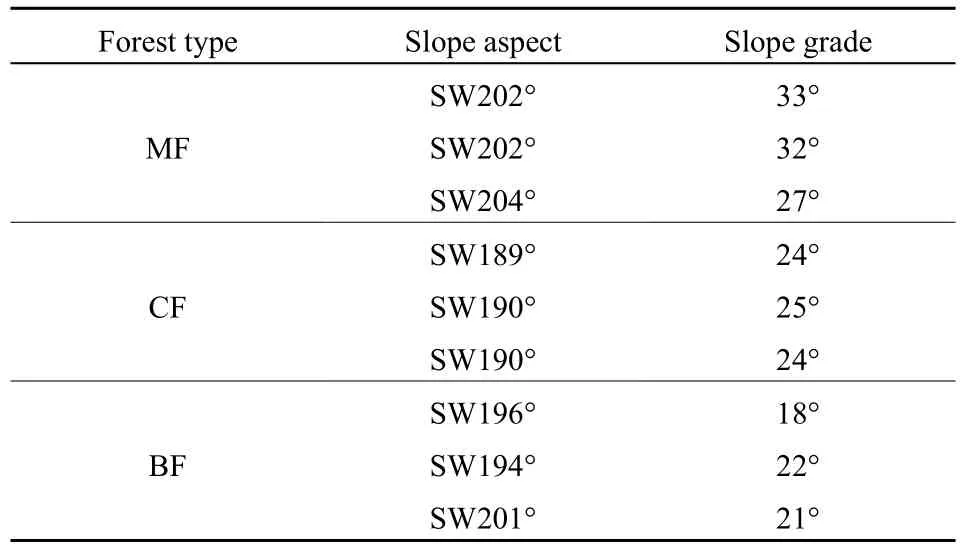
表1 样地的坡度和坡向Table 1 Slope aspect grade of the sampling sites
每个样地各称取250 g过筛新鲜土样,置于350 mL培养罐中。土壤含水量统一调节为60%田间持水量。为了解冻融循环对凋落叶分解过程中土壤微生物群落的影响,模拟表层土原始状态,在每一类型土壤中添加凋落叶,依据课题组前期对该地区各森林类型凋落叶年凋落量的调查研究(Yang et al.,2006),计算该地区单位面积上的实际凋落叶凋落量,针叶林、针阔混交林和阔叶林分别为 324.4、246.8和 171.2 g·m-2,再根据培养罐的横截面积(50.24 cm2)确定凋落叶的添加量,每个处理设置3个重复。本试验添加的针叶林、针阔混交林和阔叶林凋落叶有机碳含量分别为 348.00、342.86和452.25 g·kg-1(卫芯宇等,2018),碳含量差异不显著,便于进行不同林型间研究结果的比较。基于前期Wu et al.(2010)的观测数据和温度动态特征,该地区冬季土壤冻结时和土壤融化时温度分别长时间维持在-5 ℃和5 ℃左右,预实验结果表明,在-5 ℃条件下冻结12 h,5 ℃条件下解冻12 h,能保证土样冻结及完全解冻,所以将这样的一天定义为1个冻融周期,共80次。用保鲜膜封住培养罐口防止其他杂质的输入,并用针在保鲜膜上扎多个小孔,保持培养罐内外空气流通。
1.3 样品采集与分析
分别在冻融循环培养的第 5、10、20、40、80个周期取样并测定各项指标。PLFA提取的所有操作均在通风橱中进行。提取过程参考 Bossio et al.(1998)的方法加以改进,进行单项萃取。称取(1.00±0.05) g样品装入30 mL聚四氟乙烯的棕色玻璃瓶内,依次加入提取液PBS 4.8 mL(磷酸钾缓冲液,pH 7.4)、甲醇(HPLC)12 mL、三氯甲烷(HPLC)6 mL,涡旋30 s,超声10 min(37 ℃,100 Hz),37 ℃水浴30 min,冷却后倒入50 mL广口三角瓶中,加6 mL三氯甲烷(HPLC)和6 mL PBS,轻轻摇匀后静置,避光过夜。吸取下层氯仿相液体,过0.45 μm孔径的有机纤维滤膜,再过经5 mL三氯甲烷(HPLC)活化的硅胶柱。依次用(2 mL×3次)三氯甲烷(HPLC)和(2 mL×3次)丙酮(HPLC)除去非极性磷脂和糖脂。将用甲醇(HPLC)(2 mL×3次)洗脱的极性磷脂用N2吹干,提取物用1 mL碱性甲醇(质量浓度为5.6 g·L-1KOH甲醇溶液)和1 mL 甲苯-甲醇溶液(V/V=1∶1)分解,涡旋 30 s,37 ℃水浴30 min,冷却后用1 mol·L-1乙酸中和,生成的FAMEs(脂肪酸甲酯)再用(2 mL×2次)三氯甲烷-正已烷(V/V为 1∶4)提取,氮气吹干。吹干后的提取物用200 μL三氯甲烷-正已烷(V/V为1∶4)溶解,再用岛津QP2010GC-MS分析仪(GC/MS,Model QP-2010,Shimadzu,Japan)检测。
土壤微生物群落结构分析采用磷脂脂肪酸(PLFA)生物标记法。PLFA采用标准命名法进行分类命名,分子式以“X:YωZ(c/t)”表示,其中,X表示脂肪酸分子的碳原子总数,Y表示不饱和烯键数,ω表示烯键距羧基的位置,Z表示烯键或环丙烷链的位置;前缀i(iso)和a(anteiso)分别代表顺式异构和反式异构;cy代表环丙基;Me代表甲基;OH代表羟基;后缀c(cis)和t(trans)分别代表顺式和反式同分异构(Frostegård et al.,1993)。表征各微生物种群的磷脂脂肪酸标记物见表 2,采用各类群标记物生物量之和,计算真菌/细菌和革兰氏阳性菌/革兰氏阴性菌比值。
1.4 数据处理和统计分析
PLFAs为样品中各类微生物的PLFA之和。引入生物多样性指数:Shannon-Wiener多样性指数(H)、Pielou均匀度指数(J)、Margalef丰富度指数(SR)和Simpson优势度指数(D)来分析土壤微生物多样性。其中,
多样性指数:

均匀度指数:

丰富度指数:

优势度指数:

式中,ni为每种 PLFA的质量摩尔浓度,nmol·g-1;N为 PLFA 总质量摩尔浓度,nmol·g-1;S为PLFA种类数(常晨晖等,2014)。
运用 Excel 2016和 SPSS 20.0(IBM SPSS Statistics,Chicago,IL,USA)软件对数据进行统计分析。采用一般线性模型对3种林型各指标进行重复测量方差分析,单因素方差分析(one-way ANOVA)对同次取样不同林型和同林型不同冻融循环次数各指标进行方差分析,LSD法进行多重比较(α=0.05)。运用 Origin Pro 2018 软件作图,Canoco for Windows 5.0分析微生物群落结构与环境因子的关系。
2 结果与分析
2.1 土壤微生物生物量
重复测量方差分析结果表明(图 1),冻融循环(FTC)对细菌、革兰氏阳性菌、革兰氏阴性菌及真菌 PLFAs含量和真菌/细菌比值都有显著影响(P<0.05)。3种森林土壤中细菌、革兰氏阳性菌和革兰氏阴性菌的 PLFAs含量呈现随冻融循环次数增加而逐渐降低的趋势(图1a-图1 c),真菌PLFAs含量和真菌/细菌比值则随冻融循环次数增加表现出先降低后在第 40次冻融循环时升高再降低的趋势(图1d和图1e),其中真菌/细菌比值仅阔叶林存在显著差异(P<0.05),在第5次冻融循环时比值最大,在第 20次冻融循环时最低。冻融循环次数和林型对革兰氏阳性菌/革兰氏阴性菌都无显著影响。
单因素方差分析结果表明,不同林型的土壤细菌和革兰氏阳性菌的PLFAs含量在第5次和第80次冻融循环时才有显著差异(P<0.05),且混交林显著高于阔叶林,表现为混交林>针叶林>阔叶林。混交林、针叶林和阔叶林第80次冻融循环的细菌PLFAs含量分别较第5次低71.9%、73.7%、74.6%,革兰氏阳性菌PLFAs含量分别较第5次低77.1%、68.8%、73.7%(图1a和图1b)。各林型的革兰氏阴性菌和真菌的 PLFAs含量在各个测定冻融循环周期差异都不显著,混交林、针叶林和阔叶林在第80次冻融循环的革兰氏阴性菌 PLFAs含量较第 5次低70.6%、78.1%、78.8%,真菌PLFAs含量较第5次则分别低 55.5%、75.4%、84.7%(图 1c和图1d)。

表2 表征特定微生物的PLFA生物标记物Table 2 PLFAs used in this study as biomarker
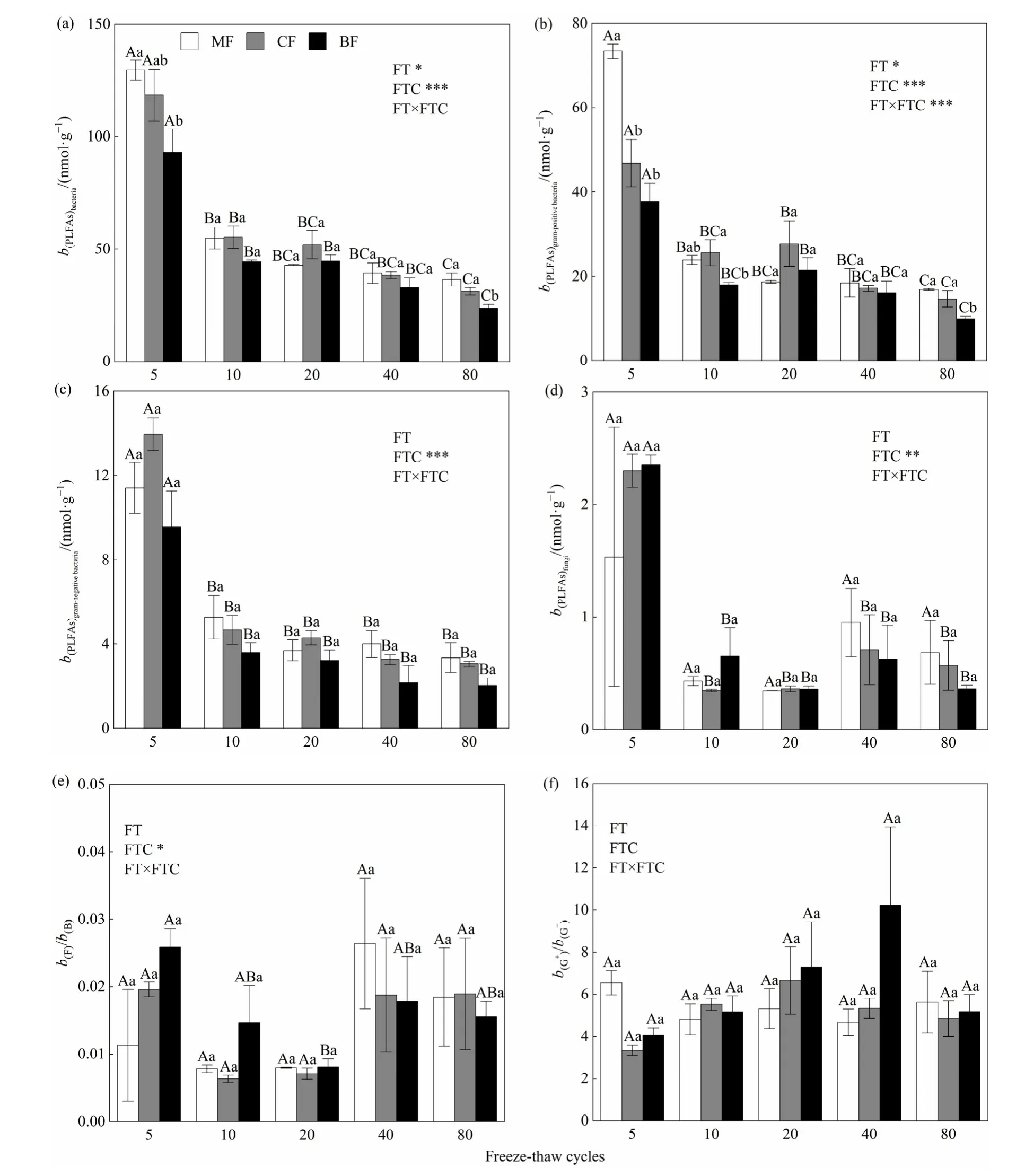
图1 3种林型土壤微生物群落磷脂脂肪酸质量摩尔浓度及比值Fig. 1 Soil microbial PLFAs molality and ratio in three forest types.
2.2 土壤微生物群落多样性
冻融循环对 3种林型的 Margalef丰富度指数(SR)、混交林和针叶林的Shannon-Wiener多样性指数(H)和 Pielou均匀度指数(J)及混交林的Simpson优势度指数(D)都有显著影响(P<0.05)。混交林Shannon-Wiener多样性指数和Pielou均匀度指数随冻融循环次数增加而逐渐增加,针叶林和阔叶林均呈现下降趋势,而Simpson优势度指数则表现出与之相反的变化动态。3种林型的Margalef丰富度指数整体呈上升趋势(图2)。在第5次冻融循环时,混交林的 Shannon-Wiener多样性指数和Pielou均匀度指数都低于针叶林和阔叶林,随着冻融循环次数的增加,在第 80次冻融循环时,混交林和针叶林的Shannon-Wiener多样性指数和Pielou均匀度指数都显著高于阔叶林,而Simpson优势度的结果完全相反,表现为混交林和针叶林显著低于阔叶林。混交林的Margalef丰富度指数在第5次冻融循环时显著低于针叶林和阔叶林,但随着冻融循环次数的增加,各林型间的差异变得不显著(图2),说明可能随着冻融循环次数的增加,土壤微环境中的土壤微生物种类趋于稳定。
3种林型5个冻融循环周期的指数相关性分析表明,多样性指数与均匀度指数相关系数为0.913,呈极显著正相关,优势度指数与多样性指数相关系数为0.899,与均匀度指数相关系数为0.921,都呈极显著负相关,而与丰富度指数的相关系数小于0.5(表3)。由此推测,微生物多样性更易受均匀度和优势度的影响,即与PLFA含量变化有关,尤其是优势脂肪酸含量变化对多样性指数影响较大。
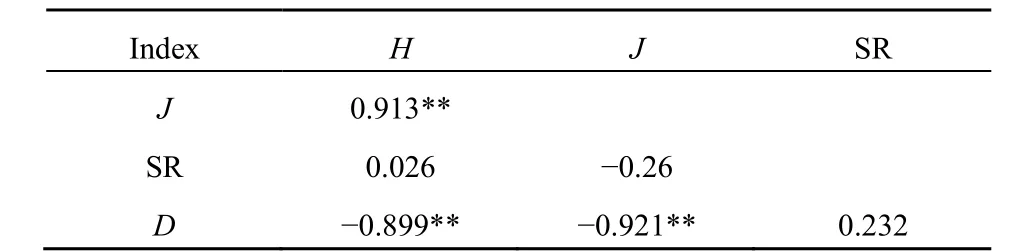
表3 不同林型下土壤微生物各指数相关性分析结果Table 3 Results of correlation analysis of soil microbial indices under different forest types

图2 3种林型土壤微生物多样性指数Fig. 2 Soil microbial diversity index of three forest types
2.3 土壤微生物群落结构与土壤环境因子的关系
冗余分析结果表明,前2轴共同解释了86.5%的变异,其中第1轴的贡献值为63.0%(图3)。土壤环境因子中,铵态氮(F=5.3,P=0.008)和硝态氮(F=4.6,P=0.024)显著影响了土壤微生物群落结构,表现为铵态氮和硝态氮与总微生物量、细菌、真菌、革兰氏阳性菌和革兰氏阴性菌 PLFAs含量呈显著正相关,真菌/细菌比值与铵态氮呈正相关,与硝态氮呈负相关,革兰氏阳性菌/革兰氏阴性菌比值铵态氮呈负相关,与硝态氮不相关。

图3 土壤微生物群落结构与土壤环境因子的冗余分析Fig. 3 Redundancy analysis (RDA) of relationships between soil microbial community structure and soil environmental factors
3 讨论
冻融循环一般通过改变土壤水分的状况及分布来直接影响土壤微生物(DeLuca et al.,1992),其会对土壤微生物生物量和群落结构造成影响,这在亚高山森林土壤中尤为明显(张丽等,2015)。本研究中,相同林型下细菌、革兰氏阳性菌、革兰氏阴性菌和真菌的 PLFAs含量都随着冻融循环次数的增加而降低,一方面可能是因为冻融循环直接致使部分土壤微生物死亡,降低了可培养微生物的多样性(DeLuca et al.,1992;Walker et al.,2006),另一方面可能是因为本试验有限的碳源(卫芯宇等,2018),使得微生物可利用的分解底物受限导致部分微生物死亡。在培养期间土壤细菌、革兰氏阳性菌和革兰氏阴性菌的 PLFAs含量都随冻融循环次数的增加而逐渐降低,而真菌PLFAs含量则在第 40次冻融循环表现出升高趋势,可能原因是此时土壤的水分迁移达到了一个动态平衡,土壤处于新的动态稳定平衡状态(王大雁等,2005),真菌群落的耐受性高(Buckeridge et al.,2008),在环境稳定初期取得了生存优势。同时,在第 40次冻融循环后,各林型的细菌、革兰氏阳性菌、革兰氏阴性菌和真菌的 PLFAs含量随冻融循环次数增加都无显著差异(图1),都表现为混交林>针叶林>阔叶林,也可以说明此时冻融循环状态下的土壤微环境是比较稳定的。
不同林型的凋落物物种组成不同,可改善林型的养分状况,进而增加微生物可获得资源的变异度(陈法霖等,2011),不同种类土壤微生物对这些变化的反应可能存在差异(李晶等,2013),导致土壤微生物群落结构和功能之间存在相互影响(Heemsbergen et al.,2004)。在第40次冻融循环后,混交林的细菌、真菌、革兰氏阳性菌和革兰氏阴性菌PLFAs含量都高于单一针叶林和阔叶林(图1),表明与混交林相比,单一针叶林和阔叶林为土壤微生物群落提供生境和食物的能力较低,混交林凋落物更容易被土壤微生物群落利用从而合成自身的生物量,与胡亚林等(2005)的针叶与阔叶混合凋落物的分解能提高了微生物生物量的研究结果相似。
真菌/细菌和革兰氏阳性菌/革兰氏阴性菌的比值常被用作微生物群落整体结构变化的重要指标(Boyle et al.,2008),较大的真菌/细菌比值表明真菌生物量以及真菌菌丝体增多,与土壤有效养分的接触面积增大,土壤养分元素的流失减少,因而土壤生态系统越来越稳定(Franciska et al.,2006)。冻融循环对真菌/细菌比值有显著影响,且表现为先下降后在第40次冻融循环升高后降低的趋势(图1e),与真菌PLFAs含量的变化趋势一样,也说明在第40次冻融循环后土壤环境趋于稳定。从图 1可以看出革兰氏阳性菌PLFAs含量远高于革兰氏阴性菌,Margesin et al.(2009)研究表明革兰氏阴性菌更易生长在营养丰富的土壤中,而革兰氏阳性菌将在资源受限的土壤中占优势,较高比例的革兰氏阳性菌是土壤环境从富营养到寡营养的转变(张地等,2012),说明在一个无外来物质循环和能量流动的环境中可利用资源是会逐渐减少的。
冻融循环对3种林型的Margalef丰富度指数、混交林和针叶林的 Shannon-Wiener多样性指数和Pielou均匀度指数及混交林的Simpson优势度指数都产生了显著影响,混交林多样性指数和均匀度指数随冻融循环次数增加而逐渐增加,针叶林和阔叶林均呈现下降趋势,而优势度指数则表现出与之相反的变化动态。3种林型的丰富度指数整体呈上升趋势(图 2)。频繁的冻融循环使微生物群落处于一个极不稳定的状态,凋落物受冻融循环的影响而破碎,剩余只能被部分微生物利用的物质为少数的微生物提供了有效基质(Campbell et al.,2005),不稳定的环境使得部分微生物总体数量减少,而低温环境下存活的耐寒微生物一定程度影响了丰富度指数的变化(李俊等,2016)。严海元等(2010)研究认为多样的凋落物能够为微生物提供多样丰富的基质来源,因而混合凋落物比单一凋落物有更多适应性的微生物存在,所以混交林多样性指数和均匀度指数随冻融循环次数增加而逐渐增加,针叶林和阔叶林均呈现下降趋势,优势度指数与多样性指数和均匀度指数呈极显著负相关。
此外,土壤氮的有效性常常能影响微生物的生长,环境中氮有效性越高,微生物的活性越强,繁殖也越快(Craine et al.,2007)。通常地,土壤冻融循环初期的土壤团聚体结构被破坏(Edwards,1991),大团聚体破碎成小团聚体,使土壤中原本不可被利用的养分释放,增加了土壤的可利用养分(李忠佩等,2004;Freppaz et al.,2007)。因此,在第5次冻融循环后,细菌、真菌、革兰氏阳性菌和革兰氏阴性菌PLFAs含量最高。然而,随着冻融循环次数的增加,分解底物逐渐被耗尽,微生物数量也逐渐减少(孙辉等,2008;张丽等,2015)。这与已有的研究(Freppaz et al.,2007;罗亚晨等,2014;张丽等,2015)以及冗余分析中土壤养分有效性与微生物生物量和群落结构显著相关的结果一致(图3)。
4 结论
冻融循环对土壤微生物群落的影响随林型的不同而存在差异,与5次冻融循环相比,3种林型的细菌、真菌、革兰氏阳性菌和革兰氏阴性菌的PLFAs含量在经过80次冻融循环后均出现降低,在第 40次冻融循环后,土壤微环境可能处于一个动态稳定平衡状态。冻融循环显著影响阔叶林的真菌/细菌比值,林型对真菌/细菌比值和革兰氏阳性菌/革兰氏阴性菌比值影响不显著。冻融循环对3种林型的丰富度指数、混交林和针叶林的多样性指数和均匀度指数及混交林的优势度指数都产生了显著影响,耐寒性强的微生物在冻融循环作用下更具生存优势。冻融过程中土壤养分有效性与微生物群落显著相关,全球变暖导致冬季冻融循环格局变化可通过改变土壤养分有效性影响亚高山森林土壤微生物生物量和多样性。
