PKG、PKA及VASP在人结直肠癌组织中的表达及临床意义*
2019-05-30翁稚颖朱焕利郑昌博刘伟军代泽兰杨之斌杨为民
陈 晨,金 旭,翁稚颖,朱焕利,郑昌博,刘伟军,代泽兰,肖 创,杨之斌△,杨为民▲
(1.昆明医科大学药学院暨云南省天然药物药理重点实验室,昆明 650500;2.昆明医科大学第三附属医院暨云南省肿瘤医院,昆明 650118)
发生在结肠和直肠的结直肠癌(colorectal cancer,CRC)是全球第三大常见恶性肿瘤[1]。据世界卫生组织预计,到2030年,CRC的预期发病者超过220万新病例和110万死亡[2]。在我国,CRC的发病率和病死率每年均保持上升趋势,由高到低依次为东部地区、中部地区、西部地区,且男性高于女性,年长者高于年轻者[3-4]。CRC的一般治疗手段包括手术切除、放射治疗和化疗[5]。另外,使用抗血管生成疗法(如贝伐单抗)和表皮生长因子受体(epithelial growth factor receptor,EGFR)抑制剂(如西妥昔单抗)的靶向治疗也只在特定患者中有一定治疗作用[6-7],但患者的生存率仍然不高,5年内约为60%[8],因此,需要寻找新的治疗方案。
cGMP依赖性蛋白激酶(cGMP-dependent protein kinase,PKG)是一种丝氨酸/苏氨酸蛋白激酶。在哺乳动物细胞中,PKG有两种亚型,即PKG-Ⅰ和PKG-Ⅱ。近年来的一些研究表明,PKG具有舒张血管,改善血管功能等作用[9-10],但在抗肿瘤特别是抗结肠癌方面鲜为少见。cAMP依赖性蛋白激酶A(cAMP-dependent protein kinase,PKA)与PKG同样是一种丝氨酸/苏氨酸激酶,目前对PKA的研究大多集中在大脑学习记忆方面,包括神经退行性疾病阿尔兹海默症和帕金森病等[11-12],但关于结肠癌方面的报道却较少。血管扩张刺激磷蛋白(vasodilator-stimulated phosphoprotein,VASP)是一种调节细胞形状和极性的肌动蛋白结合蛋白,是PKG与PKA的共同作用底物蛋白。PKG优先磷酸化Ser239(p-VASP Ser239)处的VASP,而PKA则是优先磷酸化Ser157(p-VASP Ser157)处的VASP。有报道指出,VASP蛋白的表达与癌症患者的疾病进展呈正相关,并且强调了它在恶性肿瘤中的重要性[13]。因此作者推测,作为VASP的直接上游蛋白激酶,PKG与PKA的表达与活性的变化与CRC有关。
基于以上文献报道,本研究通过检测分析CRC组织中PKG、PKA、VASP及其磷酸化蛋白的表达情况,旨在为CRC患者寻找到新的治疗靶点。
1 资料与方法
1.1一般资料 收集2015年3-9月云南省肿瘤医院结肠外科经手术切除的20例患者的癌变组织及其癌旁正常组织。20例患者相关的临床病例指标包括性别、年龄、肿瘤直径大小、肿瘤分化程度、TNM分期以及肿瘤标志物癌胚抗原(CEA)及糖蛋白125(CA-125)的测定结果。所有组织标本在手术完成后30 min获得,再放于液氮中保存。
1.2方法
1.2.1主要试剂与仪器 PKG-Ⅰ兔单抗 (货号:#3248) 、PKG-Ⅱ兔单抗 (货号:#3248)、PKA兔单抗 (货号:3927S)以及GAPDH兔单抗(货号:#2118)均购自美国Cellsignaling technology公司;VASP兔多抗(货号:SC-1395)、p-VASP Ser239兔多抗(货号:SC-23507)、p-VASP Ser157鼠单抗(货号:SC-365563)、羊抗兔二抗(货号:SC-2005)和羊抗鼠二抗(货号:SC-2004)均购自美国Santa cruz 公司;二辛酸(BCA)蛋白浓度测定试剂盒(货号:P0012)购自上海碧云天生物技术有限公司;Western blot检测所用十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳仪和半干转仪购自美国BIO-RAO公司。
1.2.2Western blot 分析 将标本从液氮中取出后,快速剪成小块后在冰上进行匀浆。收集匀浆经4 ℃ 10 000×g离心10 min,取上清液。以牛血清清蛋白为标准,用BCA法对蛋白进行浓度测定。上样20 μg 蛋白进行10% SDS-PAGE电泳,后予15 V,30 min半干转印至聚偏氟乙烯(PVDF)膜上。在室温下,用5%脱脂奶粉TBST缓冲液对膜进行封闭1 h。TBST洗膜3次,每次5 min。PKG-Ⅰ、PKG-Ⅱ、PKA、VASP、 p-VASP Ser157和p-VASP Ser239各个抗体(1∶500~1∶1 000) 4 ℃孵育过夜。如前所述洗膜后,将膜与辣根过氧化物酶标记的抗IgG抗体(1∶8 000~1∶10 000)室温孵育1 h。洗膜,化学发光(ECL)试剂显迹。同时用GAPDH抗体(1∶10 000)作为内参照。采用Scion Image图像分析系统对Western blot图像进行分析计算。每例标本每个蛋白重复3次。

2 结 果
2.1临床病理指标的相关性分析 PKG-Ⅰ、PKG-Ⅱ、PKA、VASP、 p-VASP Ser157和p-VASP Ser239各蛋白经Western blot检测,发现其在每例CRC标本中均有表达。这些蛋白的表达水平与患者性别、年龄、肿瘤大小、分化程度、TNM分期及CEA和CA-125有一定的相关性,但差异无统计学意义(P>0.05),见表1。
2.2Western bolt检测结果 Western blot结果显示,CRC组织中的PKG-Ⅰ、PKG-Ⅱ、VASP、p-VASP Ser157和p-VASP Ser239蛋白表达水平均显著低于癌旁正常组织(P<0.05)。然而,CRC组织中的PKA蛋白表达水平与癌旁正常组织相比并无明显差异,见图1。
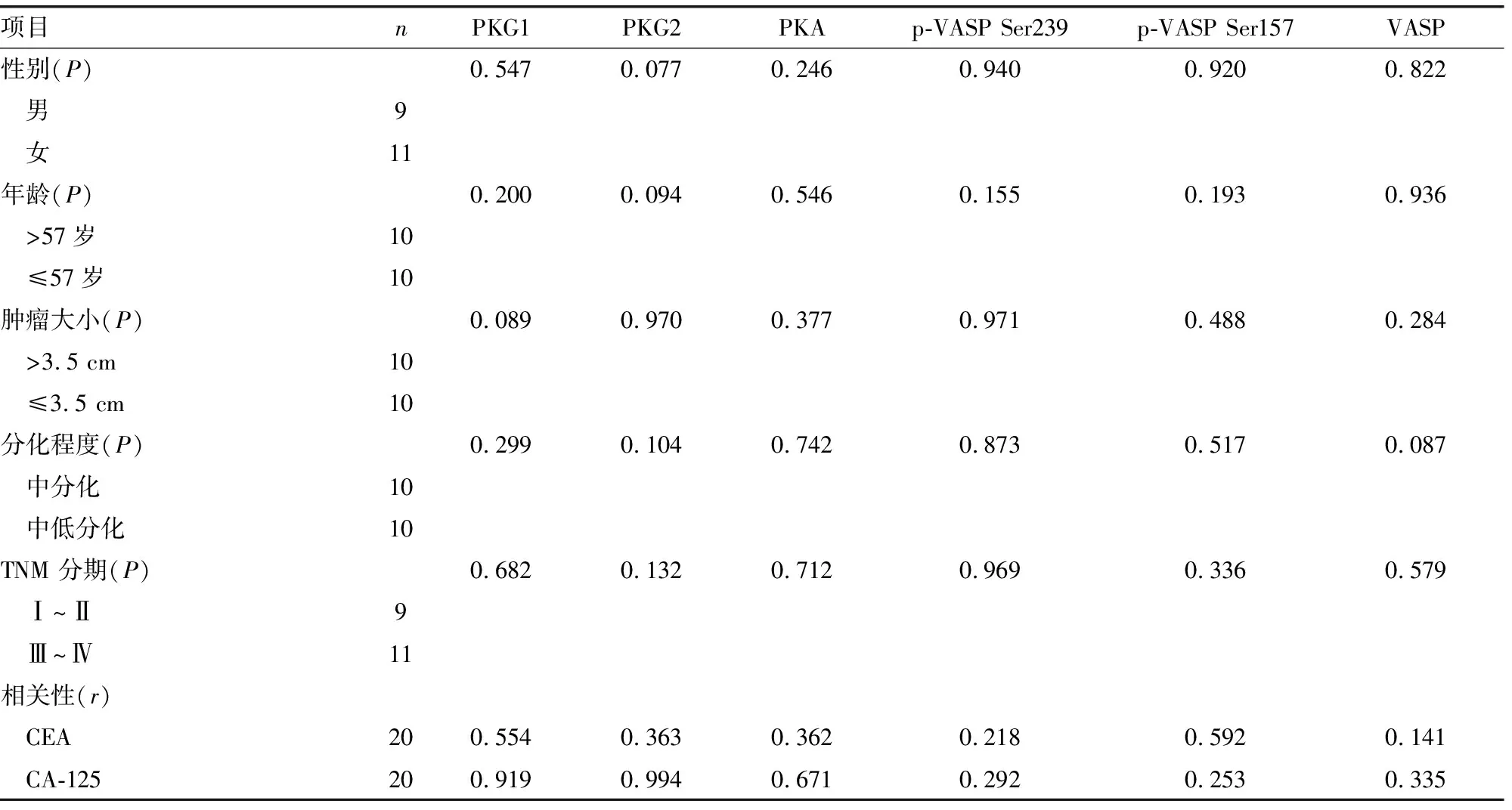
表1 CRC组织中各蛋白因子与临床病理指标的相关性(n=20)
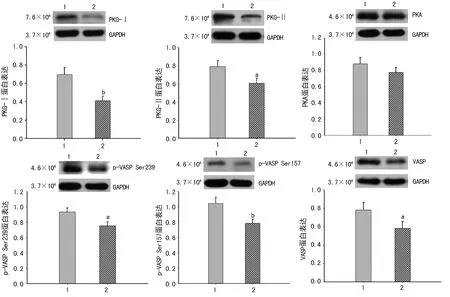
1:癌旁正常组织;2:结直肠癌组织;a:P<0.05,b:P<0.01,与癌旁正常组织比较
图1Westernblot检测CRC组织与癌旁正常组织中PKG、PKA、VASP及其磷酸化蛋白表达
3 讨 论
PKG是蛋白激酶AGC家族的成员,从两个不同的基因转录为两种亚型,即PKG-Ⅰ和PKG-Ⅱ。PKG-Ⅰ分布比较广泛,在血管平滑肌细胞(VSMC)、神经元、血小板、血管和肠平滑肌细胞分布较多,在心肌、血管内皮和大多数白细胞中表达较少。PKG-Ⅱ表达更多的分布于脑、肠和肾。在肠道中,PKG-Ⅱ参与囊性纤维化跨膜调节剂阴离子通道和氯通道的活化,引起氯化物和碳酸氢盐的外排,然后使水流入肠腔,从而调节肠壁细胞内外的渗透压[14]。PKA是A型激酶锚定蛋白家族成员,由催化亚基和抑制性调节亚基组成,其通过磷酸化底物蛋白或转录因子,以调节基因的转录翻译。PKA参与多个信号转导网络以调节细胞的生长、代谢及增殖等过程[15]。VASP属于接头蛋白 Ena/VASP 家族,可将细胞骨架系统连接到信号转导通路,并且它在细胞骨架组装、成纤维细胞迁移、血小板活化和轴突导向中发挥重要作用[16]。VASP作为PKG与PKA的共同作用底物,其区别在于两种激酶对其作用的磷酸化位点不同,分别为p-VASP Ser239与p-VASP Ser157,两种磷酸化蛋白的表达水平分别可提示PKG与PKA的活化水平。在本研究中,作者通过检测20例CRC患者病变癌组织与正常癌旁组织中的PKG-Ⅰ与PKG-Ⅱ的表达水平,发现CRC组织中的两种蛋白显著低于正常的癌旁组织;同时,CRC组织中反映PKG活性的p-VASP Ser239的表达水平也显著降低。这一研究结果提示,PKG蛋白的表达及活性均与CRC密切相关。虽然CRC组织中PKA的表达水平与正常组织中的表达相比并没有明显差异,但反映PKA活性的p-VASP Ser157的表达明显降低,这一结果提示,CRC虽对PKA蛋白表达无显著影响,但对其活性却有显著影响。另外,CRC中的VASP的表达水平同样明显降低。
WALDKIRCH等[17]的研究结果发现PKG-Ⅰ在肿瘤组织高表达时可以抑制肿瘤细胞的侵袭,因此推测其可能具有一定的抗肿瘤作用。与正常细胞相比,许多肿瘤类型的PKG-Ⅰ表达降低,其中也包括从结肠切除标本中收集的肿瘤组织。有研究表明,PKGⅠ对人结肠癌细胞SW620的生长抑制是由于减少血管内皮生长因子导致血管生成严重缺乏。有研究人员提出其机制可能是PKG-Ⅰ参与的凋亡通路MEKK1/MEK4/ JNK通路有关[18]。虽然目前还少有PKG-Ⅱ对结肠癌发生发展作用方面的报道,但已经有关于其他癌症方面的报道。FALLAHIAN等[19]的研究结果显示cGMP可以诱导乳腺癌细胞的凋亡,并提出这一作用时与PKG-Ⅱ有关。近年来,有研究显示PKG-Ⅱ在胃癌组织中表达和活性均明显降低,并且证实提高PKG-Ⅱ活性可明显抑制胃癌细胞的生长,而这一作用可能与EGFR/MAPK/ERK通路和EGFR/MAPK/JNK通路相关。本研究结果显示,PKG-Ⅰ与PKG-Ⅱ在CRC中的表达水平低于正常组织,并且反映其活性的磷酸化底物p-VASP Ser239的蛋白同样在CRC组织中表达减少,表明PKG两种亚型的表达及活性均被抑制,这一结果与上述WALDKIRCH等[17]的结果一致。
钱晶等[20]在研究CRC肝转移中cAMP/PKA通路的作用时发现,给小鼠腹腔注射cAMP类似物8-溴-cAMP后,原发灶中的PKA有微弱减少,而VEGF、E-钙粘蛋白及MMP2 的表达却有显著变化。TINSLEY等[21]研究表明增加cAMP以激活结肠肿瘤细胞中的PKA并不显著促成细胞死亡。然而,LEIPHRAKPAM等[22]的研究结果发现,在FET和GEO结肠癌细胞实验中转化生长因子β(TGF-β)和胰岛素样生长因子1受体(IGF1R)增加细胞凋亡的机制可能与PKA的激活有关。
PKG与PKA是分别依赖于细胞内cGMP与cAMP水平磷酸化特定蛋白的激酶,与其相关的经典的信号通路分别为NO-cGMP-PKG与AC-cAMP-PKA。BABYKUTTY等[23]的研究显示NO-cGMP-PKG通过激活ERK-1/2和AP-1促进MMP-2/9的表达,可以抑制结肠癌细胞迁移/侵袭。FRANCIS等[24]发现细胞内的磷酸二酯酶(PDE)的可同时降低胞内cGMP与cAMP水平,抑制PKG与PKA活性,并表明非甾体类抗炎药可通过抑制PDE的活性可增加cGMP与cAMP水平从而激活PKG与PKA,但通过抑制Wnt/β-Catenin信号通路诱导结肠肿瘤细胞凋亡仅与PKG有关[25]。
VASP作为一种肌动蛋白结合蛋白,也是细胞骨架蛋白,它控制着癌细胞的形状、极性和细胞分裂,迁移和侵袭的膜组织。有研究表明,VASP Ser磷酸化作为调节肌动蛋白聚合速率和细胞骨架依赖性细胞器的关键因子,调控着丝状伪足、板状伪足、侵袭伪足、粘着斑和细胞-细胞连接等肌动蛋白依赖的膜细胞器[26]。宋胜江等[27]的研究发现,VASP在结直肠癌组织中的表达明显高于相对应的癌旁正常组织,这一结果与本研究结果一致。ALI等[28]研究结果发现,分别抑制p-VASP Ser157和诱导p-VASP Ser239 VASP磷酸化可控制肌动蛋白细胞骨架组装以及结肠癌细胞的存活和死亡行为,这一结果表明,VASP Ser磷酸化的失调可能是造成结肠癌永生和侵袭性细胞表型发育的潜在因素。在本研究中反映PKA活性的p-VASP Ser157在CRC组织中与p-VASP Ser239同时降低,与ALI等[28]研究相悖,推测可能与研究对象不同有关:ALI等[28]研究用的结肠癌细胞,细胞种类较为单一,而本研究中用的是结肠癌组织,可能其中也含有其他细胞种类;另外,由于临床标本珍贵、难得,推测可能与本研究的样本量偏少有关,在后续相关研究中,将考虑增大样本量。
本文系统的研究了PKG两种亚型、PKA、VASP以及反映PKG与PKA活性的两种VASP Ser磷酸化蛋白的表达水平在CRC组织已经正常癌旁组织中的表达,研究结果提示PKG两种亚型的活性及表达与CRC发生发展密切相关。这一结果与目前的相关报道呈现一致性。目前,信号转导研究揭示药物开发的新治疗靶点,这种前景正在改善;而本研究结果正是为临床诊断治疗CRC寻找到新的治疗靶点提供了参考依据。
