肉苁蓉苯乙醇总苷脂质体对rrPDGF-BB诱导的肝星状细胞增殖的影响及作用机制研究*
2019-05-30马晓婷张石蕾王志强陈文龙由淑萍
马晓婷,张石蕾,王志强,陈文龙,由淑萍,刘 涛
(新疆医科大学公共卫生学院,乌鲁木齐 830011)
肝纤维化(hepatic fibrosis,HF)是一种常见的慢性肝损伤过程,许多与肝损伤相关的因素都可以导致HF[1]。在HF病理过程中常出现以下症状:肝细胞坏死、结缔组织异常增生、肝循环紊乱等,最终导致肝硬化继而引发肝衰竭[2]。之前的研究报道指出,HF是一种可逆的病理现象,早期预防或治疗HF对慢性肝病的治疗有重要意义[3]。目前研究的重点是寻找疗效确切、不良反应小的药物,以延缓、抑制甚至逆转HF的进程[4]。一些临床实践和试验研究证明,中医药通过多成分、多路径、多层次、多目标的综合药理作用能减缓HF的进程[5-7]。肉苁蓉是名贵的补益类中药,分布于中国北部的干旱地区和沙漠地区[8]。脂质体作为载体在临床应用中具有安全性好、生物相容性好、载药及靶向效果明确的优点,也是最早用于靶向给药的载体[9]。本研究旨在探讨肉苁蓉苯乙醇总苷(CPhGs)脂质体对重组大鼠血小板衍生生长因子(rrPDGF-BB)诱导的肝星状细胞(hepatic stellate cell,HSC)增殖的作用,为肝纤维化的治疗提供依据。
1 材料与方法
1.1材料 用薄膜分散二次包封法制备pPB修饰的肉苁蓉总苷靶向脂质体,其粒径为212.7 nm,电位35~50 mV,包封率(38.46±7.85)%,由本实验室保存。HSC(中乔新舟),胎牛血清(美国Gibco公司),青霉素(美国Hyclone公司),链霉素(美国Hyclone公司),DMEM高糖培养基(美国Hyclone公司),四甲基偶氮唑盐(MTT,美国Sigma公司),二甲基亚砜(DMSO,美国Sigma公司),磷酸盐缓冲液(PBS,BI公司),0.25%胰酶(美国Hyclone公司),TRIzol Reagent(赛默飞公司),RevertAid First Strand cDNA Synthesis Kit(赛默飞公司),SYBR Premix Ex TaqTMⅡ(TaKaRa公司),PIPA裂解液(赛默飞公司),蛋白酶抑制剂苯甲基磺酰氟(PMSF,博士德生物),蛋白定量试剂盒(BioMIGA公司),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶制备试剂盒(北京索莱宝公司),5×Tris-甘氨酸电泳缓冲液(北京索莱宝公司),10×电转液(北京索莱宝公司),10×TBST(北京索莱宝公司),无水乙醇(天津大茂化学试剂厂),异丙醇(天津富宇精细化工有限公司),氯仿(天津大茂化学试剂厂),甲醇(天津市大茂化学试剂厂),辣根过氧化物酶标记山羊抗兔IgG(中杉金桥),rrPDGF-BB(R&D公司),4×蛋白上样缓冲液(北京索莱宝公司),兔抗β-actin多克隆抗体(北京博奥森生物科技有限公司),兔抗p38丝裂原活化蛋白激酶(MAPK)多克隆抗体(北京博奥森生物科技有限公司),兔抗p-p38 MAPK多克隆抗体(北京博奥森生物科技有限公司)。
1.2方法
1.2.1细胞培养与传代 大鼠HSC在含有100 U/mL青霉素、100 mg/L链霉素和10%胎牛血清的高糖DMEM细胞培养液,于37 ℃、5% CO2培养箱中培养。细胞隔日换液,待生长融合至80%~90%时,使用0.25%胰蛋白酶消化收集细胞,按1∶2进行传代培养,实验均采用对数生长期细胞。
1.2.2抑制率为50%时的药物浓度计算 实验设9个CPhGs脂质体系列浓度组和1个空白对照组,共10组,每组3个复孔。CPhGs脂质体系列浓度组剂量分别为117.79、58.90、29.45、14.72、7.36、3.68、1.84、0.92和0.46 mg/L。将处于对数生长期,浓度为5×104/mL的HSC-T6细胞悬液接种于96孔板,每孔添加量为100 μL,每组设3个复孔,于37 ℃、5%CO2培养箱中培养24 h后,观察细胞生长状态,若贴壁则弃上清液,根据分组设计分别更换含117.79、58.90、29.45、14.72、7.36、3.68、1.84、0.92和0.46 mg/LCPhGs脂质体的完全培养液和空白完全培养液。加药后轻晃混匀,放至培养箱继续培养48 h,镜下观察细胞状态,拿至工作台,避光,每孔加浓度为5 mg/mL的MTT 20 μL,放至培养箱,4 h后,吸去孔里的液体,每孔加入DMSO 150 μL,于摇床轻晃10 min,用酶标仪于492 nm波长测定,记录吸光度(A)值。计算各复孔A值能平均值,计算抑制率,以此找寻CphGs脂质体的最佳作用浓度。抑制率(%)=(1-各浓度的平均A值)/空白组平均A值×100%);以CPhGs脂质体作用浓度为横轴,细胞生长抑制率为纵轴,绘制CPhGs脂质体作用于HSC-T6的量效反应曲线,采用Probit分析计算50%存活率的CPhGs脂质体浓度,即为半数抑制浓度(IC50)。
1.2.3细胞分组 (1)Normal组;(2)rrPDGF-BB组;(3)rrPDGF-BB+29.45 mg/L CPhGs脂质体组;(4)rrPDGF-BB+14.72 mg/L CPhGs脂质体组;(5)rrPDGF-BB+7.36 mg/L CPhGs脂质体组。各组细胞均培养24 h后进行后续实验。
1.2.4不同浓度 CPhGs脂质体对rrPDGF-BB诱导的HSC增殖的影响 大鼠HSC以1×105/mL密度接种至96孔板,待细胞贴壁后进行分组干预,每组设3个复孔。分别培养24、48和72 h,每孔加入20 μL的MTT溶液,培养箱内37 ℃培养4 h后,弃去MTT溶液,再向各孔内加入150 μL的DMSO,置于摇床室温摇动10 min,待结晶充分溶解后,于酶标仪492 nm波长处测定A值。抑制率=[(模型组-空白组)-(用药组-空白组)]/(模型组-空白组)×100%。
1.2.5实时荧光定量聚合酶链反应(qRT-PCR)检测α-平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原和ATF-2的mRNA的表达 Trizol试剂盒提取大鼠HSC总RNA,经纯度及完整性鉴定后反转录反应生成cDNA。按照qRT-PCR试剂盒说明书建立qRT-PCR反应体系,使用qRT-PCR检测仪进行检测。qRT-PCR热循环参数:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸45 s,共40个循环。结果分析以β-actin为内参基因,确定每个样品、每个基因扩增的循环阈值(CT),按照2-△△CT计算目的基因的相对表达水平,所用引物序列见表1。

表1 目的基因和内参基因的实时荧光定量PCR引物序列
F:正向;R:反向
1.2.6Western blot法分析p-p38蛋白表达水平 收集细胞,运用RIPA裂解液提取各组细胞总蛋白,BCA法测定蛋白浓度,取相同质量的蛋白上样,经SDS-PAGE转移至硝酸纤维素膜,5%的脱脂奶粉室温封闭1 h,一抗(1∶1 000兔抗p-p38多克隆抗体;1∶1 000兔抗p38多克隆抗体)4 ℃摇床孵育过夜,TBST漂洗3次,二抗(1∶25 000辣根过氧化物酶标记山羊抗兔IgG)室温避光孵育1 h,TBST漂洗3次后,电化学发光(ECL)显影试剂盒曝光显影。利用图像分析软件Image J对条带进行灰度值的测定,计算分析各组蛋白相对表达水平,以p-p38与p38条带信号强度的比值表示p-p38蛋白表达水平。
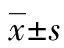
2 结 果
2.1GPhGs脂质体对HSC的IC50由于CPhGs脂质体药物浓度的递增,HSC的抑制率随之增加,当CPhGs脂质体药物浓度为117.79 mg/L时,抑制率为(69.09±1.06)%,经过Probit分析,CPhGs脂质体药物的IC50为29.06 mg/L,见图1。
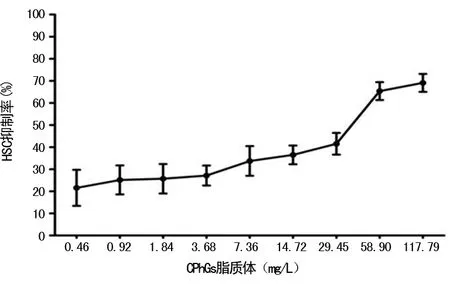
图1 GPhGs脂质体对HSC的IC50
2.2不同时间、不同浓度GPhGs脂质体对rrPDGF-BB诱导的HSC增殖的影响 MTT实验结果显示在24 h时,与Normal组比较,rrPDGF-BB组和不同浓度CPhGs脂质体组A值显著升高,差异有统计学意义(P<0.05);与rrPDGF-BB组比较,除7.36 mg/L CPhGs脂质体组外,其余浓度CPhGs脂质体组A值显著下降,差异有统计学意义(P<0.05)。在48 h和72 h时,与Nomal组比较,rrPDGF-BB组和不同浓度CPhGs脂质体组A值显著升高,差异有统计学意义(P<0.05);与rrPDGF-BB组比较,不同浓度CPhGs脂质体组A值显著下降,差异有统计学意义(P<0.05),见表2。
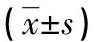
表2 不同浓度CPhGs脂质体对rrPDGF-BB诱导的HSC增殖的影响
a:P<0.05,与Normal组比较,b:P<0.05,与rrPDGF-BB组比较
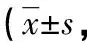
表3 不同浓度CPhGs脂质体对rrPDGF-BB诱导的HSC增殖抑制率的影响%)
a:P<0.05,与rrPDGF-BB+29.45 mg/L CPhGs脂质体组比较,b:P<0.05,与rrPDGF-BB+14.72 mg/L CPhGs脂质体组比较
2.3不同时间、不同浓度GPhGs脂质体对rrPDGF-BB诱导的HSC增殖抑制的影响 在24 h时,与29.45 mg/L和14.72 mg/L CPhGs脂质体组比较,7.36 mg/L CPhGs脂质体组抑制率显著降低,差异有统计学意义(P<0.05)。在48 h和72 h与29.45 mg/L CPhGs脂质体组比较,14.72 mg/L和7.36 mg/L CPhGs脂质体组抑制率显著降低,差异有统计学意义(P<0.05);与14.72 mg/L CPhGs脂质体组比较,7.36 mg/L CPhGs脂质体组抑制率显著降低,差异有统计学意义(P<0.05),见表3。
2.4GPhGs脂质体对rrPDGF-BB诱导的HSC α-SMA、Ⅰ型胶原、ATF-2 mRNA表达的影响 qRT-PCR实验结果显示,与Normal组比较,α-SMA和Ⅰ型胶原基因在rrPDGF-BB组、14.72 mg/L和7.36 mg/L CPhGs脂质体组表达显著增加,差异有统计学意义(P<0.05);与rrPDGF-BB组比较,α-SMA和Ⅰ型胶原基因在不同浓度CPhGs脂质体组表达下降,差异有统计学意义(P<0.05)。与Normal组比较,ATF-2基因在rrPDGF-BB组和不同浓度CPhGs脂质体组表达显著升高,差异有统计学意义(P<0.05);与rrPDGF-BB组比较,ATF-2基因在不同浓度CPhGs脂质体组表达下降,差异有统计学意义(P<0.05),见图2。
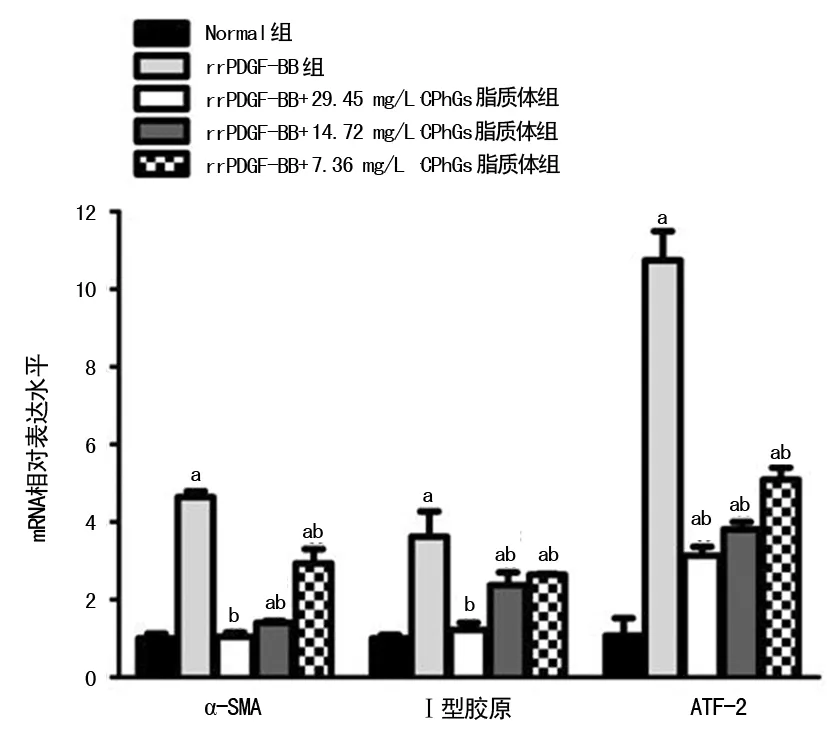
a:P<0.05,与Normal组比较,b:P<0.05,与rrPDGF-BB组比较
图2GPhGs脂质体对rrPDGF-BB诱导的HSCα-SMA、Ⅰ型胶原、ATF-2mRNA表达的影响
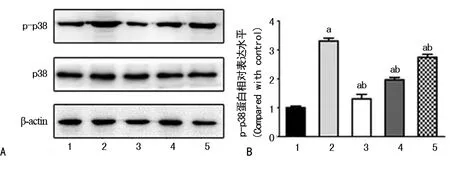
A:Western blot检测蛋白条带;B:Western blot条带灰度统计分析图;a:P<0.05,与Normal组比较,b:P<0.05,与rrPDGF-BB组比较;1:Normal组;2:rrPDGF-BB组;3:rrPDGF-BB+29.45 mg/L CPhGs脂质体组;4:rrPDGF-BB+14.72 mg/L CPhGs脂质体组;5:rrPDGF-BB+7.36 mg/L CPhGs脂质体组
图3GPhGs脂质体对rrPDGF-BB诱导的HSCp-p38蛋白表达的影响
2.5GPhGs脂质体对rrPDGF-BB诱导的HSC p-p38蛋白表达的影响 Western blot实验结果显示,与Normal组比较,p-p38蛋白在rrPDGF-BB组和不同浓度CPhGs脂质体组表达显著增加,差异有统计学意义(P<0.05);与rrPDGF-BB组比较,p-p38蛋白在不同浓度CPhGs脂质体组表达下降,差异有统计学意义(P<0.05),见图3。
3 讨 论
HF是世界范围内的健康问题,50%的肝癌患者死于HF[10]。尽管HF发病率高,但目前尚无有效的治疗方法。目前抗HF的治疗策略的主要目的是抑制HSC活化和增殖。血小板生长因子(PDGF)-BB存在于肝脏中,对HSC 的增殖有着较强的促进作用,能促进HSC 活化增殖及胶原分泌,是一个高度有效的HSC促有丝分裂原,PDGF与其受体PDGFR结合形成二聚体后,激活MAPK信号通路,诱导HSC持续活化;促进HSC迁移、增殖的同时抑制其凋亡[11]。PDGF信号中断,通过其受体阻断MAPK信号通路,HSC的增殖和胶原的分泌受到抑制。有学者在研究羟基红花黄色素A(HSYA)对HF的作用时发现,HSYA 对PDGF-BB诱导的HSC的增殖有明显的抑制作用[12]。
本研究用50 μg/L的rrPDGF-BB刺激HSC,所有实验分组在同一刺激因子作用下进行。MTT实验结果显示:CPhGs脂质体作用24 h抑制率为10.77%~32.45%,且抑制率与实验时间和药物浓度呈线性增加关系,48 h抑制率为26.50%~50.73%,72 h抑制率为20.75%~54.68%。从实验结果可以看出,实验时间的延长并没有使抑制率发生较大的改变,作者认为48 h是药物的最佳反应时间。研究结果表明,不同浓度的CPhGs脂质体均能抑制HSC的增殖。
任何病因的肝损伤最终都会导致HSC的活化、肌成纤维细胞分化转为HF。也就是说,肌成纤维细胞来自活化和增殖的HSC,且被视为是HF形成的中介[13]。而HSC的活化则是HF的主要过程[14]。活化的HSC通过积累产生ECM,分泌细胞因子,增强趋化能力进而促进肝上皮细胞的再生[15]。在慢性肝病中,HSC的反复激活导致肝纤维化,其特征是广泛的瘢痕形成和干扰肝脏正常结构与功能。最近的临床试验提示,HF在清除潜在病原体过程中是可逆的[16]。肝损伤后HSC经历一个复杂的从静止状态向肌成纤维细胞转换或激活过程,其中α-SMA在肌成纤维细胞分化中起作用。α-SMA降低了收缩力和Ⅰ型胶原合成并抑制伤口收缩。Ⅰ型胶原和α-SMA被认为是肝纤维化中诱导HSC活化的标志物。在四氯化碳(CCl4)所致的HF研究中发现,HSC活化过程中α-SMA 和Ⅰ型胶原表达上调[17]。而最近的研究表明,HSC的活化可以由几个促有丝分裂原推动,包括PDGF、胰岛素样生长因子-1(IGF-1)[18]和结缔组织生长因子(CTGF)[19]。在关于TRPM7通道调节PDGF-BB诱导的HSC增殖的研究数据表明,TRPM7可降低α-SMA和Ⅰ型胶原的表达,抑制HF[20]。ATF-2参与多条信号通路的传导,同时在肝组织表达的ATF-2的碱基在p38磷酸化后出现转录活性和DNA结合的增加。本研究探讨不同浓度CPhGs脂质体对rrPDGF-BB诱导的HSC增殖的影响。qRT-PCR扩增检测α-SMA、Ⅰ型胶原、ATF-2 mRNA结果提示,与Normal组相比,rrPDGF-BB组α-SMA、Ⅰ型胶原、ATF-2 mRNA表达明显增高;与rrPDGF-BB组相比,不同浓度的CPhGs脂质体均可不同程度下调α-SMA、Ⅰ型胶原、ATF-2 mRNA表达,其中29.45 mg/L CPhGs脂质体组下调作用最明显,α-SMA,Ⅰ型胶原mRNA与Normal组比较,差异无统计学差异,作者认为产生这种现象的原因在于浓度越高,其对rrPDGF-BB引起的HSC增殖的抑制效果越明显,越趋近于正常。作者认为CPhGs脂质体能有效抑制rrPDGF-BB刺激的HSC中Ⅰ型胶原和ATF-2 mRNA表达、下调α-SMA mRNA表达,进而减少ECM合成与分泌,阻止HF的形成。
此外,MAPK信号转导途径及其子系统p38通路参与HSC的活化,因而可能成为治疗HF的靶点。p38 MAPK是MAPK家族成员之一,p38是由各种刺激引起的许多细胞的传感器,且在调节棕色脂肪细胞、肌肉细胞和肝细胞的能量平衡过程中起着重要的作用,p38 MAPK也被认为在调节炎性因子方面扮演重要角色。因此,p38 MAPK激活可能在HSC损伤与炎症过程中发挥作用。研究证明PDGF-BB可通过MAPK信号通路诱导HSC细胞活化与增殖[21]。栀子苷可抑制p-p38蛋白的表达从而起到抑制HF的作用[22]。本研究结果显示,与Normal组比较,rrPDGF-BB组p-p38的蛋白表达水平明显增高,表明rrPDGF-BB可通过影响MAPK信号而使HSC活化增殖。不同浓度的CPhGs脂质体组,p-p38的蛋白表达水平随着药物浓度的升高逐渐降低,且将不同浓度的CPhGs脂质体组p-p38的蛋白表达水平与rrPDGF-BB组比较,差异均有统计学意义(P<0.05)。由此可见,CPhGs脂质体可在一定程度上抑制rrPDGF-BB诱导的HSC增殖与活化,从而抑制HF的形成。当前,对HF的了解较少,全新的方法及技术手段将会对HF进行深入研究,从而对干预、早期诊断和治疗HF提供全新的治疗策略。
