敲低蛋白酶激活受体2基因对缺氧/复氧损伤后H9c2心肌细胞氧化应激的影响▲
2019-05-22慕家盛王媛媛杨青男黄泽旭陈启稚
王 敏 张 珊 慕家盛 王媛媛 杨青男 黄泽旭 陈启稚
(上海交通大学医学院附属第九人民医院心内科,上海市 200011,电子邮箱:minnwang@163.com)
急性心肌梗死是全球致死率极高的疾病之一[1]。伴随着病变血管的开通,再灌注过程中产生的大量自由基、钙超载等造成的心肌缺血再灌注损伤 (ischemia/reperfusion injury,IRI) 越来越常见[2]。早在1960年,Jennings等[3]即指出缺血再灌注其实是一把双刃剑。冠状动脉再通对于挽救濒危心肌、改善患者症状和预后的益处毋庸置疑,但如何预防和治疗随之而来的再灌注损伤已成为临床迫切需要解决的难题。
蛋白酶激活受体2(protease-activated receptor 2,PAR2)是七次跨膜G蛋白偶联受体的重要成员,表达于心血管系统多种类型细胞(如心肌细胞、血管内皮细胞、平滑肌细胞、心肌成纤维细胞),与IRI引起的氧化应激密切相关[4-6]。研究表明,PAR2激活可以减轻IRI后心肌氧化应激损伤,减少心肌梗死面积,改善心肌功能失调,发挥心肌保护效应[5],但PAR2缺陷对IRI后心肌氧化应激的影响尚不明确。因此,本研究构建H9c2心肌细胞缺氧/复氧 (hypoxia/reoxygenation,H/R)模型,模拟在体心肌缺血再灌注,从氧化应激的角度探讨敲低PAR2基因对IRI后心肌的保护作用及机制。
1 材料与方法
1.1 细胞及主要试剂 大鼠心肌细胞株H9c2购自上海市中科院细胞库;针对大鼠心肌细胞株H9c2的PAR2小干扰RNA(small interfering RNA,siRNA)(正义链:5′-GCUGCUCGUCGUGCAUUAUTT-3′,反义链:5′-AUAAUGCACGACGAGCAGCTT-3′)及非特异性siRNA(正义链: 5′-UUCUCCGAACGUGUCACGUTT-3′,反义链:5′-ACGUGACACGUUCGGAGAATT-3′)由上海吉玛公司合成;杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)由HyClone公司生产(批号:SH30022.01),特级胎牛血清由Gibco公司生产(10100147C);磷酸缓冲盐溶液(phosphate-buffered saline,PBS)由Dycent Biotech公司生产(批号:7647-14-5),0.25%胰蛋白酶-乙二胺四乙酸(Trypsin-ethylenediaminetetraacetic acid,Trypsin-EDTA)由Gibco公司生产(批号:25200056);转染试剂脂质体3000由Life Technologies公司生产(批号:L3000015),乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛检测试剂盒由南京建成生物工程研究所提供(批号:A020-1、A001-3、A003-2);AMV反转录酶由Promega公司生产(批号:A3500),FastStart SYBR-Green/Rox试剂由Roche公司生产(批号:4913850001)。2′,7′-二氯荧光黄双乙酸盐(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针由碧云天生物技术公司生产(批号:S0033)。
1.2 主要仪器 Heraeus 150型CO2细胞培养箱由Thermo公司生产,ABI-7500 Fast型实时荧光定量PCR仪由Applied Biosystems公司生产,MIC-101型缺氧培养小室由Billups-Rothenberg公司生产,Synergy H1全功能酶标仪由BioTek公司生产,CytoFLEX S流式细胞仪由Beckman Coulter生产。
1.3 实验方法
1.3.1 细胞培养:将H9c2心肌细胞用含100 mL/L胎牛血清的DMEM培养基,置于5% CO2、37℃细胞培养箱中无菌培养。细胞达90%汇合率时进行传代。
1.3.2 PAR2 siRNA转染H9c2心肌细胞[7]:(1)细胞分组,将对数生长期的H9c2细胞以每孔3×104个细胞接种于6孔板,每孔加入不含抗生素的培养基,置于37℃、5% CO2培养箱中培养12~16 h,细胞密度达到30%~50%时将细胞分为非特异性干扰组(NS组)和特异性干扰组(SI组)。(2)转染,先将125 μL无血清培养基分别与脂质体3 000(7.5 μL)和相应的siRNA(5 μL) 各自混匀,再将两种混合物混匀为脂质体3000-非特异性siRNA和脂质体3000-特异性siRNA复合物,将上述两种复合物分别加入NS组和SI组细胞,再加入无血清培养基使每组的siRNA终浓度为50 nmol/L,置于37℃、5% CO2培养箱中培养,6 h后更换为含10%胎牛血清的培养基。转染24 h后重复上述传染步骤再次向细胞转染siRNA。(3)第2次转染完成后48 h收集细胞用于后续实验。
1.3.3 实时定量PCR检测PAR2 mRNA表达情况:收集转染48 h后的细胞,采用TRIzol提取法抽提细胞的RNA,取纯化的总RNA 2 μg,应用AMV反转录酶进行反转录获得cDNA。采用实时定量 PCR检测靶基因表达,实验步骤根据FastStart SYBR-Green/Rox试剂盒说明书进行。反应体系:SYBR Green Ⅰ MasterMix 10×3 μL,100 μmol/L的上下游引物各0.6×3 μL,dd H2O 6.8×3 μL,cDNA 2×3 μL。将其混匀后以3复孔模式加入96孔PCR板。反应条件:预变性95℃ 10 s;变性60℃ 30 s,退火延伸72℃ 30 s,40个循环。以标本自身的甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参。基因的引物序列见表1,引物由上海生工生物工程有限公司合成。运用7500 Software v2.0.5软件输出数据。采用2-△△Ct分析法,计算SI组PAR2 mRNA的相对表达水平。实验重复3次。

表1 引物序列
1.3.4 H9c2心肌细胞H/R实验:siRNA转染H9c2细胞48 h后,更换无糖无血清培养基,将培养的H9c2细胞置于缺氧培养小室,通入体积分数950 mL/L的氮气+体积分数50 mL/L CO2混合气体15 min,然后将缺氧培养小室置于37℃细胞培养箱处理4 h后,取出缺氧处理的H9c2细胞,再更换含100 mL/L胎牛血清的DMEM培养基,置于37℃细胞培养箱(95% O2+5% CO2)处理4 h[8]。
1.3.5 检测LDH水平:H/R处理后,室温下1 000 r/min离心5 min收集各组细胞培养上清液,按照LDH检测试剂盒说明书进行操作,于酶标仪440 nm处测量各管吸光度,检测各组细胞培养液中LDH吸光度值,细胞培养液LDH活性(U/L)=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度×1 000。
1.3.6 DCFH-DA荧光探针检测H9c2心肌细胞活性氧含量:H/R处理后,收集两组细胞,去除细胞培养液,用PBS洗涤细胞1次,每个孔分别加入2 μmol/L的DCFH-DA 1 mL,37℃细胞培养箱内孵育20 min。用事先预冷的PBS洗涤细胞两次,以充分去除未进入细胞内的DCFH-DA,收集细胞置于冰上,立即流式细胞仪上机检测心肌细胞活性氧(reactive oxygen species,ROS)含量。
1.3.7 测定H9c2心肌细胞内SOD、丙二醛水平:H/R处理后,收集两组H9c2心肌细胞,去除细胞培养液,PBS洗涤细胞两次,超声破碎制备成10%匀浆,按照SOD、丙二醛检测试剂盒说明,采用黄嘌呤氧化酶法测定SOD活力、硫代巴比妥酸显色法测定丙二醛含量。
1.4 统计学分析 应用SPSS 21.0软件进行统计分析。计量资料以(x±s)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 H9c2心肌细胞PAR2敲除效率 CY3红色荧光标记的非特异性siRNA转染NS组H9c2心肌细胞后,转染成功的细胞内可见红色荧光(见图1)。转染48 h后,NS组、SI组H9c2心肌细胞的PAR2 mRNA相对表达水平分别为0.99±0.10、0.28±0.02(t=12.383,P<0.001)。SI组H9c2心肌细胞的PAR2 mRNA下降至NS组的30%以下,证实有效敲除PAR2基因。
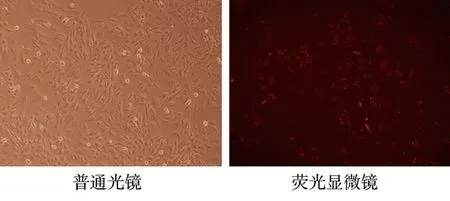
图1 H9c2心肌细胞转染效果(×100)
2.2 H/R后两组观察指标比较 SI组的LDH含量、ROS相对荧光强度、丙二醛含量均低于NS组(均P<0.05),SOD活力高于NS组(P<0.05)。见表2。

表2 两组观察指标比较(x±s)
3 讨 论
研究表明,心肌IRI的发生发展机制十分复杂,包括氧化应激、炎症反应、细胞凋亡、心肌纤维能量代谢障碍、血管内皮细胞功能障碍及钙超载等因素[9-10]。心肌IRI和H/R过程中可产生大量ROS,导致心肌细胞膜脂质过氧化,破坏心肌细胞结构[11]。作为氧化应激通路中的重要分子,PAR2的激活可引起剂量依赖性的ROS产生增加,可以促进氧化应激的发生发展[12]。PAR2的激活也可引起包括内皮细胞和心肌细胞在内的多种类型细胞发生丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)磷酸化[13-14]。另外,有研究表明H9c2心肌细胞H/R过程中释放的ROS能够触发MAPK信号通路,提高细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)1/2、p38和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)磷酸化水平[15]。Antoniak等[16]研究发现PAR2缺陷小鼠IRI后心肌组织ERK1/2、p38和JNK磷酸化减少。因此,我们推测PAR2敲低对H9c2心肌细胞的保护作用机制可能与MAPK通路依赖的抗氧化应激作用相关。
大多数研究结果显示外源性PAR2激动剂可保护心肌免受IRI。其中,Napoli等[5]在小鼠活体心肌IRI模型中首次发现外源性选择性激动剂活化PAR2后可剂量依赖性减少IRI心肌中ROS的产生,提高相关抗氧化剂的活性,减轻缺血心肌的过氧化损伤,在IRI心肌中发挥保护作用。Antoniak等[16]在活体小鼠心肌IRI模型中研究发现PAR2缺陷可以减轻IRI心肌的炎症反应、心肌梗死和心肌重塑,然而,PAR2缺陷对心肌氧化应激的影响尚未完全明确。从胚胎大鼠心肌获取的H9c2细胞系和原代乳鼠心肌细胞非常相似,可传代,易培养,实验稳定,常用于心血管领域基础方面的研究[17]。因此,我们以H9c2心肌细胞构建体外H/R模型模拟在体心肌缺血再灌注,在细胞水平进一步探索PAR2敲低对H/R损伤后心肌细胞氧化应激的影响。
LDH释放是心肌细胞损伤的重要指标。心肌细胞膜受损后,LDH即被释放到细胞外,通过检测细胞培养上清液中LDH水平,可判断心肌细胞的损伤程度;SOD能清除超氧阴离子自由基,保护细胞,间接反映机体清除自由基的能力;丙二醛为脂质过氧化产物,间接反映机体受自由基攻击的程度。本研究结果显示,H/R后,与NS组比较,SI组H9c2心肌细胞的ROS相对荧光强度、丙二醛及LDH含量降低,SOD活力升高(均P<0.05),表明PAR2敲低可减轻心肌细胞 H/R过程中氧化应激损伤,但这与Napoli等[5]的研究结果恰恰相反。
在野生型小鼠中,为何PAR2激活和敲除都能改善心肌IRI,对于PAR2作用的矛盾结果,我们推测可能有以下原因:(1)细胞作用特异性。在小鼠心肌IRI模型中,PAR2对心肌组织不同细胞具有不同作用,因此外源性PAR2激动剂可能通过活化血管内皮细胞表达的PAR2,扩张冠状动脉血管而发挥保护作用,但无法作用于炎症细胞和心肌细胞表达的PAR2;而PAR2敲除导致机体细胞均缺乏PAR2,可能通过抑制全身的炎症反应、氧化应激过程减轻心肌IRI。(2)外源性PAR2激动剂的心肌保护作用可能与偏置信号转导相关,Hollenberg等[18]发现合成的外源性配体和胰蛋白酶裂解的自身配体可结合PAR2的不同结构位点,能够激活不同信号通路,导致不同细胞效应。(3)外源性PAR2激动剂引起β抑制蛋白激活[19],研究表明β抑制蛋白可阻止核转录因子κB的激活和靶向基因的转录,减轻心肌组织局部炎症反应[20]。此外,β抑制蛋白能够反激活表皮生长因子受体而发挥保护心肌作用[21],而PAR2整体缺陷细胞无法作用于β抑制蛋白。
综上所述,在H/R中敲低PAR2基因可通过减轻氧化应激损伤从而保护H9c2心肌细胞,这可为PAR2在心肌IRI的防治作用提供了参考依据。鉴于PAR2在心肌IRI中的研究尚存在缺陷,有必要进一步明确PAR2在心肌IRI中的确切作用,分析其具体信号转导路径和分子机制。整体敲低人类心肌细胞PAR2是不现实的,因此研制选择性和特异的PAR2拮抗剂或PAR2阻断抗体仍可能是缓解心肌IRI的治疗目标。
