结合线粒体D-loop序列和SSR标记对宝石鲈养殖群体遗传多样性的分析
2019-05-21赵立祥董浚键孙成飞田园园卢迈新
赵立祥,董浚键,孙成飞,田园园,胡 婕,卢迈新,叶 星
(1.农业部热带亚热带水产资源利用与养殖重点实验室,中国水产科学研究院珠江水产研究所,广州 510381;2.上海海洋大学,上海 201306)
宝石鲈(Scortumbarcoo)学名高体革鯻,隶属于鲈形目(Perciformes)鲈亚目(Percoidei)鯻科(Teraponidae)革鯻属(Scortum),自然分布于澳洲河流,是澳大利亚重要的游钓鱼类。上世纪90年代中国山东、广东等地陆续宝石鲈,因其肉质细腻、无肌间刺且生长速度较快等而深受消费者喜爱,现正成为中国淡水工业化养殖与池塘养殖的品种[1]。由于近年来养殖宝石鲈出现生长速度下降与病害频发的问题,严重影响宝石鲈的养殖效益,也危及产品的质量安全。目前,关于宝石鲈的研究主要集中在营养成分分析、养殖技术、杂交育种和病原病害等领域,针对宝石鲈种质遗传变异未有相关的研究报道。因此,有必要开展宝石鲈养殖种群种质情况调查,了解其遗传多样性及遗传结构,综合采用线粒体D-loop序列及SSR标记分析对4个广东地方养殖种群的遗传多样性及种群间的分化进行分析,以期为宝石鲈的改良育种与苗种培育工作提供理论依据。
遗传多样性是生物多样性的重要组成部分,广义上它是指地球上所有生物携带的遗传信息的总和,表现为多层次、多水平,遗传多样性不仅包括变异水平的高低,也包括变异的分布格局,即种群的遗传结构[2]。一个物种的遗传多样性高低与其适应能力、生存能力和进化潜力密切相关。丰富的遗传多样性意味着较高的适应生存潜力,蕴藏着较大的进化潜能以及育种和遗传改良潜力;而贫乏的遗传多样性则会给物种生存进化以及种质资源的保护和利用带来许多不利影响。随机扩增多态性(PARD)、简单重复序列(simple sequence repeats, SSR)、简单重复序列区间(ISSR)等标记方法以及某些线粒体基因(CO I、16SrRNA、Cytb)等常用于生物种群遗传多样性分析,也被应用于水产鱼或虾类野生或养殖群体的分析上[3~6],但关于宝石鲈遗传多样性的研究尚未见报道。
微卫星标记,又称短串联重复序列(short tandem repeats, STRs)或简单重复序列(SSR),因其在基因组中分布广泛,具较高的多态性、呈共显性遗传,且由于其分析方法相对简便快捷也被广泛应用于水产生物种群遗传多样性分析、种质资源保护等领域[7]。微卫星标记分析通常是通过PCR扩增、电泳检测和片段大小分离分析各等位基因。传统的片段分离采用聚丙烯酰胺凝胶电泳的方法,其分辨率和效率均较低。近年发展起来的SSR分型新方法, 通过荧光标记的PCR引物扩增微卫星位点区域序列, 对扩增产物进行毛细管电泳检测,结合分子量内标计算DNA片段长度,使SSR分型更高效与准确[8]。
线粒体DNA(mtDNA)具有结构简单、进化速率快、母系遗传等特点,其中一些基因D-loop、COI、Cytb等已被作为鱼类遗传多样性和保护生物学研究的重要标记[9~13]。DNA条形码(DNA barcoding)技术常被用于水产动物分子鉴定研究[14]。线粒体控制区 D-loop区为非编码区,缺乏编码的选择压力,比其它线粒体基因进化速率更快,在群体遗传变异及系统进化等研究有较多应用[15]。
本研究采用线粒体D-loop序列和SSR分析方法,对广东4个宝石鲈养殖群体进行遗传多样性分析,并比较二者的分析结果,旨在更准确地了解广东地区宝石鲈养殖群体的遗传多样性及种质资源状况,为其选育种工作提供基础依据。
1 材料和方法
1.1 实验材料
实验样品分别采自广东省广州市(番禺区)、中山市和佛山市3个不同地区,其中广州番禺群体(PY)24尾,中山群体(ZS)24尾,佛山群体1(FS1)24尾,佛山群体2(FS2)24尾,共计96尾。广东广州(番禺区)、中山和佛山宝石鲈养殖群体分别由广州市番禺区农业科学研究所、中山一力农业发展有限公司和佛山市南海区西樵显恒水产农业有限公司惠赠。
1.2 基因组DNA的提取与检测
剪取宝石鲈新鲜个体的鳍条,无水乙醇-20 ℃保存。采用广州美基生物科技有限公司的HiPureMollusc DNA Mini Kit软体动物总DNA提取试剂盒,根据其说明书提取宝石鲈鳍条组织的总DNA,并用1%的琼脂糖凝胶电泳检测DNA的完整性,多功能酶标仪(BioTek)检测DNA的浓度和纯度,样品-20 ℃保存备用。
1.3 线粒体序列片段的选择及D-loop序列片段的扩增及测序
根据GenBank中登录的宝石鲈线粒体基因组序列(KP317810.1)[16],设计用于扩增线粒体D-loop片段的引物(表1),扩增长度分别为598 bp;先在8个随机样本中进行扩增,PCR反应体系为20 μL:TaKaRa Premix rTaq 10 μL、上下游引物(10 μmol/L)各1 μL,模板DNA 1 μL,ddH2O 7 μL。PCR反应程序为:94 ℃预变性5 min;之后进入30个循环:94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min;最后一个循环结束后72 ℃再延伸10 min后4 ℃保存。PCR产物送广州艾基生物科技有限公司进行测序,结果发现在D-loop序列中一共检测出8个多态性位点。
1.4 微卫星引物的筛选、扩增及基因分型
根据本实验室前期获得的宝石鲈肌肉组织的转录组数据,选取40个微卫星位点,设计并合成SSR引物,对8个随机样本进行PCR扩增。PCR反应体系20 μL:TaKaRa Premix rTaq 10 μL、上下游引物(10 μmol/L)各1 μL,模板DNA 1 μL,ddH2O 7 μL。PCR反应程序为:94 ℃预变性5 min;之后进入30个循环:94 ℃变性30 s,退火30 s(退火温度根据引物复性温度设定),72 ℃延伸1 min;最后一个循环结束后72 ℃再延伸10 min后4 ℃保存。琼脂糖凝胶电泳检测产物的特异性,并送广州艾基生物科技有限公司进行测序。采用Qsep100全自动核酸蛋白分析系统检测微卫星位点多态性,从中筛选出11个特异性和多态性较好的微卫星位点,由艾基生物有限公司合成荧光引物,用于本研究4个群体的扩增(表1)。

表1 用于宝石鲈微卫星序列及D-loop扩增的引物序列及其退火温度
SSR PCR产物分型委托艾基生物有限公司完成。11对微卫星引物分成3组分别合成3种不同荧光标记(表1)的引物,荧光标记的微卫星引物分别扩增微卫星位点区域序列,3种不同荧光PCR产物混合成一管样品进行检测。采用3730XL测序分析仪(ABI)对样品的荧光PCR产物进行毛细管电泳检测,结合分子内标进行DNA片段长度计算,根据每个扩增条带分子量的差异性, 判断每个个体各基因座的基因型。
1.5 数据分析
使用Cluatal X软件比对D-loop序列测序结果,并辅以人工校对。利用MEGA 6软件统计序列的碱基含量,利用邻接法基于K2P模型构建宝石鲈4个养殖群体的单倍型系统发生树,进化树各分支的自举置信度水平由自举法(bootstrap value)估计,自引导次数为1 000。通过DnaSP软件统计单倍型(h),计算单倍型多样性(Hd)、核苷酸多样性遗传多样性(Pi)等参数。
SSR分析中获得微卫星位点上等位基因的条带大小后,将所得结果进行归类。使用POPGENE Version 1.31 进行统计分析,计算各群体每个微卫星位点的等位基因数(Na)、有效等位基因数(Ne)、Shannon 指数(I)、观测杂合度(Ho)、期望杂合度(He)、遗传距离和基因流(Nm)。根据Nei's遗传距离以及非加权配对算术平均法(unweighted pair group method with arithmetic mean, UPGMA),利用 MEGA 6软件分别构建群体间和个体间的系统进化树。CERVUS3.0软件计算多态信息含量(polymorphism information content,PIC)。ARLEQUIN 3.5软件计算遗传分化指数(FST)并进行群体分子方差分析(AMOVA)。群体遗传结构采用STRUCTURE2.3 进行分析。
2 结果
2.1 宝石鲈mtDNA D-loop序列、群体遗传多样性与群体遗传分化分析
对宝石鲈4个群体共96个样本的mtDNA D-loop基因片段进行了扩增与测序,通过比对和人工校对,选择了598 bp的序列用于进一步的分析。共获得变异位点14个,含有3个简约信息位点,1个碱基位点缺失,1个碱基位点插入。变异位点数占分析位点的2.34%。4种碱基在此段序列中的平均含量为A(30.4%)、T(31.8%)、C(20.1%)、G(17.7%),其中A+T含量为62.2%,明显高于C+G含量。
从96个样本中共定义8个单倍型(Hap),其中单倍型Hap1为ZS和FS1、FS2 3个群体的共享单倍型,Hap3为PY和FS1、FS2 3个群体的共享单倍型,其它6个单倍型(Hap2, Hap4-8)为各群体特有(表2)。其中FS1群体拥有的单倍型最多,为6个;PY群体次之,为3个;FS2群体较少,为2个;ZS群体拥有单倍型最少为1个。Hap1和Hap3为优势单倍型,分别占个体总数的60.4%、32.3%。

表2 宝石鲈4个养殖群体中D-loop序列单倍型的分布
使用Dna SP(version 5.0)软件计算宝石鲈4个养殖群体的2个遗传多样性参数:单倍型多样度(Hd)和核苷酸多样度(Pi)。4个群体的Hd为0.000 0~0.543 5,以FS1群体为最高、ZS群体最低;Pi为0.000 00~0.001 76,其中FS1群体的Pi值最高(0.001 76),而ZS群体不存在Pi(0.000 00)(表3)。表明4个养殖群体的遗传多样性均极低。

表3 宝石鲈4个群体线粒体D-loop序列的遗传多样性参数
2.2 宝石鲈SSR遗传多样性分析
根据转录组数据设计筛选到11对微卫星引物对,在4个宝石鲈群体中有较好的多样性(表4),进一步用这11对微卫星引物对4个宝石鲈群体共96个个体进行扩增与分型。结果显示,11个微卫星位点在96个样本中的PIC为0.233~0.609,平均PIC为0.391(表5)。各位点的基因流Nm为2.678~98.617(>1),平均Nm为7.483。
表4 宝石鲈11个微卫星位点在4个群体中的预扩增情况
Tab.4 Characterization of 11 microsatellite loci for 4 populations ofS.barcoo
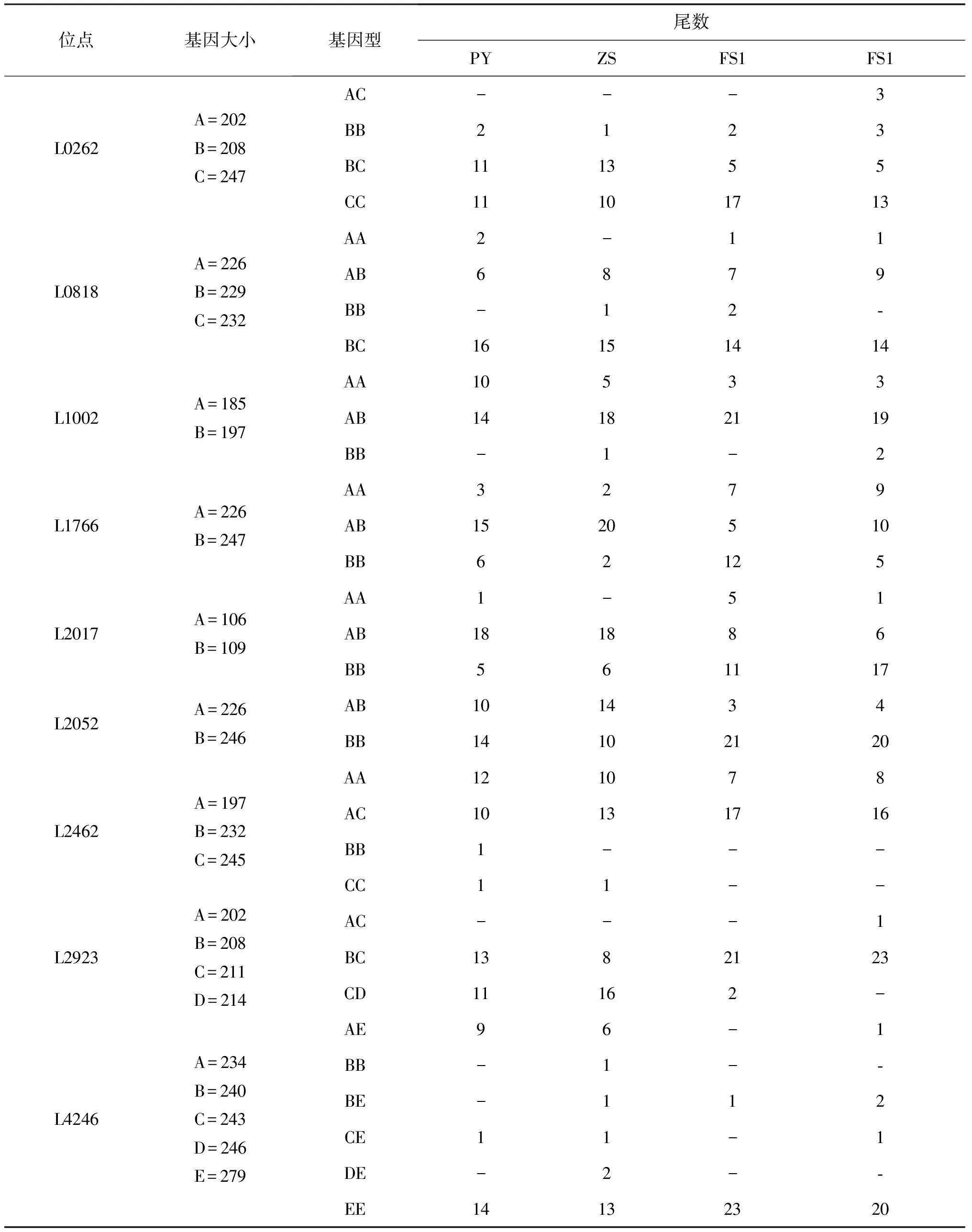
位点基因大小基因型尾数PYZSFS1FS1L0262A=202B=208C=247AC---3BB2123BC111355CC11101713L0818A=226B=229C=232AA2-11AB6879BB-12-BC16151414L1002A=185B=197AA10533AB14182119BB-1-2L1766A=226B=247AA3279AB1520510BB62125L2017A=106B=109AA1-51AB181886BB561117L2052A=226B=246AB101434BB14102120L2462A=197B=232C=245AA121078AC10131716BB1---CC11--L2923A=202B=208C=211D=214AC---1BC1382123CD11162-L4246A=234B=240C=243D=246E=279AE96-1BB-1--BE-112CE11-1DE-2--EE14132320

续表

表5 宝石鲈96个样品中11个微卫星位点的多样性参数
PY、ZS、FS1和FS2 4个群体的平均He为0.491、0.516、0.396、0.424,平均PIC为0.405、0.420、0.320、0.347,显示4个群体的遗传多样性均较低。ZS群体的遗传多样参数略高于其它三个群体,但4个群体之间的He和PIC不存在显著性差异(表6)。
下表(表7)是4个宝石鲈群体根据线粒体D-loop序列和SSR位点的AMOVA分析结果,基于线粒体D-loop序列分析 4个群体间遗传分化系数FST=0.403 5,显示群体间具有较高程度的遗传分化,而SSR的分析结果显示FST极低,仅为0.044 5,二者差异较大。而对于遗传变异来源的分析二者的结果则相近。基于线粒体D-loop序列分析,遗传变异有40.34%来自于群体间,59.66%来自于群体内;根据11个SSR位点的分析遗传变异来源,39.28%来自于群体间,60.72%来自群体内。

表6 4个宝石鲈群体11个位点的平均遗传多样性参数
注:同列数据上标相同字母表示不存在显著性差异

表7 4个宝石鲈群体根据线粒体D-loop序列和SSR位点的AMOVA分析结果
4个群体两两间的Nei’s遗传相似度和遗传距离如表8所示,其中遗传相似度为0.953 7~0.987 6,遗传距离为0.012 5~0.047 4。根据遗传距离构建的UPGMA系统进化树,4个养殖群体分聚成了2类,PY群体和ZS群体聚为一支,FS1、FS2两个群体聚为另一支(图1)。根据96尾宝石鲈个体间的遗传距离构建的UPGMA进化树(图2)显示4个群体呈镶嵌式排列,未出现明显的群体分支。

表8 4个宝石鲈群体的遗传相似度和遗传距离
注:对角线以上为遗传相似度,对角线以下为遗传距离

图1 基于Nei’s遗传距离构建的4个宝石鲈群体的UPGMA聚类树

图2 基于Nei’s遗传距离构建的96个宝石鲈个体的UPGMA聚类树
运用STRUCTURE软件分析4个群体的遗传结构,结果显示对数似然函数值L(K)随亚群数K的增加而增加,当K=2时L(K)值开始趋于稳定,开始出现平台期,说明这4个群体可分为2个亚群(图3)。其中PY、ZS、FS1、FS2 4个群体中分别有62.5%、75%、8.3%和20.8%为亚群I,37.5%、25%、91.7%和69.2%为亚群Ⅱ(图4),也即PY与ZS群体大部分个体为亚群I,而FS1与FS2群体大多属于亚群Ⅱ。

图3 L(K)值随K的变化

图4 参试4个宝石鲈群体在K=2时的遗传结构图
3 讨论
3.1 基于线粒体D-loop序列的宝石鲈群体遗传多样性
本研究利用线粒体D-loop 序列片段(598 bp),分析4个宝石鲈养殖群体共96个样本,共检测出14个多态性位点,定义了8个单倍型,并计算了核苷酸多样性指数Pi和线粒体DNA的单倍型多样性指数Hd。这二个参数是衡量群体DNA多态程度的重要指标[17]。从单倍型多样度(Hd=0.000 0~0.543 5,平均0.535)和核苷酸多样性(Pi=0.000 00~0.001 76,平均0.001 39)的数值来看,本研究所分析的宝石鲈4个养殖群体的多样性均较低。王沈同等[18]利用线粒体控制区片段(894 bp)对草鱼野生及选育群体进行遗传变异分析,6个群体共276个样本检测出27种单倍型,野生群体和选育群体的单倍型多样度及核苷酸多样性分别为Hd=0.585 5、Pi=0.001 42,而选育群体的分别为Hd=0.429、Pi=0.000 92,说明野生群体的遗传多样性远比选育群体更丰富。董新培等[19]利用906 bp的线粒体D-loop区片段对不同地理区域的104个乌鳢样本进行遗传多样性分析,结果显示在104条序列中出现37个多态性位点,共定义27种单倍型。乌鳢遗传群体的多样性参数分别为Hd=0.875、Pi=0.003 72,说明乌鳢群体的遗传多样性较为丰富。本研究中宝石鲈的4个养殖群体的多样性均低于上述草鱼与乌鳢研究中的野生群体,但高于王沈同等的研究中草鱼选育群体的对应参数(Hd=0.429、Pi=0.000 915)。
遗传分化指数FST多用于分析不同群体间的遗传差异,FST为0~0.05,表明群体间分化比较小;若FST为0.05~0.15,则群体间存在中等程度分化水平;若FST>0.15,群体间存在较高的分化水平[17]。本研究根据线粒体D-loop序列分析的4个宝石鲈养殖群体的遗传分化指数为FST=0.403 5,处于较高的分化水平。王沈同等[18]的研究(FST=0.403 12)中的草鱼群体以及董新培等[19]的研究(FST=0.319 14)中乌鳢群体的结果相差不大,三者的分化水平相当。
通过mtDNA D-loop序列对宝石鲈4个养殖群体的分析,显示4个养殖群体遗传多样性均较低,遗传分化指数FST=0.403 5显示群体间遗传分化处于较高水平。4个养殖群体的遗传分化主要来自群体内部(59.66%)。
3.2 基于微卫星位点的宝石鲈群体遗传多样性
在利用SSR进行种群遗传多样性的评估中,常用群体PIC和杂合度(H)两个指标。PIC能反映出某个群体的遗传变异程度和位点多样性[20],PIC>0.5的位点为高多态性位点,0.25
Nm是指一些个体从一个群体迁移至另一个群体过程中将某些基因带入新群体,它对新群体的变异产生影响。不同群体间的基因流越大,遗传相似性越高。当Nm>1 时,可认为群体之间的基因流较大,遗传相似性较高[23]。本研究中的4个群体各位点的基因流均较高(Nm>1),因此说明4个群体遗传相似性高。个体间遗传进化树(图2)则反映出这些个体未因群体差异或来源而呈现出明显的分群,从另一角度说明这4个群体间遗传相似度较高。STRUCTURE 软件是根据Pritchard等的方法开发而成[24],它根据多位点基因型数据来划分群体的结构组成,将每个个体分配到不同亚群中,可分析群体间的混合区以及群体间的迁移等。K值反映了群体的亚群数,在ΔK最大时,其对应的K值为适宜的亚群数[25]。本研究中通过STRUCTURE软件分析,各群体中的个体均被分成2个亚群,但其中番禺群体和中山群体中有更多个体属于亚群Ⅰ,佛山的2个群体则更多个体属于亚群Ⅱ,提示中山群体与番禺群体、佛山群体1与群体2的遗传关系较近,这与群体间遗传进化树(图1)分析结果一致。
基于11个微卫星位点的分析,4个养殖群体的遗传多样性水平偏低,其中中山群体的遗传多样性水平较高,遗传分化指数FST=0.044 5显示群体间遗传分化处于较低水平。遗传变异来源与D-loop的分析结果相似,主要为群体内部(60.72%)。
3.3 综合两种分析方法分析4个群体的遗传多样性
本研究通过线粒体D-loop序列和SSR分析,均显示4个宝石鲈养殖群体的遗传多样性水平较低。根据SSR分析结果,中山群体在4个群体中多样性相对较高,其期望杂合度(He=0.516)属于中等水平。但根据D-loop序列分析结果来看中山群体的线粒体D-loop序列不存在多态性位点,全部个体属于同一单倍型。这可能与线粒体DNA的遗传特殊性有关。线粒体为母系遗传,遗传过程不经过基因重组[9],因此对于亲缘关系较近的分析样本而言,用其分析种群遗传多样性具有局限性。本研究的预实验还发现宝石鲈线粒体Cytb、COI和12S rRNA上的多态性位点更少,不适合用于对现有宝石鲈养殖群体的遗传多样性评估。
两种分析方法的结果均显示4个群体的遗传分化大部分来自于群体内。但两种方法所得的群体遗传分化指数FST差异较大,根据线粒体D-loop序列获得的FST较大,(FST=0.403 5 >0.15),说明群体间的遗传分化处于较高水平,而根据微卫星位点的分析结果(FST=0.044 5),群体间遗传分化偏低。两者在群体遗传分化指数上的不同可能是由于两者遵循不同的遗传模式而导致变异速率存在差异[26]。如果种群间的基因流是由雄性个体造成的,那么就只有用核基因标记才能检测,因此微卫星标记在研究种群遗传分化时可以获得更为完善的信息[27]。宝石鲈引进时间较长、批次较少,而性成熟时间较长(雌鱼3年性成熟,雄鱼成熟时间则更长为5年),这就导致在繁殖过程中一尾雄鱼可能与多尾雌鱼配对,导致雄性产生的基因流大于雌性,所以对于本研究而言,使用SSR分析群体的遗传分化应更为准确。
本研究使用SSR和线粒体D-loop序列分析宝石鲈4个养殖群体的遗传多样性,结果显示4个群体的遗传多样性较低、群体间遗传分化水平较低、遗传距离很小,亲缘关系较近,说明这4个养殖群体进一步选育的潜力不足,因此有必要通过引进原种以丰富国内宝石鲈养殖群体的遗传多样性。本研究结果可为下一步宝石鲈种质改良与品种选育提供依据。
