一株用于石油污染修复的产漆酶菌种产酶条件优化及性能评价
2019-05-21宋佳宇李兴春于文赫吴百春
宋佳宇,李兴春,于文赫,吴百春
(1.石油石化污染物控制与处理国家重点实验室,北京 102206;2.中国石油集团安全环保技术研究院有限公司,北京 102206)
1 引言
随着石油石化行业的发展,土壤石油污染问题日益突出,石油污染物因具有结构稳定、不易降解、“三致”等[1]特点已成为影响土壤安全利用的重要因素之一。酶是具有生物催化活性的一类物质,石油降解酶类对土壤中有机物具有活化或抑制分解等作用[2]。近年来,酶修复技术已在石油污染修复领域得到广泛关注[3]。
漆酶(Laccase,EC 1.10.3.2),又名酚酶、多酚氧化酶、漆酚氧化酶等,是一类含铜的糖蛋白氧化酶[4,5],对酚及其衍生物[6]、芳胺及其衍生物[7]等污染物具有较强的催化效果。因其具有底物选择性广泛和稳定性好的优势,漆酶在环境污染修复领域[8,9]应用前景广阔。然而,漆酶大多属于胞内酶,提取效率极低,纯化成本较高,严重制约了其在实际污染治理中的应用[10~12]。
据此,本研究选取可胞外产漆酶的血红密孔菌Pycnoporus coccineus(PC)为产漆酶菌种,通过优化产漆酶培养基条件及培养环境条件,获取漆酶最佳液体发酵工艺参数,制备出高效石油降解粗酶制剂并开展原油降解效果评价,为漆酶制剂的工业化生产和现场应用提供技术参数。
2 材料与方法
2.1 试验材料
2.1.1 产漆酶菌种
本研究所用的产漆酶菌种为血红密孔菌(Pycnoporus coccineus,PC),取自日本某菌种保藏中心。
2.1.2 石油降解菌群
本研究所用石油降解菌群为本实验室保存的高效石油烃降解复配菌群[13],由铜绿假单胞菌(Pseudomonas aeruginosa,GenBank登录号:Z76651)、弯曲芽孢杆菌(Bacillus flexus,GenBank登录号:AB021185)和蜡样芽胞杆菌(Bacillus cereus,GenBank登录号:AE016877)按1∶1∶1(V∶V∶V)比例复配而成。该复配菌群10 d内对实验用原油(约10000 mg/L)的总石油烃(Total Petroleum Hydrocarbons,TPHs)降解率达58.24%。
2.1.3 培养基配方
基础产酶培养基:葡萄糖 20.00 g,硫酸铵 2.64 g,苯甲基丙氨酸 0.15 g,腺嘌呤 0.028 g,硫胺素50.00 μg,KH2PO41.00 g,Na2HPO4·2H2O 0.10 g,CaCl20.01 g,MgSO4·7H2O 0.50 g,FeSO4·7H2O 0.01 g,ZnSO4·7H2O 0.0010 g,MnSO4·4H2O 0.0010 g,CuSO4·5H2O 0.0020 g,蒸馏水1000 mL。
马铃薯葡萄糖琼脂培养基[14](PDA 固体培养基):马铃薯200.00 g切成小块,加蒸馏水煮沸,冷却后用四层纱布过滤,将滤液装入1000 mL容量瓶。随后加入琼脂17.00 g,葡萄糖20.00 g,加热搅拌混匀,稍冷却后用蒸馏水定容至1000 mL。
Luria-Bertani培养基(LB培养基):蛋白胨10.00 g,酵母提取物5.00 g,NaCl 10.00 g,琼脂2.00 g,蒸馏水1000mL,调整pH值6.5~7.5。
微量元素液:MgSO425.00 g、CuSO41.00 g、MnSO41.00 g、FeSO4·7H2O 1.00 g、蒸馏水500mL。
无机盐培养基:NH4Cl 2.00 g、NaNO31.00 g、KH2PO41.00 g、K2HPO42.50 g、NaCl10.00 g、微量元素液5 mL、2%CaCl2溶液0.5 mL、蒸馏水1000 mL。
含油培养基:移取1.00 g原油至已灭菌的150 mL锥形瓶,加入50 mL无机盐培养基即得。
以上培养基/液使用前均需经121 ℃高压灭菌30 min后方可使用。
2.1.4 原油
本研究所用原油取自某油田,其动力粘度为282.7 mPa·s,相对密度为0.971 g/cm3。原油中饱和烃、芳香烃、沥青质、胶质的质量分数分别为:16.22%、55.21%、4.24%和15.77%。
2.2 试验方法
2.2.1 产漆酶菌种活化
挑取少量冷冻保藏的PC菌菌丝接种于 PDA 固体培养基上,25 ℃恒温培养2 d后,挑出长势较好的菌体转接到50 mL基础产酶培养基中,在30 ℃、200 r/min条件下培养2 d,即为产漆酶菌种母液[15]。
2.2.2 粗酶液的制备
取一定量产漆酶菌种母液在4 ℃,8000 r/min条件下离心10 min,取上清液。将上清液透析除盐后,即得到粗酶液。
2.2.3 漆酶酶活测定
漆酶可以催化2,2’-连氮-二-(3-乙基苯并噻唑-6-磺酸)(ABTS)发生氧化反应[16,17],生成的氧化型ABTS在420 nm处产生强吸收峰。据此,本研究以漆酶对ABTS的氧化速度作为漆酶酶活的评价指标。具体步骤[18]如下:在30 ℃水浴条件下,将缓冲液(1.9 mL 0.1 mol/L HAc/NaAc (pH=4))和粗酶液加入试管中,加入1 mL ABTS,使其工作浓度为1 mmol/L,开始计时。利用分光光度计检测在420 nm波长条件下反应3 min时的吸光值,所有反应设3个平行。1 min催化1 umol的ABTS消耗掉的酶为1个酶活力单位(U)。
2.2.4 蛋白含量测定
采用马斯亮蓝法[19]测定蛋白含量。在595 nm处测定标准蛋白以及样品溶液的吸光值,根据标准蛋白吸光度衡量样品的蛋白含量。计算公式为:
2.2.5 产酶培养基条件对漆酶活性的影响
(1)不同碳源对漆酶活性的影响。分别以20 g/L的葡萄糖、蔗糖、淀粉、羧甲基纤维素钠为产酶培养基替代碳源,保持培养基其他成分不变,在30 ℃、175 r/min条件下培养5 d后测定漆酶活性。所有试验均重复3次。
(2)不同氮源对漆酶活性的影响。分别以5 g/L的硫酸铵、硝酸铵、硝酸钠和硝酸钾为基础产酶培养基替代碳源,保持培养基其他成分不变,在30 ℃、175 r/min条件下培养5 d后测定漆酶活性。所有试验均重复3次。
(3)不同磷源对漆酶活性的影响。分别以2 g/L的磷酸氢二钠、磷酸二氢钠、磷酸氢二钾及复合磷源(磷酸二氢钾与磷酸氢二钠质量比为10∶1)为基础产酶培养基替代磷源,保持培养基其他成分不变,在30 ℃、175 r/min条件下培养5 d后测定漆酶活性。所有试验均重复3次。
(4)铜离子对漆酶活性的影响。设置铜离子(无水硫酸铜)浓度梯度分别为0、0.5、1.0、1.5、2.0、3.0、4.0 mmol/L,保持培养基其他成分不变,在30 ℃、175 r/min条件下培养5 d后测定漆酶活性。所有试验均重复3次。
(5)不同诱导剂对漆酶活性的影响。在产酶菌体生长第二天分别添加诱导剂咔唑、萘酚、芘、蔥至产酶培养基中,诱导剂添加浓度均为2×10-4mmol/L,在30 ℃、175 r/min条件下摇床培养5 d后测定漆酶活性。所有试验均重复3次。
2.2.6 培养环境对漆酶活性的影响
以漆酶活性为评价指标,保持最佳产酶培养基成分不变,针对初始pH值、温度、摇床转速和接种量4个变量开展培养环境对漆酶活性影响因素研究。所有试验均重复3次。
2.2.7 粗酶液对微生物原油降解速率的影响
分别将5 mL过夜培养的复合制剂(粗酶制剂+菌剂,体积比1∶1)及单一制剂(石油降解菌液)置于30 mL原油培养基中,在30 ℃,175 r/min下培养。每隔48 h测定原油浓度变化情况,选用二氯甲烷(色谱级,4L)为萃取液,利用重量差值法[20]计算残油量,连续测试18 d。所有试验均重复3次。
3 结果与讨论
3.1 基础产酶培养基中产漆酶的一般过程
本研究对PC菌在基础产酶培养基上产漆酶历程进行研究,经过144 h的培养,漆酶活性及蛋白含量随时间变化曲线如图1所示。由图1可知,培养前期(0~60 h)PC菌漆酶活性及蛋白含量均较低,分别为4.10±0.89 U/L和0.25±0.092 mg/L,这主要是由于大部分产漆酶真菌在培养的初始阶段仅为菌体的生长而并未分泌漆酶,漆酶作为次生代谢产物[21],大量生成主要集中在培养的第二阶段,故真菌产胞外漆酶的产酶周期一般较细菌长。进入培养中期(72~120 h)后,漆酶活性及蛋白含量均迅速增加,并均在120 h达到最大值,分别为118±10.33 U/L和1.49±0.55 mg/L,表明PC菌进入迅速增长期,且产生的蛋白大多为漆酶蛋白。进入培养后期(132~144 h),漆酶活性及蛋白含量均呈迅速下降趋势,分别由79.33±8.24 U/L降至38.24±5.42 U/L和1.02±0.42 mg/L降至0.35±0.13 mg/L,这主要是由于随着菌体生长代谢,培养基中营养成分大量消耗,导致菌剂生长受到抑制,漆酶活性及蛋白含量大幅下降。据此,确定60 h(5 d)为PC菌最优培养时间。该结论与王蕾等[22]、李环明等[23]的研究结果一致。
3.2 培养基条件对漆酶分泌的影响
产酶培养基组成对真菌分泌漆酶的影响较大,主要影响因子为碳源[24]、氮源[25]、诱导物[26,27]等。据此,本研究选取碳源种类、氮源种类、磷源种类、Cu2+浓度及抑制剂种类5个指标开展单因素条件实验,对其产漆酶培养基成分进行优化。
由图2(a)可知,复杂碳源(羧甲基纤维素钠和淀粉)对PC菌分泌漆酶的影响显著高于简单碳源(葡萄糖和蔗糖),其中,以羧甲基纤维素钠作为替代碳源时漆酶活性最高,达399.37 ±5.99 U/L,约为基础产酶培养基的3.70倍。据此,选取羧甲基纤维素钠作为产酶培养基最优替代碳源。
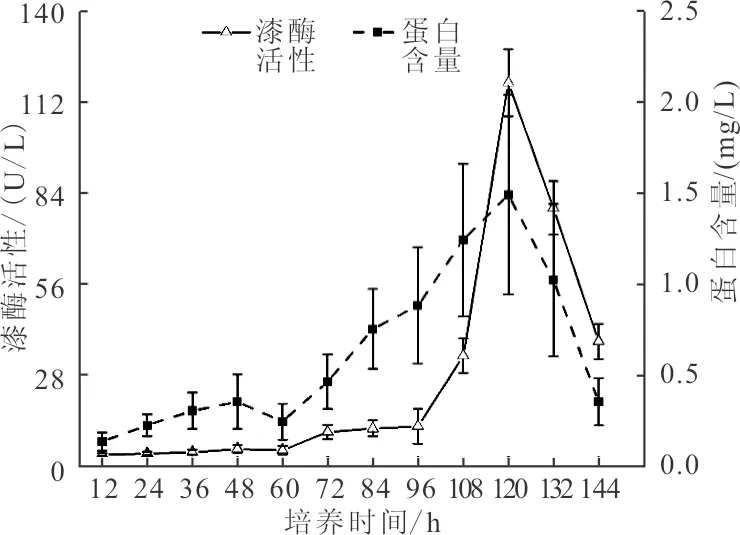
图1 漆酶活性及蛋白含量随时间变化曲线
由图2(b)可知,除硝酸氨外,其他氮源均对漆酶分泌产生了促进作用,影响最为显著的是硝酸钠,达到了320±10.25 U/L。据此,选取硝酸钠作为产酶培养基最优替代氮源。
由图2(c)可知,不同种类的磷源均对漆酶分泌有促进作用,其中磷酸氢二钾对漆酶分泌影响较为明显,达到了387±3.77 U/L。据此,选取磷酸氢二钾作为产酶培养基最优替代磷源。
由图2(d)可知,当培养基中Cu2+初始浓度为1.0 μmol/L时,漆酶活性最高,达190.59±10.14 U/L。但随着Cu2+浓度持续增加,漆酶活性逐渐下降。当Cu2+浓度达到4.0 umol/L时,漆酶活力显著下降至54.45±5.33 U/L。据此,在PC菌发酵产漆酶的过程中,Cu2+的浓度应控制在1.0 μmol/L。
由图2(e)可知,在各类诱导物均对漆酶的分泌具有较强的促进作用,尤其以蒽的促进作用最为明显,达725.18±30.71 U/L。据此,选取蒽作为产酶培养基最优诱导物。
综上,PC菌漆酶产量受产酶培养基培养条件影响较大,产漆酶培养条件参数可优化为:碳源为羧甲基纤维素钠20.00 g/L、氮源为硝酸钠5.00 g/L、磷源为磷酸氢二钾2.00 g/L、Cu2+浓度为1.00 μmol/L、诱导剂为蔥2.00×10-4mmol/L。

图2 培养基条件对漆酶分泌的影响
3.3 培养环境对漆酶分泌的影响
在最佳产酶培养基条件下,本研究选取初始pH值(3、4、5、6、7、8、9)、培养温度(25、30、35、40、45、50 ℃)、摇床转速(0、50、100、150、200、250、300 r/min)及接种量(体积分数,0.20%、0.50%、1.00%、2.00%、2.50%、3.00%)4个指标综合考察培养环境对漆酶分泌效果的影响。
如图3(a)所示,漆酶活性在初始pH值5~7均活性最强,最高可达700.13±22.14 U/L。当pH<5时,漆酶活性迅速下降至10.33±0.55 U/L;pH>7时,漆酶活性呈缓慢下降趋势,表明PC菌在酸偏中性环境中可以保持较好的活性。据此,选择pH值5~7为最优初始pH值。
如图3(b)所示,漆酶活性在30 ℃时活性最强,达213.14±15.13 U/L。当培养温度>30 ℃时,漆酶产量明显降低,最低仅为6.02±2.33 U/L。据此,从大规模工业化生产和产酶效率的角度综合考虑,30 ℃是较为适宜PC菌生产漆酶的培养温度。
如图3(c)所示,随转速的增加,漆酶活性呈逐渐上升趋势,当转速达到200 r/min 时,PC菌产漆酶活性最高,达523.17±30.99 U/L;当转速>200 r/min,漆酶活性呈现下降趋势,这主要是由于振动产生的机械剪切力破坏酶结构所致。据此,选择200 r/min作为最优摇床转速。
如图3(d)所示,随着菌体接种量的增加漆酶活性呈上升趋势,当菌体接种量为1.5%时,酶活性达到最大值,为415±33.28 U/L。当接种量>1.5%,漆酶活性稳定在300 U/L左右。据此,选择1.5%为最优接种量。
综上,环境条件的变化亦对漆酶活性产生较大影响,PC菌产漆酶最优环境参数可优化为初始pH值为5~7、初始温度30 ℃、摇床转速为200 r/min,接种量1.5%。
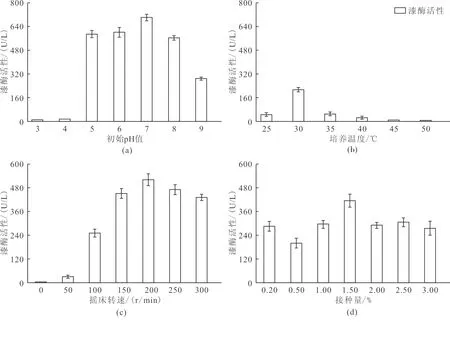
图3 培养环境对漆酶活性的影响
3.4 粗酶制剂性能评价
高效石油降解制剂原油降解效率随时间变化曲线如图4所示。由图4可知,经过18 d的原油降解实验,复合制剂(粗酶制剂+菌液)对原油TPHs降解效果显著高于单一制剂(仅投加菌液),TPHs去除率分别为63.13%和46.75%。
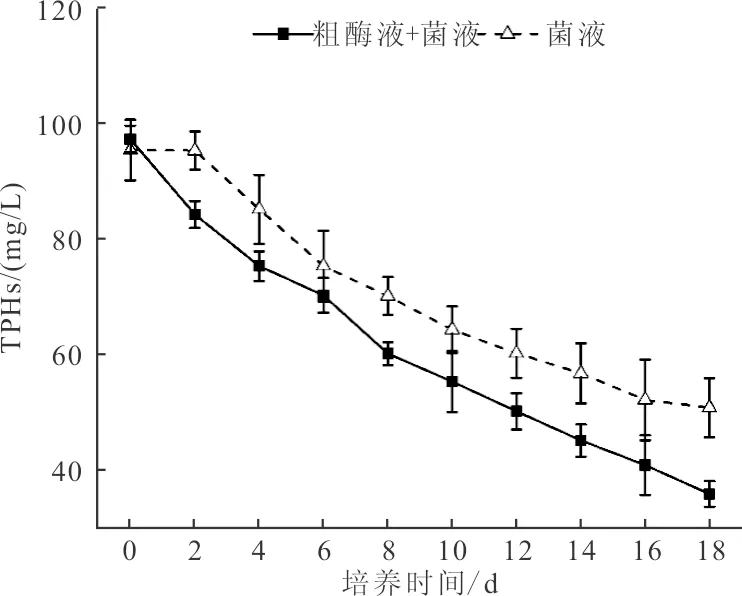
图4 原油降解效率随时间变化曲线
从原油速率来看,单一制剂对原油的降解存在4 d迟滞期,而复合制剂对原油的降解仅存在2 d的迟滞期。利用SPSS软件计算可知,单一制剂的反应速率模型为:C=92.02e-0.019t,复合制剂的反应速率模型:C=86.74e-0.022t,故复合制剂的原油降解速率约为0.022[mg/(L·d)],单一制剂的原油降解速率约为0.019[mg/(L·d)],表明粗酶制剂可有效加快微生物对石油降解的启动速度。
综上,粗酶制剂不仅能加快微生物降解原油的启动速度,还可加强菌种的底物利用范围,对石油污染修复起着至关重要的作用。
4 结论
本研究采用单因素实验分别考察产酶培养基条件及培养环境条件对PC菌产漆酶活性的影响,得出了漆酶最佳液体发酵工艺参数:初始pH值5~7、初始温度30 ℃、摇床转速200 r/min,接种量1.5%、碳源为羧甲基纤维素钠20.00 g/L、氮源为硝酸钠5.00 g/L、磷源为磷酸氢二钾2.00 g/L、Cu2+浓度为1.00 mmol/L、诱导剂为蔥2.00×10-4mmol/L。同时,基于最佳漆酶发酵工艺参数开展粗酶制剂原油生物降解性能评价。结果表明:复合制剂原油TPHs降解效率显著单一制剂,可有效提高微生物原油降解速率,具备更为强大的环境耐受性和微生物底物作用能力。
