冷藏对虾中腐败希瓦氏菌活菌EMA-qPCR检测方法的建立
2019-05-15唐廷廷李美良韩国全
肖 玲,唐廷廷,李美良,韩国全*
(1.四川农业大学食品学院,四川 雅安 625014; 2.重庆三峡职业学院,重庆 万州 404155)
腐败希瓦氏菌(Shewanella putrefaciens)属于希瓦氏菌科、希瓦氏菌属,为革兰氏阴性菌,兼性厌氧,是冷链流通过程中高蛋白食品中的主要腐败菌[1]。该菌能还原鱼类等水产生物肌肉中的氧化三甲胺(trimethylamineoxide,TMAO),生成二甲胺(dimethylamine,DMA)和甲醛(formaldehyde,FA),并产生H2S,从而导致水产品的腐败,造成了巨大的经济损失[2]。腐败希瓦氏菌也是人类潜在病原菌,能导致人软组织感染、肺炎和心内膜炎等疾病[3-5]。
食品中腐败希瓦氏菌传统鉴定首先需用培养基分离,再进行生化鉴定,整个周期过长,且由于培养基的敏感性、生化反应的稳定性等因素严重影响了腐败希瓦氏菌的检出率和准确性[6-7]。近年来,随着分子生物学的发展,普通PCR 和实时荧光PCR被用于细菌等微生物的快速鉴定。但普通PCR 和实时荧光PCR 也能扩增死菌或自由状态的DNA,进而导致腐败希瓦氏菌活菌检验时假阳性的产生[8]。因此,迫切需要一种特异、准确、快速检测腐败希瓦氏菌活菌的新检测方法。有文献报道指出叠氮溴乙锭(EMA)能够选择渗透进入死细胞,在光作用下与死细胞内的DNA 发生共价不可逆的结合,从而抑制死细胞DNA 的PCR 扩增,但对活细胞DNA 影响甚微,能够有效降低普通PCR 和实时荧光PCR 检测时的假阳性[6,9]。
EMA-qPCR 技术已被证实在细菌活菌诊断上具有极好的稳定性与应用价值,但目前尚无关于该技术在腐败希瓦氏菌的研究及应用报道[8]。本研究旨在将EMA 与实时荧光PCR 技术相结合,建立一种特异、准确、快速检测食物中腐败希瓦氏菌活菌的检测方法。
1 材料和方法
1.1 试验材料
1.1.1 试验菌株
腐败希瓦氏菌(Shewanella putrefaciens,ATCC BAA-1097)、拟态弧菌(Vibiro mimicus,ATCC 33653)、单增李斯特菌(Listeria monocytogenes,ATCC 19111)、副溶血弧菌(Vibrio Parahemolyticus,ATCC 33847)、鲍希瓦氏菌(Shewanella haliotis,ATCC 49138)、表皮葡萄球菌(Staphylococcus epidermidis,ATCC 12228)、金黄色葡萄球菌(Staphylococcusaureus,ATCC25923)、鼠伤寒沙门菌(Salmonellatyphimurium,ATCC 13311)、粪链球菌(Escherichia faecalis,ATCC 8043)、乙型溶血性链球菌(Streptococcus pyogens,ATCC 32210)购于中国微生物菌种保藏中心;蜡样芽胞杆菌(Bacillus cereus,CMCC 63303)、大肠埃希菌(Escherichia coli,M-2-7)购于中国药品生物制品检定所。
1.1.2 主要试剂
叠氮溴乙锭(EMA),Biotium 公司(美国);SYBR Premix Ex TaqTMII 试剂盒,TaKaRa 公司(中国);LB培养基,上海依赫生物科技有限公司(中国);细菌基因组DNA 提取试剂盒(DP302),天根生化科技(北京)有限公司。
1.2 方法
1.2.1 腐败希瓦氏菌活菌和死菌的制备
取腐败希瓦氏菌(ATCC BAA-1097)接种LB 固体培养基,25 ℃,培养24~36 h 后,挑取单菌落,接种到LB 液体培养基中,在25 ℃,250 r/min 振荡过夜培养,经革兰氏染色验纯后,用麦氏比浊法调整菌悬液浓度为1×107CFU/mL,即为活菌悬液[10]。结合预实验结果,活菌悬液于100 ℃水浴加热10 min,可获得死菌悬液。
1.2.2 引物及荧光定量PCR 反应条件
选择腐败希瓦氏菌的gyrB 基因序列(登录号:NC_009438.1),用DNAMAN 软件设计特异性引物。引物由宝生物工程(大连)有限公司合成。引物序列如下:上游引物(gyrB F)5′-GACGAACCAGCACTGACTCAATACCT-3′;下游引物(gyrB R)5′- GCCATCTAACGCCGCACCTAACTTG-3′。PCR 反应体系为25 μL:2×Taq PCR Mastermix 12.5 μL,上下游引物各0.5 μL,DNA 模板1 μL,ddH2O 补足体积为25 μL。反应条件为:94 ℃预变性5 min;94 ℃变性30 s,62 ℃退火30 s,30 个循环。qRT-PCR 扩增完成后分析熔解曲线。如果Ct 值≤35 则判定为阳性,Ct 值>35 或无Ct 值判定为阴性。
1.2.3 EMA 作用浓度和作用时间的优化
取16 支无菌EP 管,按1 mL/支,分别加入浓度均为1×107CFU/mL 的腐败希瓦氏菌死菌液8 支和活菌液8 支。活菌和死菌组,均依次避光分别加入0、5、10、15、20、25、30、40 μg/mL 的EMA,室温静置5 min,将EP 管置于冰上距离卤素灯灯管15 cm 处垂直照射5 min。取200 μL 进行荧光定量PCR 扩增。
相同方法把40 μg/mL 的EMA 与腐败希瓦氏菌死菌液和活菌液混合,分别室温静置0、5、10、15、20 min,取200 μL 进行荧光定量PCR 扩增。
1.2.4 最低检出限和对死菌抑制率检测
采用麦氏比浊法,按10 倍稀释,制备浓度依次为1×107、1×106、1×105、1×104、1×103、1×102、1×101CFU/mL 的腐败希瓦氏菌活菌液,各取200 μL 进行EMA 实时荧光PCR 扩增,以确定该方法的最低检出限。
取1×106、1×105、1×104、1×103、1×102、1×101、1 CFU/mL 的腐败希瓦氏菌,经100 ℃水浴加热10 min。按上述方法进行EMA-qPCR 扩增,确定该方法对死菌DNA 抑制率。
1.2.5 EMA-qPCR 在死活菌混合体系中的选择性扩增
以固定数量的死细胞(1×104CFU)分别与不同数量的活细胞(1×106、1×105、1×104、1×103、1×102和1×101CFU)混合形成不同死、活细胞比例的混合菌液。用优化的EMA 浓度和时间处理菌液。取200 μL进行荧光定量PCR 扩增。
1.2.6 特异性验证
选用腐败希瓦氏菌、蜡样芽胞杆菌、拟态弧菌、单增李斯特菌、副溶血弧菌、鲍希瓦氏菌、表皮葡萄球菌、乙型溶血性链球菌、大肠埃希菌、金黄色葡萄球菌 鼠伤寒沙门菌和粪链球菌进行EMA-qPCR 扩增,验证方法的特异性。
1.2.7 冷藏对虾中腐败希瓦氏菌的EMA-qPCR 扩增
在四川成都某3 个大型超市和一个水产品销售门市部共采集冷藏南美白对虾101 尾。无菌操作,采集样品躯干部肌肉和肝胰腺,按1∶5 加入无菌生理盐水,冰水浴条件下,组织匀浆机打碎,4 000 r/min离心10 min,取上清液。将上清液分为3 部分:第1部分取0.1 mL 涂布于LB 培养板,25 ℃培养24~48 h,进行平板计数,每个样本做3 个平行;第2 部分上清按照1.2.3 中优化方法,经EMA 及卤素灯光照处理后,取适量进行qPCR 扩增;第3 部分上清不做任何处理直接进行qPCR 扩增。
1.2.8 细菌16S rDNA 鉴定
分离纯化1.2.7 平板生长的优势细菌,挑取纯化后的单菌落,加入含100 μL 无菌水的EP 管中混匀,参照细菌DNA 提取试剂盒说明书,提取细菌DNA 作为模板,进行PCR 扩增。引物序列:F:5'-AGAGTTTGATCCTGGCTCAG-3',R:5'-CTACGGCTACCTTGTTACGA-3'。PCR 反应体系:DNA 模板2 μL,上下游引物各1 μL、Taqmix 12.5 μL、ddH2O补足至25 μL。反应程序:94 ℃变性5 min,94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸1 min,35 个循环,72 ℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测,电泳完成后凝胶照相仪照相,根据条带大小,选择符合要求的扩增产物进行测序。测序由成都擎科梓熙生物技术有限公司完成。在NCBI 上将测序结果序列进行BLAST 比对,同源性≥95%为同一种细菌。
1.2.9 统计学分析
用SPSS 20.0 对实验数据进行分析。两组之间比较采用独立样本t 检验,3 组间比较用单因素方差分析(ANOVA-LSD),以P<0.05 为差异有统计学意义。
2 结果与分析
2.1 EMA 作用浓度和作用时间的优化结果
用不同浓度EMA 处理腐败希瓦氏菌死活菌(浓度为1×107CFU/mL)30 min,筛选最佳EMA 浓度。Ct 值表示循环阈值,Ct 越低,说明细菌DNA 浓度越高。检测结果如图1A 所示,用0、5 和15 μg/mL EMA 处理30 min,死菌的Ct 值分别为19.56±0.06、21.13±0.23 和25.54±0.15,当EMA 浓度在20~40 μg/mL时,无Ct 值,表明死菌DNA 被彻底抑制。在EMA浓度为0~40 μg/mL 范围内,活菌Ct 值从20.90~23.32,表明在EMA 浓度≤35 μg/mL 范围内,EMA浓度对活菌Ct 值影响不大。综合考虑,选择EMA 的浓度为20 μg/mL。
用20 μg/mL 的EMA 分别处理腐败希瓦氏菌死活菌0、5、10、15、20、25 min。死菌扩增的Ct 值呈时间依赖性增加,与对照组相比,各时间点Ct 值均具有显著性差异(P<0.05,在20 min 后,Ct 值无显著性变化,表明死菌DNA 的扩增被完全抑制。20 μg/mL的EMA 在0~20 min 内对活菌Ct 值均小于20,且各组之间无显著性差异(P>0.05),见图1B。综合考虑成本与效率,选择EMA 的作用时间为20 min。
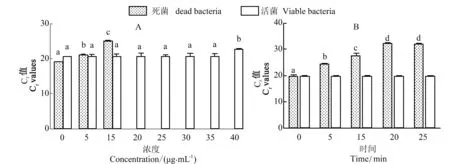
图1 EMA 作用浓度和作用时间的优化结果Figure 1 Optimization of EMA concentration and irradiating times
2.2 EMA-qPCR 对活菌最低检出限结果
分别对浓度为1×107、1×106、1×105、1×104、1×103、1×102、1×101CFU/反应的腐败希瓦氏菌活菌进行EMA-qPCR 检测。结果发现在活菌数为1×101~1×107CFU 范围内,Ct 值与对应活菌数目的对数值(X)呈良好的线性关系,Ct=-3.37X+32.47,相关系数为0.996 6,见图2。通过Ct 值直接可以计算qPCR 中的活菌数目,方法的最低检出限浓度为1 CFU/反应。
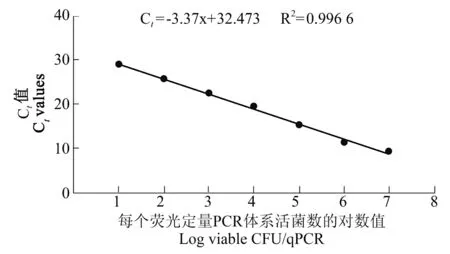
图2 EMA-qPCR 对活菌检测结果Figure 2 The results of EMA-qPCR for the detection of viable bacteria
2.3 EMA-qPCR 对死菌抑制结果
分别对腐败希瓦氏菌死菌1×106、1×105、1×104、1×103、1×102、1×101、1 CFU/反应进行EMA-qPCR 检测。结果发现1×106CFU/反应死菌的Ct 值为33.55±0.55。其余死菌Ct 值在35.33±0.72 到无Ct 值。因此,该方法对死菌的最高抑制浓度为1×105CFU/反应。
2.4 EMA-qPCR 在死活菌混合体系中的选择性扩增结果
将1×104CFU 的死细胞与1×106、1×105、1×104、1×103、1×102、1×101CFU 活细胞混合后,加入EMA,使其终浓度为20 μg/mL。结果发现死菌DNA 被彻底抑制,随着活菌浓度的降低,Ct 值逐渐增大,具体结果见图3。
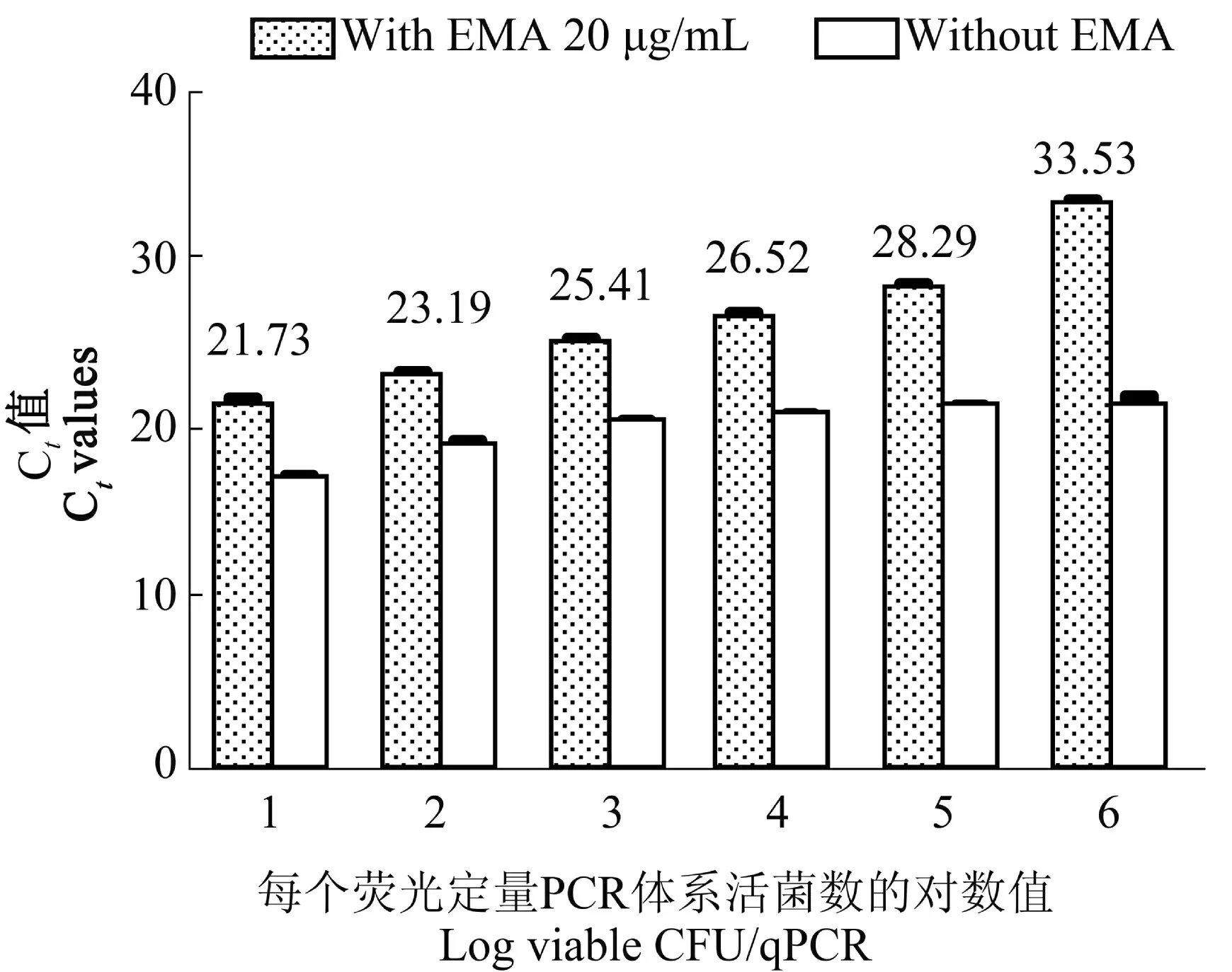
图3 死、活细胞混合体系的EMA-qPCR 扩增Figure 3 The amplication of mixed bacteria by EMA-qPCR
2.5 特异性验证结果
对10 株细菌进行EMA-qPCR 进行检测,结果显示腐败希瓦氏菌的扩增Ct 值27.31±0.07,其它细菌Ct 值均大于35。图4为部分细菌扩增结果。
2.6 EMA-qPCR 在冷藏对虾样品中的应用
对采集的101 尾冷藏南美白对虾均分别用平板培养法,qPCR 法和EMA-qPCR 法检测腐败希瓦氏菌。结果发现平板培养法、qPCR 法和EMA-qPCR法分别在19、16 和12 尾对虾中检测到腐败希瓦氏菌。其中,3 种检测方法均分别在相同12 尾对虾中(第3、10、17、18、33、42、56、63、75、86、93 和97 号)检测到腐败希瓦氏菌;qPCR 法和EMA-qPCR 法在另外4 尾对虾中(第6、27、69 和89 号)均检测到腐败希瓦氏菌;还有3 尾对虾(第52、65 和80 号),仅qPCR 检测到腐败希瓦氏菌阳性。本研究结果表明建立的EMA-qPCR 法与平板培养法相比,灵敏度更高;与qPCR 法相比,能减少腐败希瓦氏菌活菌检测的假阳性。
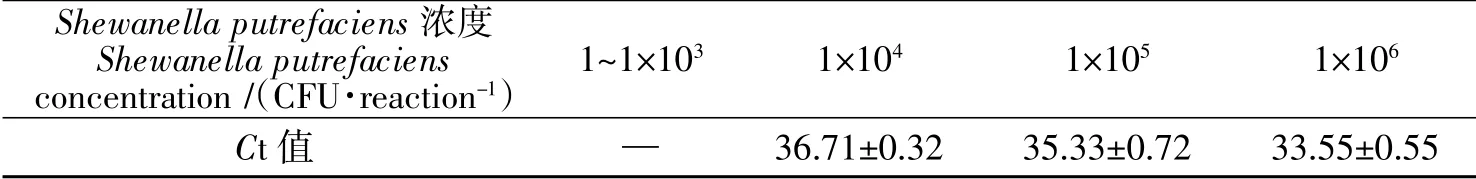
表1 不同浓度的腐败希瓦氏菌死菌EMA-qPCR 检测结果Table 1 Detection results of dead S.putrefaciens of ferent concentrations by EMA-qPCR
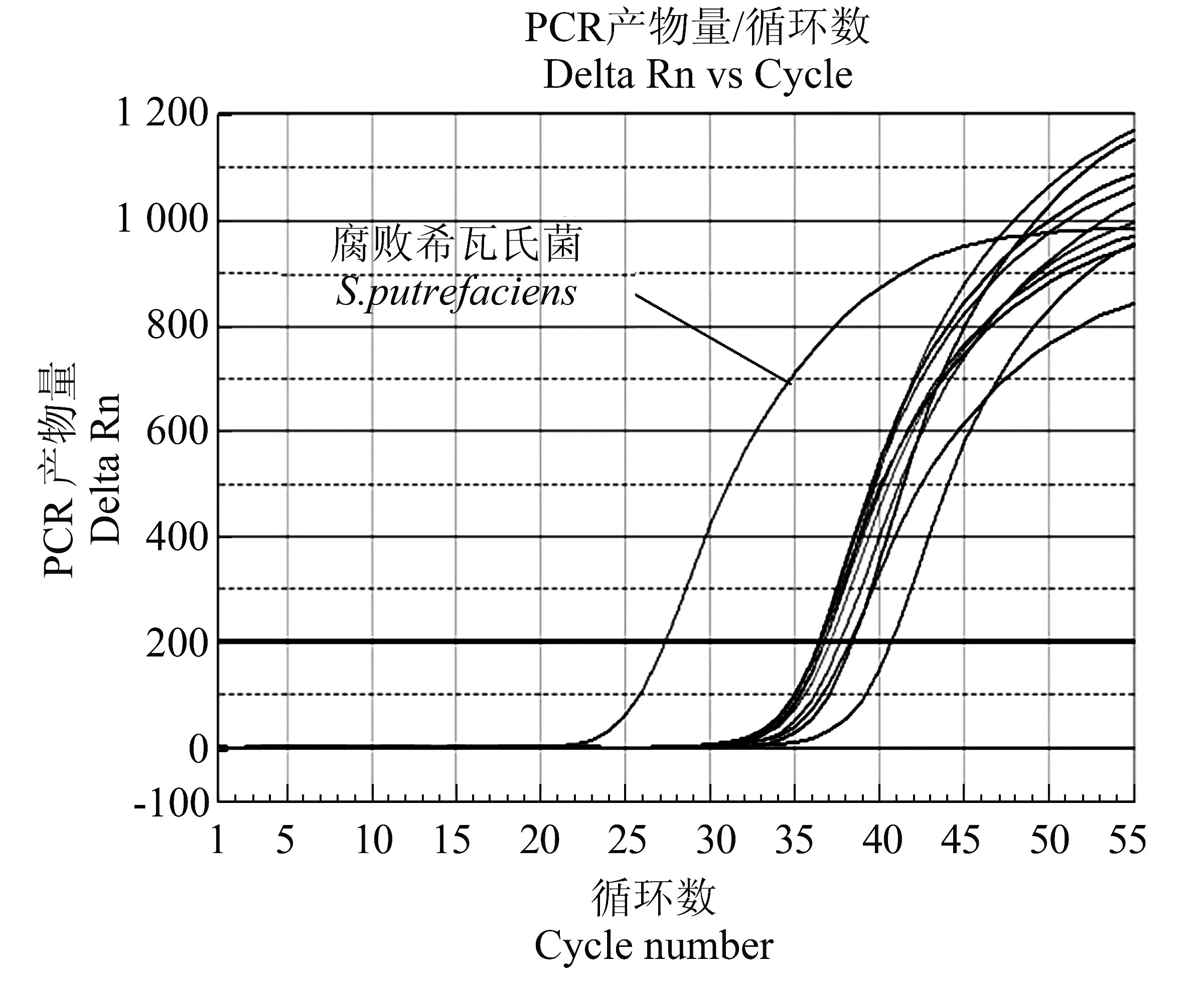
图4 腐败希瓦氏菌EMA-qPCR 检测技术特异性检测结果Figure 4 Results of detection specificity for S.putrefaciens by using EMA-qPCR
3 讨论与结论
腐败希瓦氏菌广泛分布在自然界,特别是在水生环境,如海洋、淡水及水产生物中,是高蛋白食品常见的特定腐败菌[11]。近年来,随着我国经济的快速发展,居民生活水平的也显著提高,低脂肪和高蛋白的水产品越来越受到人们的喜爱。如此大大加剧了腐败希瓦氏菌的感染率。因此,水产品中腐败希瓦氏菌的快速、准确鉴定极为重要。目前对腐败希瓦氏菌鉴定的方法主要包括平板分离培养和PCR鉴定[12]。平板分离培养虽然操作简单,但周期较长,特异性低[13]。普通PCR 或荧光定量PCR 虽然周期短,灵敏度较高,但由于腐败希瓦氏菌死菌DNA 能在食品中保存很长时间[14],在进行PCR 反应时死菌DNA 也被扩增,容易导致PCR 鉴定假阳性。从食品安全角度考虑,存活的腐败菌较死菌有更强的扩散及传播风险,尤其对于生食水产品而言,活菌的定量检测具有十分重要的意义,需要建立一种高效、准确、快速的活菌检测方法。
EMA 能够选择性的进入死细胞,而不能进入细胞膜完整的活细胞。EMA 能在光刺激作用下与DNA 结合,抑制DNA 的扩增。将EMA 与传统PCR或qPCR 结合可以选择性的仅扩增活菌DNA,从而快速、准确的区分死菌和活菌,有效降低传统PCR或qPCR 检测产生的假阳性。EMA-qPCR 检测技术已被用于食品和环境中部分病原菌的检测[15-16],但对腐败希瓦氏菌的检测还没有被报道。
本研究首先用腐败希瓦氏菌标准菌株进行了EMA-qPCR 方法的建立。研究结果表明当EMA 浓度为20 μg/mL,作用时间为20 min 时,EMA 能够彻底抑制1×107CFU/mL 腐败希瓦氏菌死菌DNA 的扩增。张俊彦等[6]建立了食品中单增李氏特菌活菌的EMA-qPCR 检测方法,其方法对单增李氏特菌活菌的最低检出限为54 CFU,本检测方法的最低检出限为1 CFU,表明该方法灵敏度较高。EMA-qPCR对死菌抑制实验显示能够抑制最高浓度为1×105CFU/反应的死菌DNA 扩增。qPCR 虽然能够快速检测食品中细菌的含量,但由于死菌DNA 不能完全降解,因此,在进行qPCR 检测活菌含量时,往往导致假阳性的产生。EMA 作为一种核酸染料,在光作用下与死细胞内的DNA 发生共价不可逆的结合,可以减少PCR 扩增时假阳性的产生。本研究死菌和活菌混合实验结果表明,对于不同比例的死活菌,EMA 能够抑制死菌DNA 扩增,但对活菌DNA 扩增无影响。表明建立的方法能对混合体系中的活菌数进行快速定量。特异性验证实验中腐败希瓦氏菌Ct为27.31±0.07,其余9 株细菌扩增的Ct 均大于35,说明该方法特异性良好。黄新新等[17]用另一种核酸染料叠氮溴化丙锭(propidium monoazide,PMA)联合qPCR 建立了冷冻食品中副溶血孤菌的检测方法,发现PMA-qPCR 既能有效抑制对死菌的扩增,又能克服传统平板培养法的漏检缺陷。本研究对101 尾冷藏南美对虾样品检测结果显示,建立的EMA-qPCR 也能克服传统平板分离培养法的漏检缺陷。与普通qPCR 相比,又能减少腐败希瓦氏菌活菌检测时的假阳性。
综上所述,本研究建立了基于EMA-qPCR 的冷藏对虾腐败希瓦氏菌活菌检测新方法,可及时、准确的定量检测水产品等食品中的腐败希瓦氏菌,能够预警水产食品被活腐败希瓦氏菌污染程度,辅助评价食品安全质量,减少人类因误食或因直接创口接触感染导致的疾病发生。
