在微通道反应器中探究Paal-Knorr反应动力学
2019-05-13田念蒙楼一先沈海伟倪意文夏春年浙江工业大学药学院浙江杭州310014
田念蒙,楼一先,沈海伟,倪意文,夏春年(浙江工业大学药学院,浙江 杭州 310014)
0 引言
微通道技术起始于20世纪90年代的微流控技术,属于微观范畴[1]。通过将其与普通间歇式反应器相比,发现微通道反应器由于它尺寸较小(微米级通道),有较大的比表面积,可以精确控制反应时间和物料配比[2-4],因此具有传质和传热效率高、安全性高、可直接放大生产无放大效应、可高度集成化、绿色环保等优点[5]。体现在微反应器中,可以明显缩短反应时间、大幅度提高反应转化率,控制反应选择性,提高产品收率等[6-7]。
该反应最初由德国化学家Carl Paal[8]和Ludwig Knorr[9]于1884年分别描述为合成呋喃的方法,然后进行了吡咯和噻吩合成的改良。但釜式反应中存在诸多难以解决的问题,例如酸性条件下加热、反应时间较长、杂质多和产率低等[10-12],为了拓展Paal-Knorr反应的应用范围,探索并优化了微通道反应器中的反应条件且回归出反应动力学速率常数。
1 合成方法
1.1 反应方程式
1-(2-羟基乙基)-2,5-二甲基吡咯的合成方程式如下:
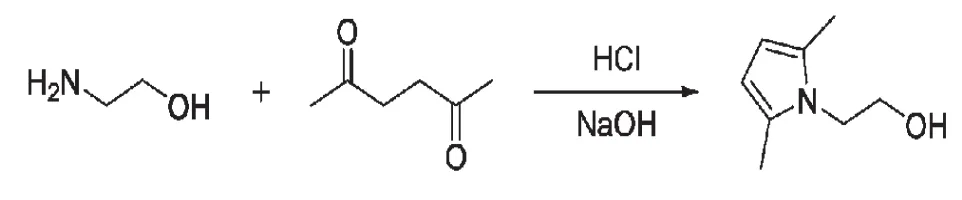
1.2 实验步骤
使用三支气密性注射器 (每根体积为1 mL)分别抽取已精确配置的一定浓度的2,5-己二酮、乙醇胺和氯化氢甲醇溶液,固定至注射泵上,设置相应保留时间的流速和背压阀压力。氯化氢甲醇在反应器末端加入,用于淬灭反应。
检查设备无异常情况后,启动注射泵运行反应器,设定背压阀压力,待产品管有液体流出时,升温到所需的温度并在该温度下运行几分钟,待设备稳定后开始收集反应液,并记录时间和压力,在收集一定量的反应液后,停止收集;重复上述过程,完成下一批次物料收集。实验完成后至室温,关闭注射泵以停止反应,完成一组实验。
待压力降至标准大气压后,取下气密性注射器,重新抽取反应液,进行下一组实验。
收集得到的样品用气相色谱进行检测,统计数据,拟合反应动力学。
微通道管道示意如图1。
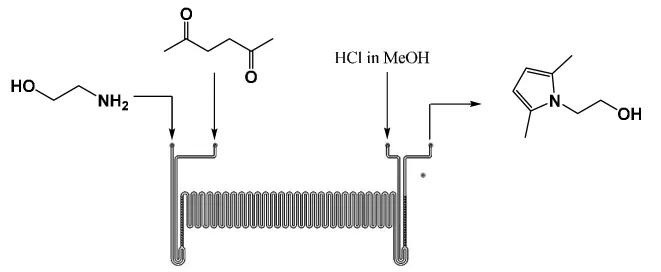
图1 微通道制备1-(2-羟基乙基)-2,5-二甲基吡咯Fig.1 Preparation of 1-(2-hydroxyethyl)-2,5-dimethylpyrrole by microchannel
2 实验部分
2.1 主要实验仪器及试剂

表1 实验试剂Table 1 Experimental reagent
表2 实验仪器及设备Table 2 Experimental instruments and equipment
2.2 条件优化
设定5 mol/L的反应原料液进行反应。对不同温度 (25℃、75℃、100℃、125℃以及150℃)和保留时间 (9.3 s、18.6 s、37.1 s、74.2 s、148.4 s)进行控制单一变量进行优化,共25组不同条件,分别在这些条件下进行反应,收集样品,用气相色谱检测,收集汇总结果如表3:
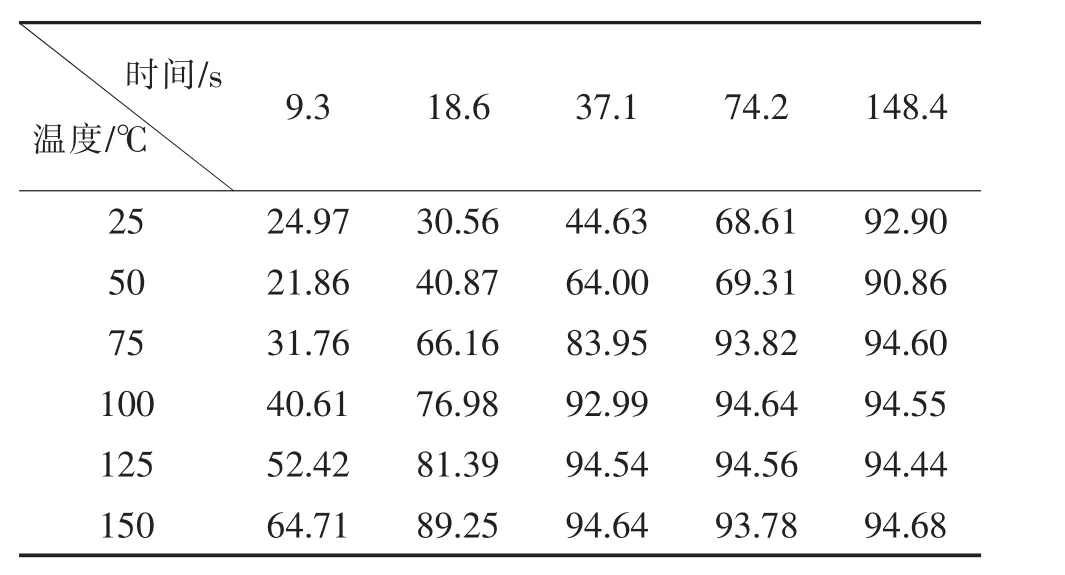
表3 反应温度和时间对1-(2-羟乙基)-2,5-二甲基吡咯流动合成影响的数据汇总(转化率/%)Table 3 Data summary of the effect of reaction temperature and time on the flow synthesis of 1-(2-hydroxyethyl)-2,5-dimethylpyrrole(Conversion rate/%)
由图2可以看出,反应温度越高,反应越快,转化率越高。反应温度较高,反应时间37.1 s就已达到高峰,延长保留时间转化率变化也不明显。确定在5 mol/L原料液的条件下,2,5-己二酮与乙醇胺反应的最佳条件为:反应温度为150℃,保留时间为37.1 s。
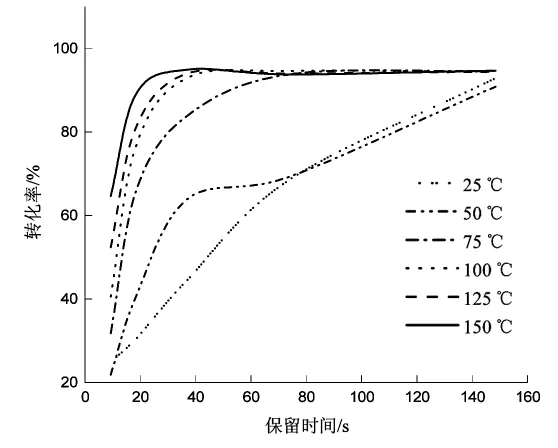
图2 反应温度和时间对1-(2-羟乙基)-2,5-二甲基吡咯流动合成影响的图示Fig.2 Illustration of the effect of reaction temperature and time on the flow synthesis of 1-(2-hydroxyethyl)-2,5-dimethylpyrrole
2.3 拟合反应动力学
从图2看出,反应在75℃下进行时,随着保留时间的延长,转化率逐渐增加,具有最大的保留时间效应。选择在75℃的温度条件下,探究反应浓度和保留时间的关系,尝试拟合反应动力学。

表4 反应浓度和时间对1-(2-羟乙基)-2,5-二甲基吡咯流动合成影响的数据汇总(转化率/%)Table 4 Data summary of the effect of reaction concentration and time on the flow synthesis of 1-(2-hydroxyethyl)-2,5-dimethylpyrrole(Conversion rate/%)
进行拟合反应动力学,求取反应速率常数。
首先假设反应级数为零级,求取反应浓度与保留时间的关系表5。
由数据汇总表绘制关系图(图3)。
从图3可看出,没有线性关系,判定不是零级反应。
假设反应级数为一级,求取反应浓度与保留时间的关系,如表6所示。
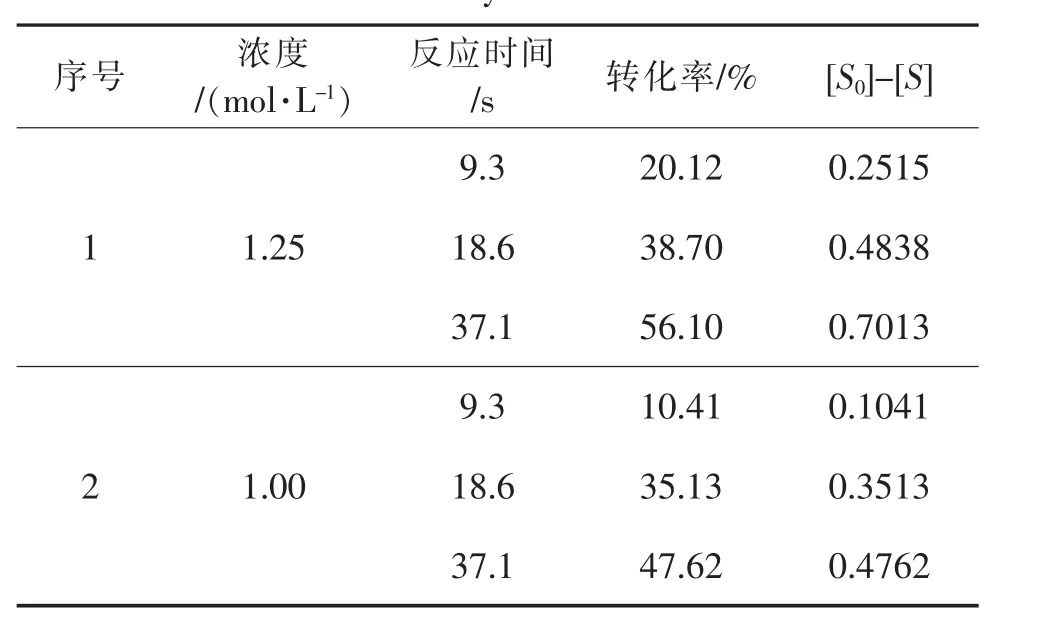
表5 零级反应数据汇总Table 5 Data summary of zeroth order reaction

图3 [S0]-[S]与时间的关系图Fig.3 [S0]-[S]versus time graph
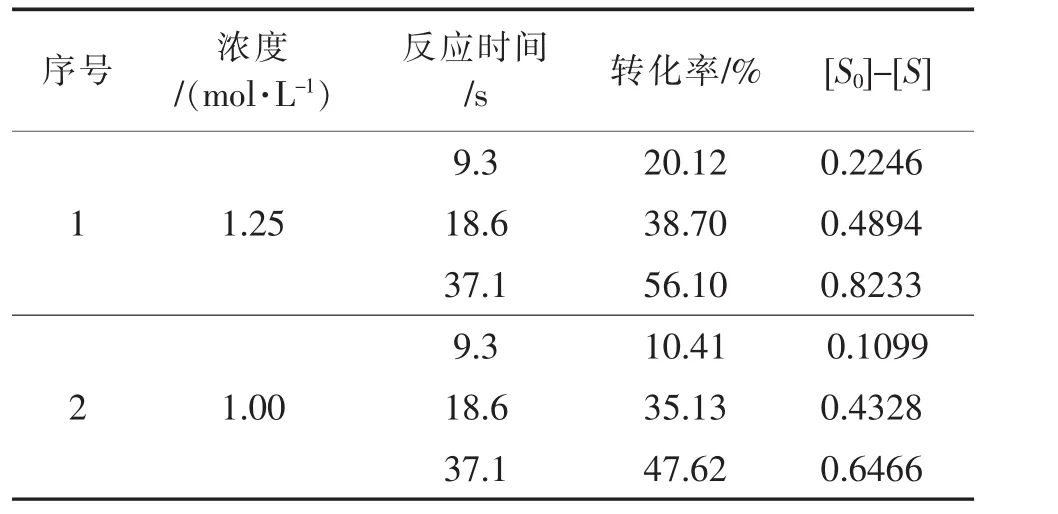
表6 一级反应数据汇总Table 6 Data summary of first order reaction
由数据汇总表绘制关系图(图4)。
从图4看出,没有线性关系,判定不是一级反应。
假设反应级数为二级,求取反应浓度与保留时间的关系,如表6所示。
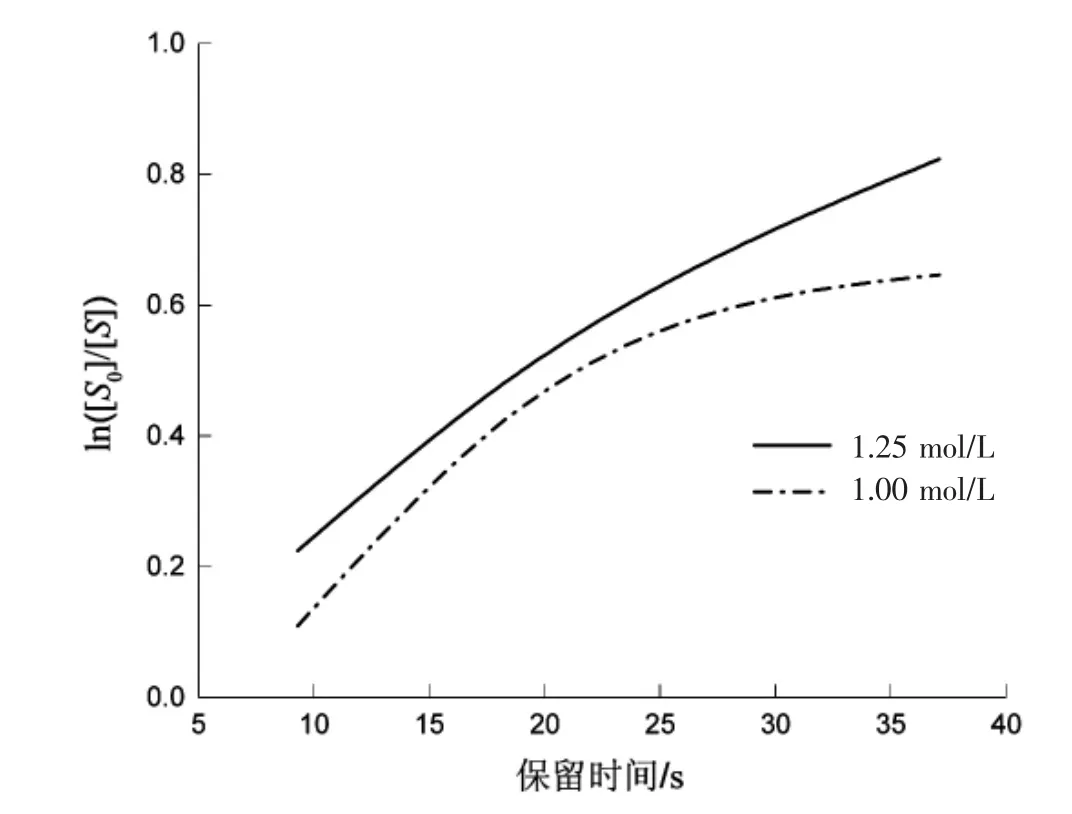
图 4 ln([S0]/[S])与时间的关系图Fig.4 ln([S0]/[S])versus time graph

表7 二级反应数据汇总Table 7 Data summary of second order reaction
由数据汇总表绘制关系图(图5)。
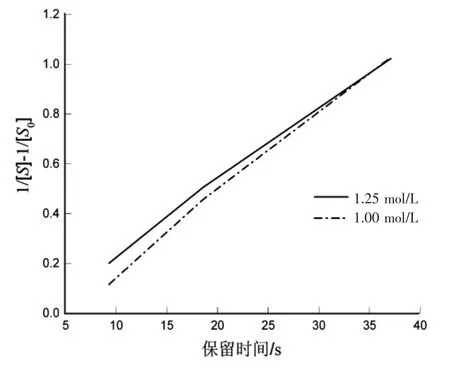
图 5 ln([S0]/[S])与时间关系图Fig.5 ln([S0]/[S]) versus time graph
从图5可看出,存在明显的线性关系,判定该反应为二级反应。1.25 mol/L的趋势方程为y=0.0293t-0.0586,R2=0.9984;1.00 mol/L 的趋势方程为y=0.0323x-0.1556,R2=0.9933。该反应为二级反应,反应速率常数 k=0.0308 L-1·mol-1·s-1。
3 结论
利用微通道反应器对Paal-Knorr反应动力学进行了探索,以2,5-己二酮与乙醇胺为原料,甲醇为溶剂,盐酸甲醇溶液为淬灭剂,合成1-(2-羟基乙基)-2,5-二甲基吡咯;用气相色谱仪(GC)对反应进行定性、定量分析;随后对反应条件(反应温度、保留时间)进行了一系列优化,得到最佳反应条件:反应温度150℃,保留时间37.1 s。确定在75℃下,该反应为二级反应,反应的速率常数为 0.0308 L-1·mol-1·s-1,与釜式反应动力学级数相一致[13],也进一步确认了微通道反应器不会改变反应的级数[14]。采用同样的方法应用到阿托伐他汀中间体的合成,得到相似的结果。
