VEGF介导PI3K-AKT信号通路在BMSCs移植治疗大鼠脊髓缺血再灌注损伤中的作用*
2019-05-07陈珊珊易敏春周国忠普跃昌韩米华胡毅金华
陈珊珊, 易敏春, 周国忠, 普跃昌, 韩米华, 胡毅, 金华
楚雄医药高等专科学校 1外科教研室 2内科教研室(云南楚雄 675000); 3云南省第一人民医院麻醉科(云南昆明650031)
脊髓缺血再灌注损伤(spinal cord ischemic reperfusion injury, SCIRI)指在脊髓缺血引起的原发性脊髓损伤基础上,由于恢复血流再灌注而引发的一系列继发性神经细胞损害,严重者发生不可逆性脊髓神经元迟发性死亡,导致不同程度的神经功能障碍,甚至截瘫,是脊髓供血动脉疾患、脊柱损伤、腹主动脉瘤或胸腹主动脉瘤等手术后严重并发症之一。近年来,干细胞移植治疗SCIRI成为研究的热点。间充质干细胞(BMSCs)具有来源广、易取材、免疫排斥反应弱、多向分化潜能及分泌多种神经营养因子等优点[1-3]。研究发现中风患者血清激活人BMSCs高表达血管内皮生长因子(VEGF)促进其神经恢复[4]。本研究组的前期研究发现BMSCs肾下腹主动脉移植一方面能减轻SCIRI大鼠脊髓缺血区神经元的坏死,另一方面可促进上下行神经纤维再生[5],可见动脉移植BMSCs是治疗SCIRI的一种有效的新手段。而这二者之间是否具有某种内在联系?为进一步明确BMSCs动脉移植治疗SCIRI大鼠的作用机制,我们于2017年7月至2018年7月观察移植BMSCs后的SCIRI大鼠脊髓缺血区AKT、Bcl-2、Bax和VEGF表达的变化,探讨血管再生机制在BMSCs动脉移植治疗SCIRI中的作用,为动脉移植BMSCs治疗SCIRI提供更有利的实验支持。
1 材料与方法
1.1 BMSCs体外培养、CD44鉴定及VEGF染色 脱颈椎法处死20 d SD乳鼠10只,在无菌条件下,剥离出双侧股骨,收集股骨中的骨髓进行原代、传代培养,传至第3代的BMSCs进行CD44和VEGF染色后用于移植。细胞培养及CD44、VEGF染色详细步骤见本研究组先前研究[5]。
1.2 动物分组与模型制备 24只成年雌性SD大鼠随机分为假手术组、对照组和移植组,每组8只,水合氯醛麻醉。SCIRI模型采用切断肾上腹主动脉的分支椎动脉、绑扎阻断肾下腹主动脉血流2 h后复通动脉恢复脊髓再灌注[6]。假手术组未切断、阻断动脉,手术过程同SCIRI模型。对照组经肾下腹主动脉阻断脊髓灌注2 h恢复再灌注5 min后,经股动脉置管推注10%胎牛血清(FBS)培养基1 mL。移植组恢复再灌注5 min后置管推注BMSCs悬液1 mL(1×106cell/mL)。术毕对所有大鼠进行严格止血、逐层缝合、青霉素抗感染及二便护理。
1.3 神经行为学(BBB)评价 应用Basso等[7]的BBB评分体系,分0~21级,包括大鼠后肢的运动、步态、协调性,躯干位置及稳定性,爪的摆放,足趾间隙和尾的位置等方面。满分21分,最低分为0分,双盲条件下由专业实验人员于术后0、4、8和14 d完成评分,取均值比较。
1.4 运动诱发电位(MEP)测定 参照文献[8]方法:术后14 d,保持受试动物清醒、俯卧位固定,经颅磁刺激(transcranial magnetic stimulation, TMS)刺激仪包括圆形刺激线圈(2×10匝,内、外径分别为10 mm、50 mm)、记录电极、参考电极及表面电极等核心部件,记录电极和参考电极针刺入腓肠肌,表面电极黏附于大鼠耳朵,磁力板中心置于大脑皮质运动区,以40%的刺激量单次刺激,重复刺激3~5次,信号采集系统描记和保存可重复的波形,标记潜伏期和波幅。
1.5 皮层体感诱发电位(CSEP)测定 MEP检测完成后1 h测定CSEP,方法:左下肢胫后神经放置刺激电极,鼻正中皮下放置参考电极,右侧大脑皮下连接记录电极,耳朵与接地电极相连。参数:滤波高频、低频分别为2 kHz和10 Hz,灵敏度10 μV/D,扫描速度10 ms/D,刺激强度控制在出现后爪抖动为宜。检测结果为记录的300次波叠加平均值。
1.6 标本处理 所有实验动物于术后14 d取材,水合氯醛麻醉,酒精浸泡消毒,撬开椎管(所有器械经灭菌、去RNA酶预处理)、游离L1、L2脊髓分存入2支去酶的EP管,-80℃暂存备用。
1.7 RT-PCR检测脊髓AKT、Bax、Bcl-2和VEGF mRNA表达 裂解、萃取提取总RNA,并鉴定其纯度和完整性。逆转录成cDNA,PCR扩增, 以反转录合成cDNA第一链为模板扩增,设置:94℃预变性5 min、变性和退火各1 min,72℃延伸1 min,循环30次;72℃ 总延伸10 min,10℃冷却。VEGF引物上游序列为5′-TACCCCGATGAGATAGAG-3′,下游序列为5′-TTGGACAAACAAATGCTT-3′,退火温度47℃,扩增产物348 bp。AKT引物上游序列为5′-CAGGTTCACCCAGTGACAACTCA-3′,下游序列为5′-CACGAGACAGGTGGAAGAAGAGC-3′,退火温度57℃,扩增产物360 bp。Bax引物上游序列为5′-GTTTCATCCAGGATCGAGCAGA-3′,下游序列为5′-GGAGTCCGTGTCCACGTCAG-3′,退火温度56℃,扩增产物258 bp。Bcl-2引物上游序列为5′-CCCCTGGCATCTTCTCCTTCC-3′,下游序列为5′-CATCCCAGCCTCCGTTATCC-3′,退火温度58℃,扩增产物448 bp。设置内参对照β-actin。β-actin引物上游序列为5′-GTAAAGACCTCTATGCCAACA-3′,下游序列为5′-GGACTCATCGTACTCCTGCT-3′,退火温度52.5℃,扩增产物227 bp。扩增产物采用1%琼脂糖凝胶、1∶ 20 000 GoldView显色、1%TAE电极缓冲液(180 V)电泳检测,BIO-RAD凝胶成像系统成像。Image软件测量光密度,取各因子相对光密度比值比较,相对光密度比值=该因子光密度值/β-actin光密度值。
1.8 Western blot检测脊髓VEGF、AKT、p-AKT、Bax、Bcl-2蛋白的表达 组织裂解、匀浆、静置、离心提蛋白,15%分离胶电泳、电转膜、10%脱脂奶粉4℃封闭过夜,孵育一抗鼠Anti-rat VEGF(1∶ 500,Chemicon)、兔Anti-AKT及抗磷酸化鼠Anti-rat p-AKT(1∶ 500,Cell signaling technology公司)、兔Anti-Bax及兔Anti-Bcl-2(1∶ 1 000,Cell signaling technology公司)摇床上孵育70 min,鼠Anti-rat β-actin(1∶ 2 000,Santa Cruz)蛋白作为内对照。洗膜后,室温下摇床上孵育goat anti-mouse IgG二抗(1∶ 5 000,Santa Cruz)70 min。增加化学发光(ECL)试剂盒显影曝光成像,Quantity one软件测光密度值,取各特异性蛋白条带光密度值与β-actin光密度值之比进行半定量分析。

2 结果
2.1 BMSCs培养及CD44、VEGF染色情况 接种第2天,细胞胞体呈圆形且贴壁不稳固,偶见数个细胞呈索形,长出短突起;4~5 d,细胞胞体呈索形或三角形,两端长出短突起;7 d,细胞基本覆盖满板底,胞体较前扁平,细胞形态、极性较一致,呈漩涡状生长(图1-A)。培养至第3代的BMSCs细胞形态、极性与7 d时的细胞保持一致。CD44免疫染色显示,棕黄色CD44免疫阳性产物广泛分布于细胞胞浆和突起,圆形或椭圆形胞核未着色,苏木素复染呈现淡蓝色(图1-B)。细胞胞浆和突起均见棕色VEGF免疫阳性产物,而胞核和核仁着色浅,苏木素复染呈现淡蓝色(图1-C)。

A:体外培养的BMSCs活细胞;B:BMSCs内CD44免疫阳性产物的分布;C:BMSCs内VEGF免疫阳性产物的分布
2.2 BBB评分 对照组和移植组大鼠BBB评分于术后0、4、8、14 d均显著低于假手术组(P<0.01);术后4、8、14 d,移植组BBB评分均较对照组高(P<0.01),且对照组和移植组组内不同时间点BBB评分随时间推移而增高(P<0.01)。见表1、图2。

表1 各组大鼠术后不同时刻BBB评分比较(n=8) 分
*与假手术组比较Ρ<0.01;△与对照组比较Ρ<0.01;▲与同组前一时间点比较Ρ<0.01

*与假手术组比较P<0.01;△与对照组比较P<0.01;▲与同组前一时间点比较P<0.01
图2各组大鼠术后不同时刻BBB评分
2.3 神经电生理检测 术后14 d,对照组和移植组较假手术组MEP、CSEP潜伏期延长(P<0.01),波幅减小(P<0.01);且这种变化在对照组更显著(P<0.01),移植组次之(P<0.01)。见图3、表2。
2.4 L1脊髓VEGF、AKT、Bax和Bcl-2 mRNA表达 术后14 d,与假手术组比,对照组和移植组AKT、Bax和Bcl-2 mRNA表达水平显著增加(P<0.01),且移植组VEGF mRNA表达亦增加(P<0.01)。与对照组比较,移植组仅Bax mRNA表达较减少(P<0.01),其余因子表达均增加(P<0.01)。见图4-A、表3。

图3 各组大鼠术后14 d行为电生理(n=8)


项目MEPCSEP潜伏期(ms)波幅(mV)潜伏期(ms)波幅(mV)假手术组4.74±0.182.97±0.134.30±0.184.35±0.13对照组8.52±0.38∗1.03±0.10∗9.78±0.26∗1.43±0.15∗移植组6.78±0.29∗△1.64±0.12∗△6.73±0.26∗△2.51±0.13∗△F值41.1473.84135.10117.60P值0.0000.0000.0000.000
*与假手术组比较P<0.01;△与对照组比较P<0.01
2.5 L2脊髓VEGF、AKT、p-AKT、Bax和Bcl-2蛋白的表达 术后14 d,各组大鼠L2脊髓均检测到VEGF、AKT、p-AKT、Bax和Bcl-2蛋白表达(图4-B)。除VEGF蛋白表达仅在移植组显著增加外(P<0.01),其余各蛋白在对照组和移植组的表达水平均较假手术组增加(P<0.01);而移植组仅Bax较对照组表达减少(P<0.01),其余各蛋白表达均增加(P<0.01)。见表4。
3 讨论
本课题组实验采用切断肾上腹主动脉的分支椎动脉、绑扎阻断肾下腹主动脉血流2 h后复通动脉恢复脊髓再灌注的方法制备SCIRI模型[6]。假手术组大鼠在术后各时间点BBB评分均介于20~21分,而对照组和移植组大鼠术后当天BBB评分几乎为0分,随着时间的推移,BBB评分逐渐增加,且移植组大鼠BBB评分达到4~11分,均高于对照组。在术后14 d,对照组和移植组大鼠较假手术组大鼠MEP和CSEP潜伏期明显延长、波幅显著减小,而这种变化在移植组有所缩小。说明本实验采用的SCIRI模型成功地呈现了大鼠的SCIRI,大鼠后肢出现了严重功能障碍,而肾下腹主动脉移植BMSCs能有效地促进损伤后大鼠后肢功能恢复。
BMSCs不仅具有干细胞的多向分化和自我更新的潜能,而且能经动静脉如颈内动脉、尾静脉等移植途径穿越血脑屏障向外伤性脑损伤病变部位迁移[9],大量表达和分泌神经营养因子与外源性神经营养因子一起共同发挥神经保护作用,而VEGF正是其中一员[10-11],本实验研究也证实体外培养的BMSCs能表达VEGF,且经肾下腹主动脉移植BMSCs后增加了SCIRI大鼠病灶脊髓局部VEGF基因和蛋白表达。VEGF是一种特异的促血管内皮生长和血管形成的多肽类蛋白,从促进血管基底膜分解及足体环的形成[12]、介导PI3K-AKT促进内皮细胞芽生[13]和调节新生血管网络的形成与重构[14-15]等方面参与到外伤、炎症及脑卒中后等缺血局部血管新生全过程[16]。但目前尚无VEGF在BMSCs移植治疗SCIRI中的作用研究的报道,结合本研究发现BMSCs移植促进了SCIRI大鼠脊髓内VEGF表达,进而推测BMSCs亦可能通过自分泌和(或)旁分泌VEGF方式参与损伤脊髓后血管和神经细胞的病理反应,促进血管内皮细胞的迁移、新生血管的形成,改善脊髓损伤局部微循环,间接地保护神经细胞免受缺血缺氧损伤,改善大鼠后肢功能。
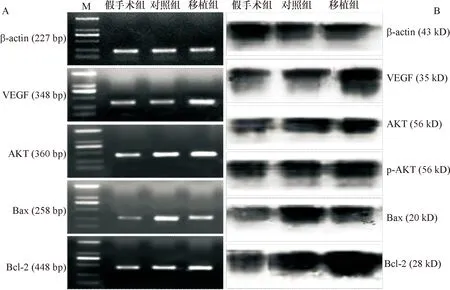
A:AKT、Bax、Bcl-2和VEGF mRNA在各组大鼠L1节段脊髓内的表达;M:Marker DL2000,条带从下往上依次为:100、250、500、750、1 000、2 000 bp;B:AKT、p-AKT、Bax、Bcl-2和VEGF蛋白在各组大鼠L2节段脊髓内的表达
图4VEGF、AKT、Bax及Bcl-2在各组大鼠脊髓中的表达


项目VEGFAKTBaxBcl-2假手术组1.13±0.081.25±0.090.93±0.091.09±0.10对照组1.26±0.11.57±0.10∗1.97±0.10∗1.43±0.11∗移植组1.94±0.11∗△2.05±0.10∗△1.46±0.11∗△1.97±0.11∗△F值19.9517.0026.6916.32P值0.0000.0000.0000.000
*与假手术组比较P<0.01;△与对照组比较P<0.01


项目VEGFAKTp-AKTBaxBcl-2假手术组1.19±0.071.29±0.061.34±0.100.95±0.061.19±0.09对照组1.38±0.061.55±0.07∗1.65±0.09∗1.95±0.06∗1.73±0.10∗移植组1.98±0.08∗△2.03±0.08∗△2.17±0.13∗△1.52±0.05∗△2.26±0.12∗△F值37.0226.6315.4575.9427.62P值0.0000.0000.0000.0000.000
*与假手术组比较P<0.01;△与对照组比较P<0.01
研究表明VEGF主要通过其下游PI3K(磷脂酰肌醇3激酶)/AKT(丝氨酸/苏氨酸蛋白激酶)信号转导通路在内皮细胞增殖、分化、凋亡方面发挥重要作用[17]。活化后的AKT即p-AKT通过抑制或激活下游靶蛋白Bax、Bcl-2等,发挥诱发细胞生长、促进细胞存活的生物学效应,实现促进脑缺血后血管内皮细胞增殖和阻止细胞凋亡发生[18],该信号转导通路在BMSCs移植治疗SCIRI中是否也发挥着生物学效应仍不得而知。本实验中BMSCs移植增加了SCIRI大鼠病灶脊髓内VEGF、AKT、p-AKT、Bcl-2基因和蛋白表达,而降低了Bax基因和蛋白表达,说明经肾下腹主动脉移植入SCIRI大鼠体内的BMSCs可能是通过VEGF介导PI3K/AKT途径,激活其下游靶蛋白Bcl-2和抑制下游靶蛋白Bax来促进血管内皮细胞增殖、分化和抗细胞凋亡的发生,从而促进病灶局部血管新生,改善局部微环境,进而促进SCIRI大鼠脊髓修复,实现后肢功能改善。但在本研究设计中并未涉及损伤脊髓局部血管内皮细胞和神经元细胞的增殖、分化、迁移以及局部新生血管形成的检测观察,尚缺乏BMSCs移植通过VEGF促进SCIRI大鼠缺血脊髓局部的神经微血管网络重构的直接证据,这将是本研究组下一步亟需解决的问题。
综上所述,肾下腹主动脉移植BMSCs通过增加脊髓损伤病灶局部VEGF的表达,进而介导其下游信号通路PI3K/AKT促进脊髓缺血再灌注损伤大鼠脊髓功能恢复。该研究成果将成为推动BMSCs动脉移植治疗SCIRI在临床应用的重要依据,同时也是进一步探讨其治疗机制的实验基础。
