不同预冷方式对鲜切紫甘蓝冷链贮运销品质变化的影响
2019-05-07许青莲王冉冉王丽邢亚阁李文秀杨华车振明
许青莲,王冉冉,2,王丽,邢亚阁*,李文秀,杨华,车振明
1(西华大学 食品与生物工程学院,四川 成都,610039) 2(重庆第二师范学院,重庆市功能性食品协同创新中心,重庆,400067)
紫甘蓝(BrassicaoleraceaL.),又称作紫包菜、红甘蓝,属十字花科芸薹属植物[1],是变种的芸苔属植物甘蓝。紫甘蓝产量高,结球紧实,价格较低,易储藏和运输,抗病虫能力强,现作为一种可食用蔬菜在国内大范围种植,是一种广受欢迎的鲜切蔬菜[2-3]。紫甘蓝因其具有鲜艳的色泽,色素含量高、营养价值高,无毒、安全等特点,成为研究热点。研究表明[4-5],紫甘蓝具有强的抗肿瘤、抗氧化、抗突变、抗炎等活性,极具保健价值。紫甘蓝被世界卫生组织(WHO)推荐为排名第三可食用最佳蔬菜,在抗癌方面排名第五。紫甘蓝属低热量高纤维食物,具有丰富的叶酸,肥胖者及孕妇均可食用[6]。
预冷技术是指在鲜切果蔬进行运输或加工前对其快速去除田间热和呼吸热,这种处理降低了生化和微生物变化的速度,从而延长了储存期[7],以保持其商品价值和营养价值[8]。预冷是果蔬保鲜处理的第一步且是必不可少的保鲜环节,最好在原产地对果蔬进行预冷处理,尤其在高温季节,能有效维持果蔬贮藏期间货架期品质[9]。果蔬在采收后,如果没有及时进行低温处理,将会直接影响其贮藏时期的营养品质、组织结构以及货架期长短。预冷方式主要包括真空预冷、冰水预冷、冷库预冷、压差预冷和强制通风预冷等。真空预冷的原理是产品的部分水分在低压下快速蒸发时吸热降温,相对传统预冷方式具有冷却速度快及冷却均匀的特点[8];冰水预冷是将果蔬放入冰水混合物进行预冷;冷库预冷依靠冷风机吹出的冷风进行预冷;压差预冷利用压差风机在开孔包装箱的两侧产生压力差,使得冷空气强制从包装箱内部通过与果蔬接触换热的一种冷却方式[10];强制通风预冷是将果蔬置于低温冷空气中,低温冷空气掠过果蔬表面,与其进行热质交换,带走果蔬内部的热量,降低其温度[11]。
HAN等[7]研究表明,桑葚经过强制通风预冷结合臭氧处理后具有较高的可滴定酸度和可溶性固形物含量,较好的硬度和色泽保存率,较低的腐烂率、呼吸强度和多酚氧化酶活性。YAN等[12]发现强制通风预冷处理减缓了贮藏期间杏的可滴定酸和可溶性固形物的下降,但对pH值和L*值没有影响。结果表明,预冷处理可以提高杏的抗氧化活性,从而保持杏的品质。廖彩虎等[13]发现真空预冷对鲜切莲藕的降温速率几乎为冷库预冷速率的10倍。随着真空预冷恒压时间的延迟,其水分损失呈增加的趋势,真空预冷至5 ℃并维持2、4、6 min所获得的理化、生化及营养指标值较对照组而言更接近新鲜莲藕。其中,真空预冷至5 ℃并维持4 min效果最佳。王伟锋[14]比较冷库预冷、强制通风预冷、水预冷和压差预冷对番茄的冷却时间、冷却均匀度和失重率的影响,发现压差预冷和水预冷是较理想的方法。尽管水预冷不存在失重率,但考虑到水预冷会使果蔬表面残留水分,往往会滋生细菌和腐烂,另外冷水中加入的一些杀菌剂会带来果蔬的二次污染,故最终选择压差预冷作为番茄的预冷处理方式。
蔬菜冷链物流可实现从“田间采收到餐桌前”始终处于适宜的低温环境下无断链,最大限度地维持其营养价值,在果蔬行业已经广泛应用,但在鲜切紫甘蓝上的应用还未见报道。鉴于此,本研究以高原特色蔬菜紫甘蓝为研究对象,通过测定不同预冷处理后的紫甘蓝温度变化以及冷链贮运销期间鲜切紫甘蓝褐变度、花青素、呼吸强度、POD、PPO、感官综合评分、MDA、可溶性固形物、可滴定酸和微生物(菌落总数、大肠菌群),比较冰水预冷、冷库预冷、压差预冷与强制通风预冷4种预冷方式对紫甘蓝冷链贮运销品质的影响,为压差预冷在果蔬采后保鲜上的应用提供参考。
1 材料与方法
1.1 材料与试剂
紫甘蓝、泡沫箱(外尺寸:450 mm×295 mm×260 mm,δ 20 mm),四川省绿茵农业开发有限公司阿坝州分公司;Ar和N2,四川侨源气体股份有限公司;聚乙烯(PE)包装材料(15 cm×25 cm,δ 0.06 mm),上海浦帝包装材料有限公司;聚乙烯(PE)、尼龙(PA)(15 cm×25 cm,δ 0.06 mm)共挤膜包装材料,上海锦蕊新材料科技有限公司;多层瓦楞纸板(40 cm×25 cm,5层BC瓦楞,δ 5.5~6.0 mm),合肥世成包装有限公司;冰水混合物实验室自制。
乳酸钙(食品级),青岛九泰生物科技有限公司;无水柠檬酸(食品级),河南蜜丹儿商贸有限公司;抗坏血酸(食品级),河北维尔康制药有限公司;半胱氨酸(食品级),万利达食化有限公司;营养琼脂和乳糖胆盐培养基,北京奥博星生物技术有限责任公司;次氯酸钠、硫代巴比妥酸、聚乙烯吡咯烷酮、愈创木酚和邻苯二酚,分析纯,成都市科龙试剂有限公司。
1.2 主要仪器设备
离心机(TDL-40B),湖南星科科学仪器有限公司;分光光度计(22s),尤尼柯(上海)仪器有限公司;便携式果蔬呼吸测定仪(JZ-3150H),北京九州空间科贸有限公司;模拟汽车运输振动试验机(TF-601A),北京市兴光测色仪器公司;外转子轴流风机(自制压差预冷机)(YWF4E-400),上海华坚科技有限公司;真空充气包装机(DZ-580A),诸城市舜康包装机械有限公司;阿贝折光仪(WYA),上海精密科学仪器有限公司;电导率仪(DDS-11A+),成都世纪方舟科技有限公司;电热恒温培养箱(DHP-9082),上海齐欣科学仪器有限公司。
1.3 试验方法
试验操作流程如图1所示,具体如下:在4 ℃条件下对采后紫甘蓝进行不同方式预冷,用100 mg/L次氯酸钠溶液将其浸泡5 min,然后用去离子无菌水冲洗,室温下放置沥干。去除根蒂,然后将可食部位切分成40 mm×10 mm大小,接着用组成成分为1.0%乳酸钙+2.0%柠檬酸+1.0%抗坏血酸+0.5%半胱氨酸+100 mg/L次氯酸钠护色浸渍剂浸泡2.0 min,再用无菌水清洗,随后将护色浸渍后的鲜切紫甘蓝以110×g4 ℃下离心1 min。再进行6种预冷处理方式,处理1:进行空白处理(对照);处理2:无预冷处理;处理3:冰水预冷(冰水混合物温度为0 ℃,用量为1∶10);处理4:冷库预冷(冷库温度为4 ℃);处理5:压差预冷(功率180 W,转速1 400 r/min,风量4 200 m3/hr,4 ℃);处理6:强制通风预冷(4 ℃)。将预冷处理后的鲜切紫甘蓝放入正反高压反应釜中,密封,抽真空后,100 s加压速率通入惰性气体Ar,进行1.0 MPa,保压60 min加压处理,最后以150 s的速率撤压。然后在4 ℃冷藏条件下,采用PE/PA复合包装材料进行Ar气调包装,100 g/袋,每个处理6袋,共计36袋。采用泡沫箱+多层瓦楞纸板减震方式运输,放置全自动模拟公路运输振荡仪(速率:200 r/min)模拟24 h公路运输;最后摆放于0 ℃的冷库展示架上模拟销售。测定预冷后的紫甘蓝温度变化以及冷链贮运销期间鲜切紫甘蓝褐变度、花青素、呼吸强度、POD、PPO、感官综合评分、MDA、可溶性固形物、可滴定酸和微生物(菌落总数、大肠菌群),在20 d的贮藏周期内,每4 d测定1次。
1.4 指标测定
1.4.1 温度的测定
将针形温度探头的感温部位垂直插入紫甘蓝球中心位置,采用温度记录仪连续记录肉质茎温度变化。2 h测定范围内,测定频率为5 min/次[15]。
1.4.2 褐变度的测定
取样品5 g,加入95%乙醇15 mL,研磨均匀,2 000 r/min离心15 min,取上清液于420 nm处测定吸光度A,即为样品褐变度[16]。
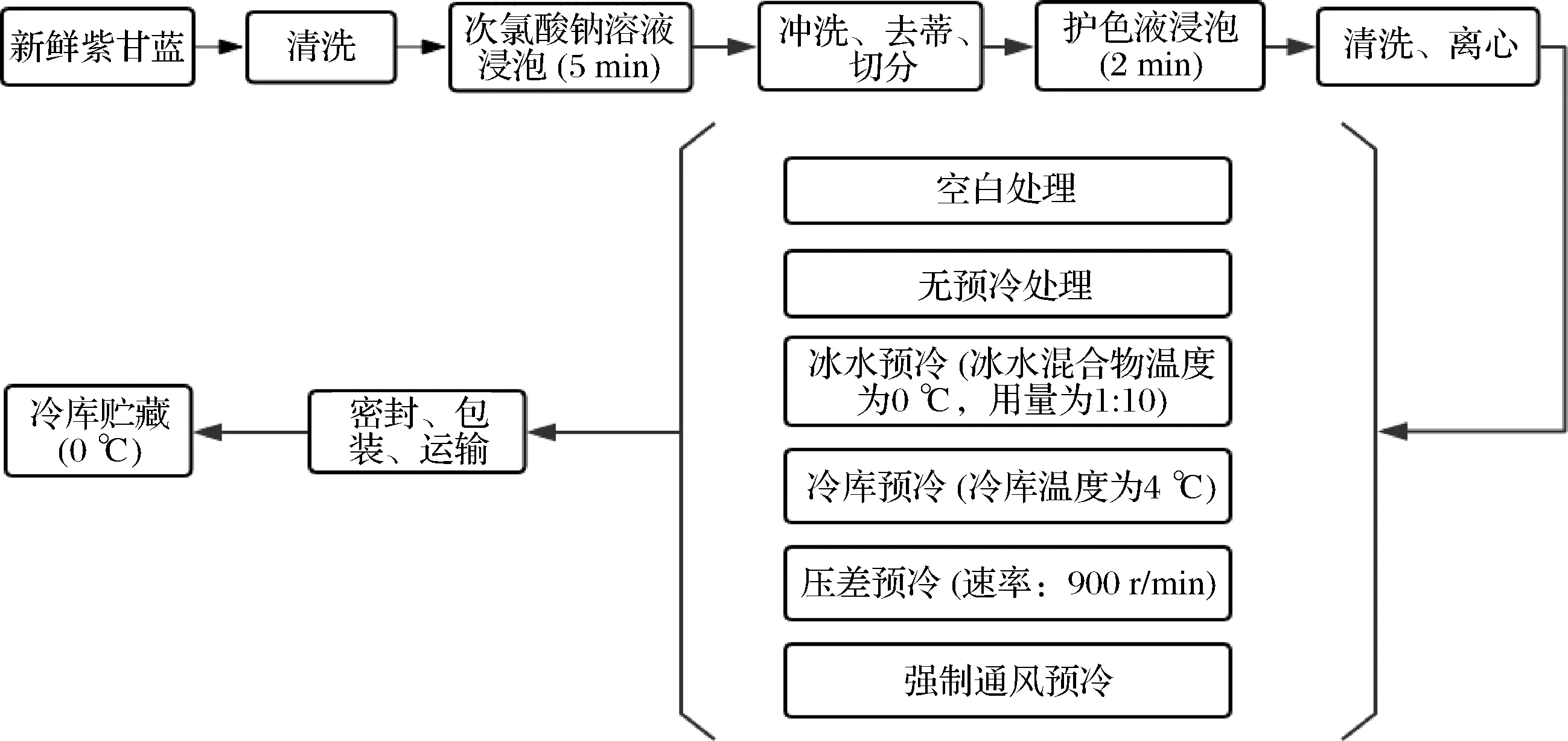
图1 鲜切紫甘蓝冷链贮运销流程图
Fig.1 Flow chart of fresh-cut purple cabbage during cold-chain transportation
1.4.3 花青素的测定
分别吸取样品提取液1 mL至2个10 mL容量瓶中,然后用pH值1.0和pH值4.5的缓冲液分别定容,平衡后,分别在510 nm和700 nm处测定吸光值。测定3次,求平均值[17]。花青素含量计算公式如下:
花青素含量/(mg/100g)=(A×MW×DF×V)×100/(ε×L×W)
(1)
式中:A为吸光系数,A=(A510-A700)pH1.0-(A510-A700)pH 4.5;MW为矢车菊花素-3-葡萄糖苷的分子量,449.2;DF为稀释因子;V为最终体积,mL;ε为矢车菊花素-3-葡萄糖苷的消光系数,26 900;L为光程,1 cm;W为样品质量,mg。
1.4.4 呼吸强度的测定
利用呼吸强度测定仪,测定样品中CO2浓度,如公式(2)所示[18]:
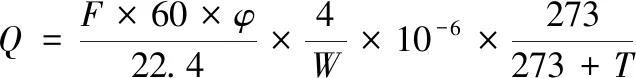
(2)
式中:Q,呼吸强度,[mg(CO2/(kg·h)];F,气体流速,mL/min;φ,CO2体积分数,μL/L;W,样品质量,kg;T,测定温度,℃。
1.4.5 感官综合评分
感官评定方法:挑选6名经过感官评定培训的天津科技大学专业人员,目测鲜切紫甘蓝表面性状,进行感官评分(1~9分),9分:切面有正常鲜样光泽,无任何褐变和水渍状;7分:切面有轻微褐变但肉眼不易辨;5分:切面褐变较深,有轻微水渍;3分:切面大面积褐变且呈水渍状;1分:腐烂变质,不具任何食用价值[19]。
1.4.6 POD的测定
(1) POD粗酶液提取:取样20 g,加入40 mL预冷至4 ℃的0.2 mol/L,pH值5.0的磷酸缓冲溶液,加入2 g聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)于研钵中,快速冰浴研磨成匀浆,然后加入磷酸缓冲溶液,4 ℃下浸提4 h,然后4 ℃下5 000 r/min离心30 min,取上清液备用。
(2) POD活性采用消光值法测定[20]。取0.1 mol/L,pH值5.0的缓冲液(同上)2.8 mL,加入20 mmol/L过氧化氢和75 mmol/L愈创木酚各1 mL,随即加入0.2 mL粗酶液并快速摇匀,空白液以蒸馏水代替原酶液,每隔5 s于470 nm处测定其吸光度并记录,测定2 min,最后计算酶活力。每毫升酶液每分钟使吸光值增加0.001为1个酶活力单位(U)。相对酶活的计算:在测定条件下,以酶活性的最高值作为100%。
1.4.7 PPO的测定
(1) PPO粗酶液的提取:取样10 g,加入20 mL 0.1 mol/L pH值6.8的磷酸缓冲液、2%聚乙烯吡咯烷酮(PVP),冰浴条件下研磨成匀浆。4 ℃下浸提4 h,于4 ℃下4 000 r/min离心15 min,取上清液备用。
(2) PPO活性采用邻苯二酚法测定[20]。取pH值6.8磷酸缓冲液2.8 mL,0.2 mol/L邻苯二酚溶液2 mL,再迅速加入粗酶液0.2 mL,空白液以蒸馏水代替原酶液,每隔5 s在412 nm处比色测定吸光度并记录,测定2 min,最后计算酶活力。每毫升酶液每分钟使吸光值增加0.001为1个酶活力单位(U)。相对酶活的计算,同上。
1.4.8 丙二醛(MDA)的测定
采用硫代巴比妥酸(thiobarbituric acid, TBA)的方法进行测定,精确称取5 g样品,加入50 mL质量浓度为100 g/L的三氯乙酸均质,然后4 ℃下,4 000 r/min离心10 min,取2 mL上清液和2 mL 0.6%的TBA溶液,混匀后,沸水浴15 min,用冷水将溶液温度迅速降至室温,然后4 ℃下,5 000×g离心10 min。分别在532 nm和600 nm处测定上清液的吸光率[21]。
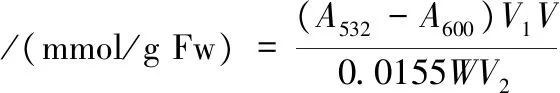
(3)
式中:A532和A600分别为532 nm和600 nm处吸光度;V1为反应后溶液的总体积;V为抽提液的总体积;V2为提取液的体积;W为样品的质量。
1.4.9 可溶性固形物的测定
参照姜国哲等[22]的方法,采用阿贝折光仪测定法。
1.4.10 可滴定酸的测定
(1)样品提取液制备用四分法,取可食部分切碎,称取250 g放入高速组织捣碎机内,加入等量水,捣碎1~2 min。称取匀浆50 g,用100 mL蒸馏水洗入250 mL容量瓶,置75~80 ℃水浴上加热30 min,期间摇动数次,取出冷却,定容,摇匀过滤。
(2)根据预测酸度,用移液管吸取50 mL样液,加入酚酞指示剂5~10滴,用NaOH标准溶液滴定,至出现微红色且30 s内不退色为终点,记下所消耗的体积。
试样的可滴定酸度以某种酸的百分含量表示,按公式(3)计算[23]:
(4)
式中:k为换算为某种酸酸度的系数。
1.4.11 微生物的测定
菌落总数的测定采用平板计数法,大肠菌群的测定采用MPN计数法[24]。
1.5 数据处理
采用SPSS 19软件对数据进行统计分析,各项指标结果以“平均数(n=3)±标准偏差”表示,采用S-N-K法进行差异显著性分析(P<0.05),图表中标注不同字母的数据表示数据间具有显著性差异(P<0.05);采用Origin 8.6软件作图。
2 结果与分析
2.1 不同预冷方式对鲜切紫甘蓝冷链贮运销期间温度变化的影响
由图2-A可知,不同预冷方式降温速率差异较为明显,压差预冷仅用35 min将紫甘蓝降温至4 ℃,而强制通风预冷、冰水预冷、冷库预冷分别需要55、75和100 min。压差预冷速度分别是强制通风预冷、冰水预冷和冷库预冷的1.6倍、2.1倍和2.9倍。许俊齐等[25]的研究与该结论一致。由图2-B可知,不同预冷处理后的鲜切紫甘蓝在冷链贮运销期间温度逐渐回升,压差预冷处理下的鲜切紫甘蓝温度回升到初始状态需170 min,而冷库预冷仅45 min就回升到初始温度。回温速率:冰水预冷>冷库预冷>强制通风预冷>压差预冷,压差预冷保温效果最好,可更长时间保持鲜切紫甘蓝的低温状态。

A-不同预冷方式对鲜切紫甘蓝降温速率的影响;B-不同预冷方式对鲜切紫甘蓝回温速率的影响图2 不同预冷方式对紫甘蓝预冷效果及冷链贮运销期间鲜切紫甘蓝温度变化的影响
Fig.2 Effects of different pre-cooling treatments on pre-cooling effects and temperature change of fresh-cut purple cabbage during cold-chain transportation
2.2 不同预冷方式对鲜切紫甘蓝冷链贮运销期间褐变度的影响
由图3可知,贮藏0 d时,各组鲜切紫甘蓝褐变度处于0.134~0.255,在贮藏周期内,冷链贮运销过程中的鲜切紫甘蓝褐变度呈上升趋势;其中,预冷处理组褐变度上升趋势较为平缓,而空白组(1号处理组)和2号处理组在贮藏12 d后褐变度急剧上升。贮藏期间,与空白组和无预冷处理组样品相比,预冷处理组褐变度较低;贮藏结束后,对照组和无预冷处理组鲜切紫甘蓝褐变度较高,分别为1.375和1.155,压差预冷处理组鲜切紫甘蓝褐变度最低,为0.457,仅为对照组和无预冷处理组的33.2%和39.6%。这说明压差预冷处理能有效抑制鲜切紫甘蓝冷链贮运销期间褐变度的上升。郁志芳等[26]研究压差预冷可有效抑制贮藏期间鲜切莲藕褐变度的增长。另外,预冷处理能降低切分激发的细胞酶活上升,减少酶促褐变的发生[27]。
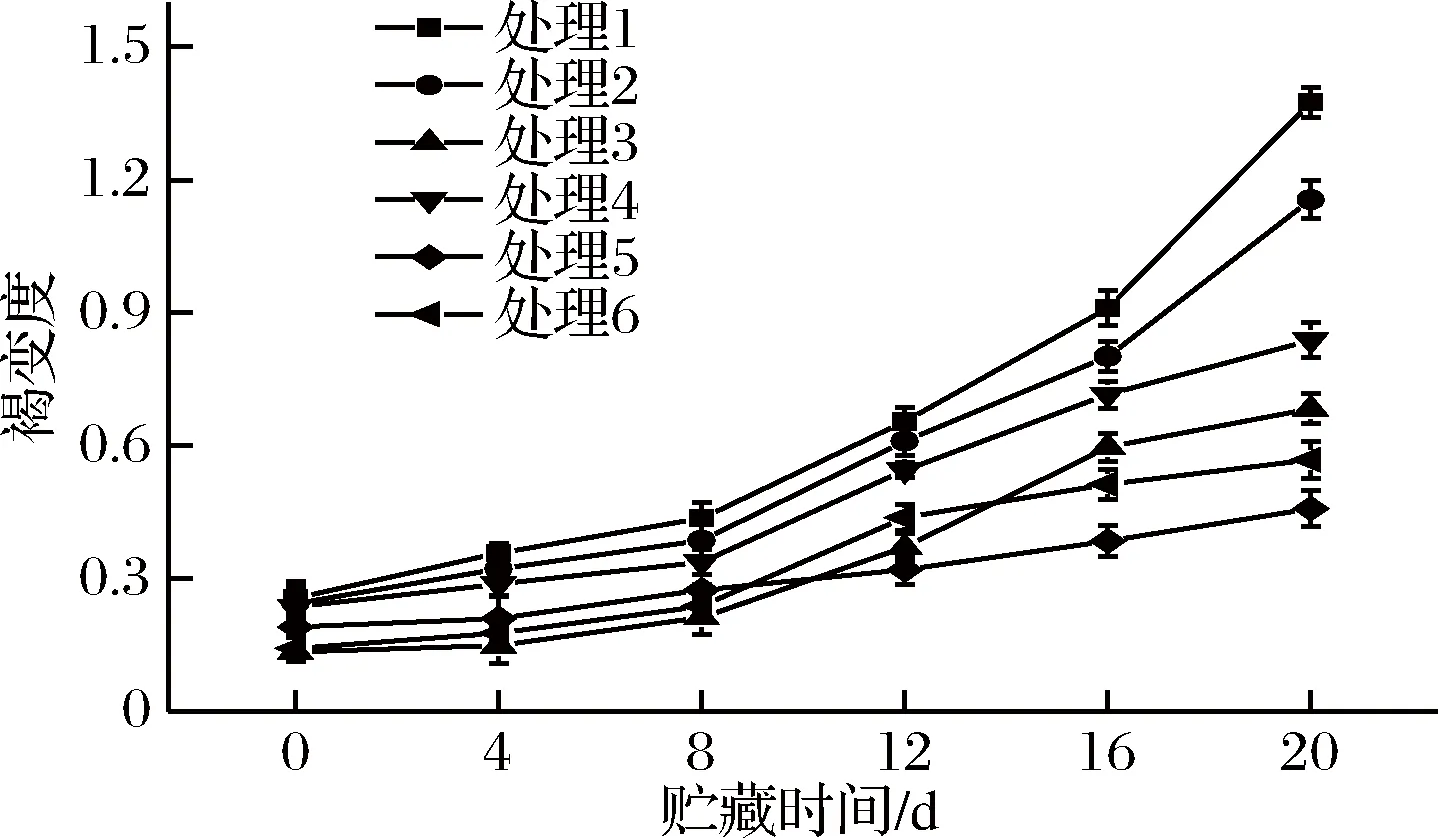
处理1-对照;处理2-无预冷处理;处理3-冰水预冷;处理4-冷库预冷;处理5-压差预冷;处理6-强制通风预冷,下同。图3 不同预冷方式对鲜切紫甘蓝冷链贮运销期间褐变度的影响
Fig.3 Effects of different treatments of pre-cooling on browning degree of fresh-cut purple cabbage during cold-chain transportation
2.3 不同预冷方式对鲜切紫甘蓝冷链贮运销期间花青素的影响
从图4可知,贮藏0 d时,各组花青素含量相差不大。各组鲜切紫甘蓝花青素随着贮藏时间的延长不断下降,且5号和6号处理组花青素下降趋势不明显,且其花青素的含量始终大于其他处理组,在贮藏8 d后1号、2号、3号和4号处理组花青素急剧下降。贮藏20 d后,5号处理组鲜切紫甘蓝花青素含量最高,为4.09 mg/L,与贮藏0 d时相比,仅下降17.0%;1号处理组样品花青素含量最低,仅为1.54 mg/L。压差预冷处理能有效抑制冷链贮运销期间鲜切紫甘蓝花青素的降解。
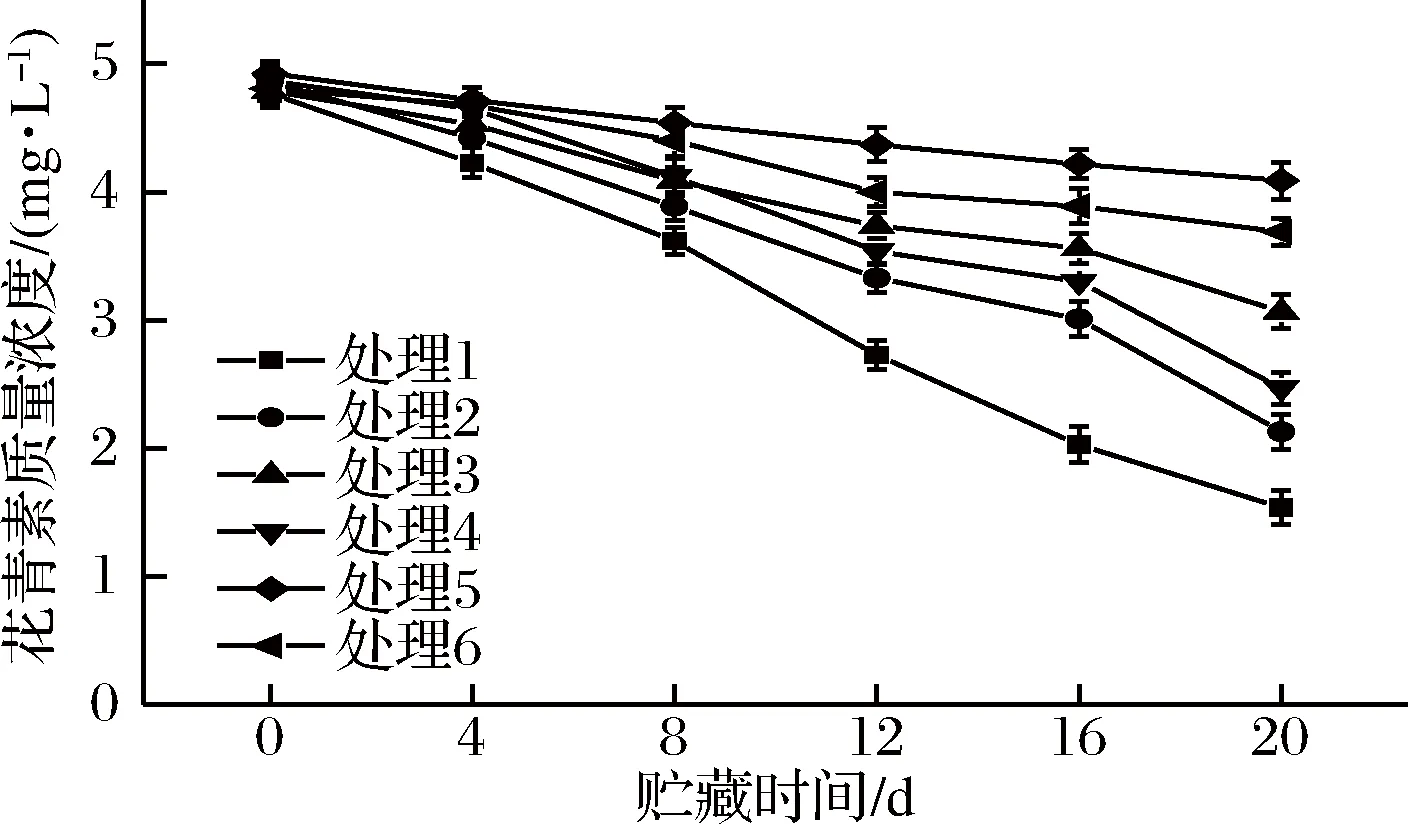
图4 不同预冷方式对鲜切紫甘蓝冷链贮运销期间花青素的影响
Fig.4 Effects of different treatments of pre-cooling on anthocyanin of fresh-cut purple cabbage during cold-chain transportation
预冷处理尤其是压差预冷可迅速将样品中心温度降到所需贮藏温度,降低鲜切果蔬组织细胞中氧化酶的活性,降低细胞内代谢活动,降低鲜切果蔬贮藏期间花青素的分解,抑制鲜切果蔬的劣变程度[28]。
2.4 不同预冷方式对鲜切紫甘蓝冷链贮运销期间呼吸强度的影响
图5表明各组鲜切紫甘蓝呼吸强度呈现出先增加后减少趋势,其中,3号处理组样品的呼吸强度变化有波动性。贮藏开始时,各组的呼吸强度差异较为明显,处于5.92~7.92 mg CO2/(kg·h)范围内。在整个贮藏期内,预冷处理组的呼吸强度始终低于1号和2号处理组,在贮藏第4天时,各组的鲜切紫甘蓝呼吸强度达到最大值。贮藏结束后,5号处理组鲜切紫甘蓝呼吸强度最低,仅为5.09 mgCO2/(kg·h),1号处理组呼吸强度最高,为6.72 mgCO2/(kg·h)。因此,压差预冷可有效抑制鲜切紫甘蓝冷链贮运销期间呼吸代谢。预冷处理可迅速除去田间热和减少呼吸热,抑制果蔬呼吸代谢相关酶,确保货架期品质[9]。

图5 不同预冷方式对鲜切紫甘蓝冷链贮运销期间呼吸强度的影响
Fig.5 Effects of different treatments of pre-cooling on respiratory strength of fresh-cut purple cabbage during cold-chain transportation
2.5 不同预冷方式对鲜切紫甘蓝冷链贮运销期间酶类(POD和PPO)的影响
POD与植物组织发生褐变密切相关,它可使酚类物质发生氧化,形成黑褐色物质,最终导致褐变[29]。由表1可知,随着冷链贮运销的不断进行,POD活性不断增加。贮藏开始时,1,2和4号处理组POD活性差异不显著(P>0.05),3、5和6号处理组POD活性差异不显著(P>0.05);贮藏10 d后,预冷处理组与1和2号处理组差异较为显著(P<0.05)。贮藏结束后,各组样品POD活性差异较为显著(P<0.05),其中,5号处理组样品POD活性最小,仅为6.14 U/(g·min),且与其他处理组相比差异较为显著(P<0.05)。以上说明,压差预冷可有效抑制鲜切紫甘蓝贮藏期间POD活性。
酚类物质在PPO诱导下氧化是造成鲜切果蔬表面褐变的主要原因之一[29]。如表1所示,鲜切紫甘蓝总酚活性随着贮藏时间延长不断增大。贮藏初期,各组间的PPO活性差异较为显著(P<0.05);与其他处理组相比,5号处理组样品的PPO活性均最低。贮藏10 d时,预冷处理组样品PPO活性明显低于1号和2号处理组,抑制酶活效果:5>6>3>4>2>1。贮藏20 d,5号处理组样品的PPO活性最低,仅为11.9 U/(g·min),1号处理组样品PPO活性最高,为22.4 U/(g·min)。
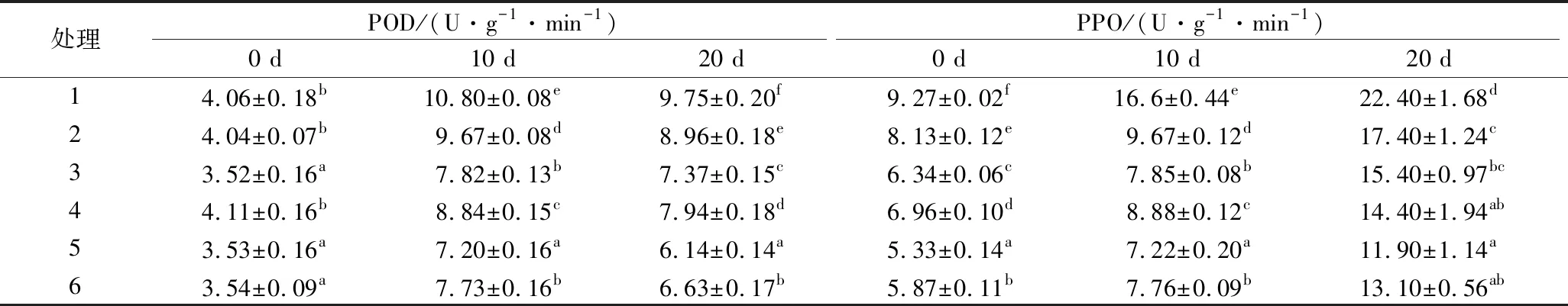
表1 不同预冷方式对鲜切紫甘蓝冷链贮运销期间POD和PPO的影响
注:数据为平均值±标准偏差(n=3);在同一列中,不同字母表示数据间具有显著性差异(P<0.05)。下同。
2.6 不同预冷方式对鲜切紫甘蓝冷链贮运销期间感官综合评分的影响
感官品质决定了产品外观色泽,会直接影响到产品的食用价值和经济价值[30-31]。由图6可知,随着鲜切紫甘蓝冷链贮运销的进行,样品的感官综合评分呈现出明显地下降趋势。贮藏到第12 天时,1号和2号处理组的鲜切紫甘蓝感官综合评分已经降至3.1分和4.4分,均已超出NY/T 1987—2011[32]行业标准中符合该品种的质地、色泽和风味以及不萎蔫的要求。贮藏结束后,5号处理组样品的感官综合评分最高,为6.1分,仍然维持在规定的商品价值以上,6号处理组感官综合评分次之,为5.3分。因此,压差预冷处理可良好地保持鲜切紫甘蓝感官品质,延长冷链贮运销货架期。
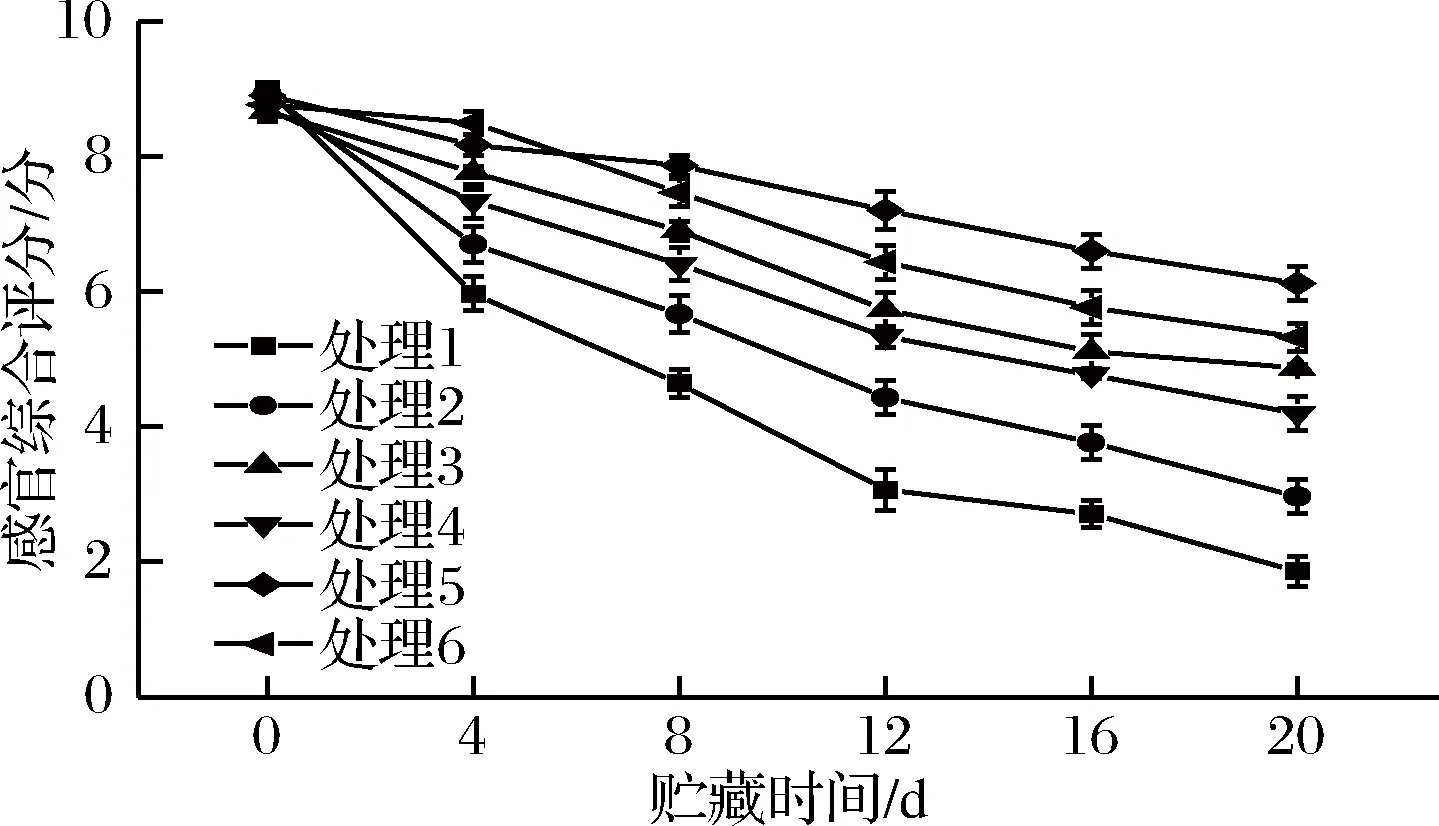
图6 不同预冷方式对鲜切紫甘蓝冷链贮运销期间感官综合评分的影响
Fig.6 Effects of different treatments of pre-cooling on sensory evaluation of fresh-cut purple cabbage during cold-chain transportation
2.7 不同预冷方式对鲜切紫甘蓝冷链贮运销期间MDA的影响
丙二醛(MDA)含量的多少可表征鲜切果蔬细胞膜膜脂氧化状态,且两者之间呈正比[31]。鲜切紫甘蓝MDA含量随时间的增加而呈明显上升趋势(图7);预冷处理组样品MDA上升趋势相对平缓。贮藏初期,各组样品的MDA含量较低且差异不明显。贮藏结束后,5号处理组样品具有最低的MDA含量,仅为3.09 mmol/g FW;1号处理组MDA含量最高,为5.52 mmol/g FW,与开始贮藏时相比,上升了311.9%。预冷处理能有效抑制鲜切紫甘蓝冷链贮运销期间的MDA增长,压差预冷效果最佳。预冷处理可抑制膜脂氧化酶对细胞膜酶解,保持细胞膜完整性及膜透性,减少鲜切果蔬内MDA的分解[33]。
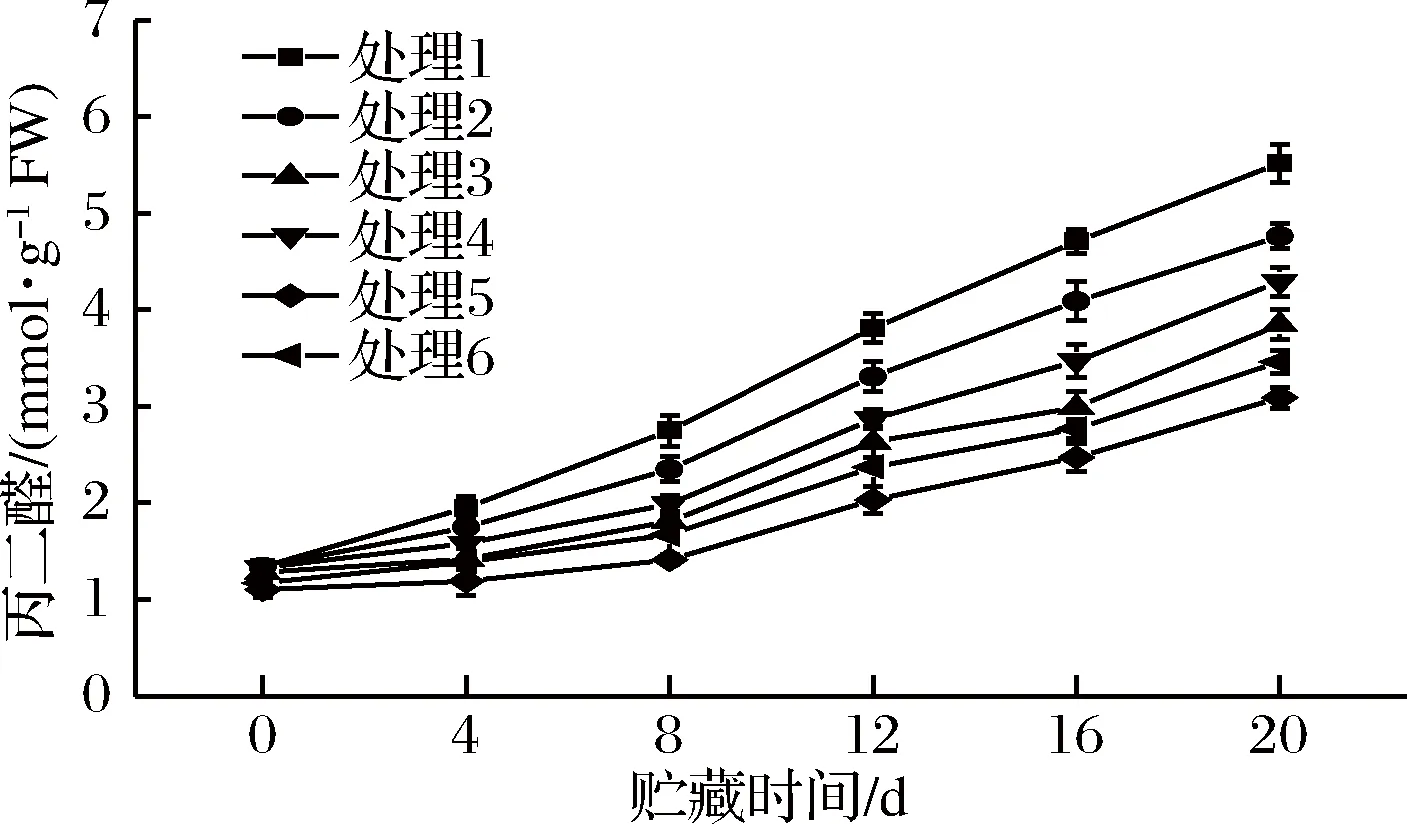
图7 不同预冷方式对鲜切紫甘蓝冷链贮运销期间MDA的影响
Fig.7 Effects of different treatments of pre-cooling on MDA of fresh-cut purple cabbage during cold-chain transportation
2.8 不同预冷方式对鲜切紫甘蓝冷链贮运销期间可滴定酸和可溶性固形物的影响
可滴定酸含量可反映鲜切果蔬呼吸强度的高低,可作为呼吸的底物被逐渐降解[34]。从表2可看出,在贮藏周期内,各处理组样品可滴定酸含量均呈现出不断减少趋势。各组样品的可滴定酸含量在贮藏初期差异不大,但在贮藏结束后差异显著(P<0.05)。贮藏20 d后,预冷处理组可滴定酸含量高于对照组,其中,压差预冷处理组可滴定酸含量最高,为0.059 8%,与贮藏开始时相比仅下降25.0%。综上,压差预冷处理可有效抑制冷链贮运销期间鲜切紫甘蓝可滴定酸的分解。陈文烜等[35]研究快速预冷可有效抑制呼吸强度,抑制膜脂过氧化酶活性,减少对可滴定酸的降解。
可溶性固形物含量会直接影响果蔬细胞渗透压,且两者呈正比,进一步对果蔬水分产生影响。如表2所示,各组样品可溶性固形物含量随着冷链贮运销时间的延长而不断下降。贮藏初期,各组样品可溶性固形物含量差异不显著(P>0.05),均处于17.55%~18.02%。贮藏10 d和20 d时,各组样品之间可溶性固形物差异较为显著(P<0.05),且5号处理组样品的可溶性固形物含量均最高,分别为13.51%和8.53%。即为压差预冷处理抑制鲜切紫甘蓝冷链贮运销期间可溶性固形物降解效果最佳。张沙沙等[36]研究预冷处理可有效抑制冷链贮运销期间鲜切紫甘蓝呼吸代谢,可有效减少可溶性固形物的降解。

表2 不同预冷方式对鲜切紫甘蓝冷链贮运销期间可滴定酸和可溶性固形物的影响
2.9 不同预冷方式对鲜切紫甘蓝冷链贮运销期间微生物的影响
切分造成的机械损伤,破坏了果蔬的防御系统,同时也增加了与微生物的接触;另外,致使鲜切果蔬汁液外渗,进而给微生物提供了有利的繁殖条件[26]。在冷链贮运销期间,鲜切紫甘蓝表面微生物不断增加。如表3所示,贮藏初期,鲜切紫甘蓝菌落总数均保持较低的水平,预冷处理组(除4号外)与空白组、对照组菌落总数差异显著(P<0.05);各组均检测不到大肠菌群。贮藏结束后,空白处理组与其他处理组相比,菌落总数和大肠菌群均差异显著(P<0.05),而预冷处理组间菌落总数差异不显著(P>0.05)。贮藏20 d后,压差预冷处理组样品中菌落总数和大肠菌群最少,分别为2.10×103CFU/g和0.57 MPN/g,1号处理组样品菌落总数和大肠菌群最多,分别为8.60×104CFU/g和2.10 MPN/g。按照GB 4789.23[37]中规定的鲜切蔬菜的微生物指标,细菌菌落总数≤5.00×104CFU/g,大肠菌群≤1.50 MPN/g,致病菌不得检出,1号(CK)处理组鲜切紫甘蓝内菌落和大肠菌群均已超出安全范围。

表3 不同预冷方式对鲜切紫甘蓝冷链贮运销期间菌落总数和大肠菌群的影响
3 结论
综上所述,4种不同预冷方式的预冷速率:压差预冷>强制通风预冷>冰水预冷>冷库预冷,回温速率:冰水预冷>冷库预冷>强制通风预冷>压差预冷,压差预冷速率最快,仅用35 min;可更长时间保持鲜切紫甘蓝的低温状态,回升至初温需170 min。相比于对照处理和无预冷处理组,预冷处理能有效地抑制鲜切紫甘蓝的褐变、呼吸作用以及POD、PPO活性,可明显地抑制鲜切紫甘蓝花青素、可溶性固形物和可滴定酸在贮藏期间的下降,有效延缓MDA含量、菌落总数和大肠菌群的增长。
预冷是保持蔬菜感官品质和营养价值的重要环节之一,真空预冷和压差预冷均具有降温速度快、保温效果好、冷却均匀和无污染等优点[25]。本文试验结果表明,压差预冷处理能使鲜切紫甘蓝在大约40 min内降至4 ℃,且能维持较好的感官品质。吴欣蔚等[8]研究发现真空预冷可以实现结球甘蓝在25 min以内降至4 ℃。两者处理存在的差异性在于样品不同,一种为整株蔬菜,一种为鲜切蔬菜。付艳武等[38]认为真空预冷一般适于单位质量表面积大的蔬菜类,温度每下降10 ℃,产品的水分会损失1.7%,会影响叶菜类的新鲜度。更重要的是真空预冷装置的投资和运转费用较高,不利于推广和工业大规模生产。而压差预冷适用于各种果蔬,投资成本远低于真空预冷,故压差预冷是鲜切紫甘蓝冷链贮运销期间较适宜的预冷方式。
