解脂亚罗酵母对棒曲霉素降解条件的筛选及部分机理研究
2019-05-07胡慧敏宗元元王振宇张国军毕阳
胡慧敏,宗元元,王振宇,张国军,毕阳
(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)
棒曲霉素(patulin, Pat),也称展青霉素,是由青霉属、曲霉属和丝衣霉等真菌产生的毒素[1]。Pat在苹果、梨、葡萄等多种水果及其制品中普遍存在[2],可导致肺、肝、脾和肾等多种器官和免疫系统的损害,紊乱胃肠功能[3-4]。Pat易溶于水,热稳定性高,在加工中难以去除。因此,有效去除水果及其制品中的Pat是当前水果产业发展中亟待解决的问题。生物脱毒是利用酵母菌等微生物去除真菌毒素的有效方法,具有毒副作用小、反应条件温和及环境友好的特点[5]。REDDY等[6]采用2株美极梅奇酵母(Metschnikowiapulcherrima) (MACH1和GS9)有效降解了Pat,其中菌株MACH1可在48 h内实现完全降解。RAFFAELLO等[7]发现,红冬孢酵母(Rhodosporidiumkratochvilovae) strain LS11可在3 d内几乎完全降解了Pat。此外,奥默毕赤酵母(Pichiaohmeri)[8]和酿酒酵母(Saccharomycescerevisiae)[9]也表现出对Pat的良好降解效果。解脂亚罗酵母(Yarrowialipolytica)是广泛存在于海洋环境中的酵母菌[10],也是公认安全的酵母[11]。王峻峻等[12]发现,Y.lipolytica可在28 ℃条件下,2 d内降解84%的赭曲霉毒素A。表明该酵母具有降解真菌毒素的能力。但该酵母是否降解Pat尚未见报道。
本研究以Y.lipolytica为材料,研究不同浓度Pat对酵母生长的影响,以及Y.lipolytica对不同初始浓度Pat的去除效果。对pH值、温度及酵母初始浓度等脱毒条件进行筛选,并初步探讨酵母的解毒机制。
1 材料与方法
1.1 材料
Y.lipolytica冻干粉,中国工业微生物菌种保藏管理中心(CICC 1444)。Pat标准品,青岛普瑞邦生物工程有限公司。
1.2 仪器与设备
恒温培养箱(SPX-30085H-II型),上海新苗医疗器械制造有限公司;超净工作台(SW-CJ-2FD型),苏净集团苏州安泰空气技术有限公司;立式压力蒸汽灭菌锅(LDZX-30KBS型),上海申安医疗器械厂;正置万能显微镜(CX21FS1C型),OLYMPUS公司,日本;台式高速冷冻离心机(3K 30型),Sigma公司,德国;超声波细胞破碎仪(SCIENTZ-IID型),宁波新芝生物科技股份有限公司;0.22 μm无菌过滤器(SLGP033RS型),雷布斯公司;高效液相色谱仪(Dionex UltiMate 3000型),Thermo Scientific公司,美国;色谱柱(ODS反相柱,C18柱, 5 μm, 250 mm×4.6 mm), GL Sciences,日本。
1.3 方法
1.3.1 Pat标准曲线的制作
准确称取50 mg Pat标准品,溶于1 mL无菌水中,使用0.22 μm微孔滤膜进行过滤,除菌后贮存于-80 ℃,得到质量浓度为50 mg/mL的Pat贮备液。配制质量浓度分别为10、25、50、100和200 μg/mL的Pat标准溶液,测定不同质量浓度Pat标准溶液的色谱峰面积。根据色谱峰面积与Pat质量浓度关系作出Pat的标准曲线。
1.3.2 酵母菌株的活化
酵母的活化参照张婕等[13]方法,将酵母接种到营养酵母葡萄糖固体培养基(NYDA)斜面上,在28 ℃下活化2~3 d。将活化好的酵母再接种到50 mL NYDB中,于28 ℃、转速200 r/min条件下培养24 h。吸取1 mL菌悬液到50 mL NYDB培养基中,继续置于28 ℃、转速200 r/min条件下培养48 h,备用。
1.3.3 不同质量浓度Pat对酵母生长的影响
参照DONG等[14]方法并进行修改。在NYDB培养基中加入适量Pat,使得Pat最终质量浓度分别为0、50、100和200 μg/mL。再分别接入终浓度为2×105CFU/mL的Y.lipolytica,在28 ℃、转速200 r/min条件下培养,分别于12、24、36和48 h取样,计数酵母细胞数。
1.3.4 Pat浓度对酵母脱毒率的影响
参照CHEN等[15]方法并进行修改。将Y.lipolytica重悬于NYDB培养基中,使得酵母最终浓度为1×109CFU/mL,并加入终浓度为0、50、100和200 μg/mL的Pat。在28 ℃、转速200 r/min摇床中培养,分别于12、24、36和48 h取样1 mL待测。
1.3.5 不同pH值及温度对酵母脱毒率的影响
参照ZHU等[16]方法并进行修改。制备pH值分别为2.0、3.0、4.0、5.0、6.0和7.0的50 mmol/L MES缓冲液,并加入适量酵母细胞和Pat,使得酵母最终浓度为1×109CFU/mL,Pat质量浓度为50 μg/mL。置于28 ℃,转速200 r/min摇床中培养。通过上述试验确定去除Pat的最佳pH值。如上述操作,将样品置于15、25、28和37 ℃条件下,培养48 h取样1 mL待测。
1.3.6 酵母初始浓度对酵母脱毒率的影响
将Y.lipolytica重悬于50 mmol/L MES缓冲液(pH值5.0)中,使得酵母终浓度分别为1×108、1×109和1×1010CFU/mL,并加入终浓度为50 μg/mL的Pat,于28 ℃、转速200 r/min条件下培养,48 h取样1 mL待测。
1.3.7 活体及灭活对酵母脱毒率的影响
参照ZHU等[16]方法并进行修改。将酵母通过热致死(121 ℃,30 min)处理使菌失活,将灭活酵母和正常酵母细胞分别重悬于含质量浓度50 μg/mL Pat的MES缓冲液(50 mmol/L,pH值5.0)中,使得酵母最终浓度为1×109cells/mL,用含有50 μg/mL Pat的MES缓冲液(pH 5.0)作为对照。在28 ℃、转速200 r/min条件下培养,48 h取样1 mL待测。从灭活酵母的样品中吸取50 μL酵母悬浮液,涂布于NYDA平板中,在28 ℃条件下培养3 d,观察是否有菌落出现,以确保酵母被完全灭活。
1.3.8 酵母的胞内物质及培养上清液对脱毒率的影响
参照CHEN等[15]方法并进行修改。将活化好的酵母在28 ℃、转速200 r/min下于NYDB中培养48 h。在8 000×g下离心10 min,分离上清液。样品Ⅰ, 2 mL培养上清液与0.5 mL 250 mmol/L MES缓冲液(pH 5.0)混合,通过0.22 μm滤膜过滤。样品Ⅱ,将培养好的酵母细胞通过超声波细胞破碎仪(400 W、工作时间5 s、停顿时间5 s) 30 min,用2 mL 50 mmol/L MES缓冲液(pH 5.0)悬浮,在15 000×g,4 ℃条件下离心30 min,取上清。样品Ⅰ和样品Ⅱ中分别加入质量浓度50 μg/mL Pat。用含有质量浓度50 μg/mL Pat的MES缓冲液(pH 5.0)作为对照。在28 ℃,转速200 r/min摇床中培养48 h,取样1 mL待测。
1.3.9 响应面试验设计
根据Box-Behnken设计原理,以pH(A)、温度(B)和酵母初始浓度(C)3个因素为自变量,Pat的脱毒率(Y)为响应值,运用Design-Expert 8.0.5对试验结果进行多元回归分析,因素水平编码见表1。

表1 响应面试验因素水平编码表
1.3.10 模型的验证
利用响应面模型优化的最佳条件进行脱毒试验,比较模型预测值与实验值,验证模型的有效性。
1.3.11 Pat含量的测定
参照ZONG等[17]的HPLC法。将所取待测样品先用0.22 μm滤膜过滤,然后自动进样器(Waters 2707)进样,进样量10 μL。色谱柱: ODS反相柱(C18柱, 5 μm, 250 mm×4.6 mm, GL Sciences, Japan);流动相:乙腈和水的体积分数分别为10%和90%,流速1.0 mL/min;柱温:30 ℃;检测波长:276 nm。
1.3.12 Pat脱毒率的计算
脱毒率计算如公式(1)所示:
(1)
式中:ρ为初始Pat质量浓度,μg/mL;ρ0为48 h后样品中Pat质量浓度,μg/mL。
1.4 数据统计
上述所有测定均重复3次。全部数据用Excel 2007计算平均值和标准误,用SPSS 17.0进行Duncan’s多重差异显著性分析,利用Design-Expert 8.0.5软件对响应面试验数据进行处理。
2 结果与分析
2.1 Pat的标准曲线
采用HPLC测定不同质量浓度Pat的标准曲线,由该曲线得到峰面积与Pat质量浓度之间的关系为:y=1.897 5x-1.804 9,线性相关系数R2=0.999 2,即Pat质量浓度与HPLC检测峰面积呈高度线性关系。
2.2 不同质量浓度Pat对Y. lipolytica生长的影响
不同浓度Pat在不同的培养阶段对酵母的生长具有一定的抑制,但整体抑制程度不大。培养12和48 h时,3种Pat质量浓度均抑制了酵母的生长,其中以200 μg/mL的抑制效果最为明显,分别低于同期对照13.4%和7.2%。培养24 h时,100 μg/mL和200 μg/mL的Pat对酵母生长表现抑制,培养36 h时,仅有200 μg/mL的Pat对酵母生长表现抑制(P<0.05) (图1)。
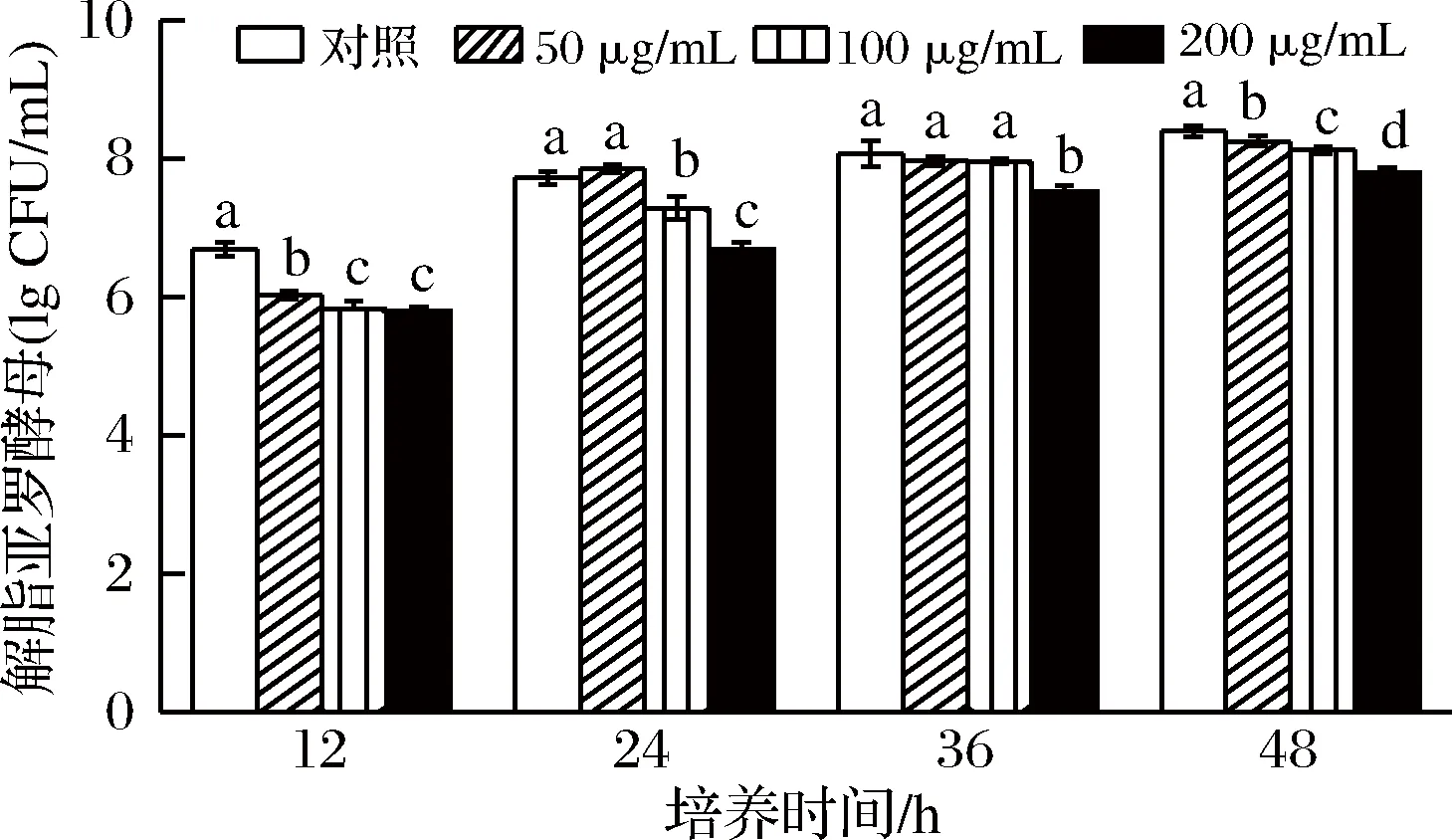
图1 不同质量浓度Pat对Y. lipolytica生长的影响
Fig.1 Effects of patulin at different concentration on the growth of Y. lipolytica注:竖线表示标准误(±SE);不同字母代表显著性差异(P<0.05),下同。
2.3 Pat起始质量浓度对酵母脱毒率的影响
Pat起始质量浓度会显著影响脱毒效果,初始质量浓度越高,酵母的脱毒率就越低(图2)。培养12 h时,Pat初始质量浓度为50 μg/mL和200 μg/mL的脱毒率与对照间均无显著性差异,初始质量浓度为100 μg/mL的脱毒率显著高于对照(P<0.05);培养24 h时,Pat初始质量浓度为50 μg/mL的脱毒率与对照间无显著性差异,但当初始浓度为100 μg/mL和200 μg/mL时,脱毒率分别显著高于对照35.2%和14.3%(P<0.05);当初始质量浓度为50 μg/mL和100 μg/mL时,36 h后的脱毒率分别为69.8%和51.5%,48 h后可几乎实现完全脱毒(图2-A, 2-B) (P<0.05)。但当Pat初始质量浓度为200 μg/mL时,酵母在36 h和48 h后的脱毒率仅分别为对照的34.1%和57.3% (图2-C) (P<0.05)。
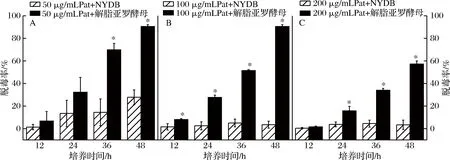
A-50μg/mL;B-100μg/mL;C-200μg/mL图2 Pat起始浓度对酵母脱毒率的影响
Fig.2 Effect of patulin at initial concentration on yeast detoxification rate
2.4 pH值、温度及酵母初始浓度对酵母脱毒率的影响
在pH值2~7,以pH值4.0的脱毒率最高,可达92.4%,其次为pH值5.0(P<0.05),但两者之间无显著性差异。偏低或偏高的pH值会显著降低酵母的脱毒效果。当pH值为2.0和6.0时,酵母的脱毒率分别低于pH值4.0时的19.5%和21.8%(P<0.05)(图3-A)。适宜的温度下,酵母会表现出良好的脱毒效果。随着温度的升高,酵母的脱毒率呈现先升高后降低的趋势。28 ℃时,酵母的脱毒率最高,可达93.0%,但当温度为15和37 ℃时,脱毒率仅相当于28 ℃的84.0%和65.1%(P<0.05)(图3-B)。酵母初始浓度越高,脱毒效果越好。当酵母浓度为1×1010CFU/mL和1×109CFU/mL时,48 h时的脱毒率分别为100%和92.3%。但当酵母浓度降至1×108CFU/mL时,同样时间的脱毒率仅相当于1×1010CFU/mL的1/3(P<0.05)(图3-C)。

图3 pH值(A)、温度(B)及酵母初始浓度(C)对酵母脱毒率的影响
Fig.3 Effects of pH (A), temperature(B) and initial concentration of yeast(C)on detoxification rate of yeast
2.5 活体及灭活酵母细胞和培养上清液及胞内物质对酵母脱毒率的影响
酵母活性对酵母的脱毒效果影响很大,活体酵母的脱毒效果更优。48 h时,活体及灭活酵母细胞的脱毒效果均显著高于对照4.9倍和3.1倍,且活体酵母的脱毒率是灭活酵母的1.5倍(P<0.05)(图4-A)。酵母胞内物质在酵母脱毒中发挥了重要作用,48 h时的脱毒率可达70.1%,高于对照组2.5倍(P<0.05)。但酵母培养上清液对酵母的脱毒效果影响不大,48 h时的脱毒率与对照相比,无显著差异(图4-B)。

A-活体及灭活酵母;B-酵母培养上清液及胞内物质图4 活体及灭活酵母(A)和酵母培养上清液及胞内物质(B)对酵母脱毒率的影响
Fig.4 Effects of living and dead yeast cells(A) and yeast culture and intracellular extracts(B) on the detoxification rate of yeast
2.6 Box-Behnken响应面试验结果
在上述单因素试验的优化的基础上,选择pH (A)、温度(B)和酵母初始浓度(C) 3个因素作为响应变量,采用Design-Expert 8.0.5 软件,进行Box-Behnken试验设计,通过3因素3水平响应曲面分析,得出其17次实验响应结果(表2)。

表2 响应面试验结果
续表2

试验号因素ABC脱毒率/%4-1-1074.83±1.4651-1076.96±1.03600090.16±2.19711068.10±2.898-10-124.62±0.42901-129.06±1.161000089.88±1.581110-132.79±2.451200087.19±1.4513-11065.06±1.6314101100.00±0150-1195.32±0.861601190.45±1.481700083.99±1.61
利用Design-Expert 8.0.5软件对pH值、温度和酵母初始浓度设计3因素3水平的Box-Behnken试验,方差分析结果如表3所示,脱毒率(Y)与pH值(A)、温度(B)和酵母初始浓度(C)的多元二次回归方程为:
Y=87.58+1.67A-3.01B+33.70C+0.23AB-2.04AC-1.06BC-6.56A2-9.78B2-16.67C2
(1)
注:P≤0.01,差异极显著;P≤0.05,差异显著;P>0.05,差异不显著。
2.7 响应面试验结果
如图5所示,通过方程可知,二次项系数为负值,其所代表的抛物面开口向下,表明方程具有最大值。利用Design-Expert 8.0.5分析计算,最适脱毒条件为pH值4.56、温度27.53℃和酵母初始浓度1×109.66CFU/mL,最大脱毒率为100.0%。
2.8 回归模型的验证结果
在上述优化的条件下,考虑到实际操作的局限性,脱毒条件的可操作性,将所得条件进行适当修正,设置pH值4.6、温度27.5 ℃和酵母初始浓度1×109.7CFU/mL,进行3次脱毒试验,以对优化结果进行进一步的验证。验证实验中脱毒率平均值为100.0%,与预测值吻合,由此表明优化模型可靠。
3 讨论
Y.lipolytica是一种非常规酵母,主要集中于富含脂类和蛋白质的环境中[18]。具有分泌各种蛋白酶、磷脂酶和脂肪酶的能力[19]。本研究发现,Y.lipolytica可有效降解Pat,但降解效果受酵母初始浓度、Pat初始浓度、温度、pH值及酵母活性的显著影响,活体酵母的脱毒效果更优。该结果与Y.lipolytica降解赭曲霉毒素A的结果类似[20]。

a-pH和温度;b-pH和酵母初始浓度;c-温度和酵母初始浓度图5 各因素交互作用的响应面与等高线图
Fig.5 Response surface and contour plots showing the interactive effects of various factors on bacteriocin production
Pat初始浓度越高,酵母的脱毒效果就越低(图2),表明Pat对Y.lipolytica具有一定的毒性。该结果与Candidaguilliermondi[15]和S.cerevisiae[21-22]降解Pat中观察到的现象基本一致。Pat对酵母的毒性主要表现为破坏细胞膜的结构和膜蛋白质的功能[23]。在细胞水平上,Pat与巯基化合物具有较高的亲和性[24-25]。可与酵母质膜外表面的游离硫醇结合,从而破坏细胞膜结构,损害其渗透性和完整性[26]。Pat一旦进入细胞,可与巯基结合,消耗胞内谷胱甘肽,破坏胞内氧化还原平衡[27],从而诱导活性氧的大量积累和随后的氧化爆发,导致应激信号的早期传递,并对细胞组分造成氧化损害[28]。本研究发现,Y.lipolytica在28 ℃的条件下,对Pat的脱毒效果较好。该结果与之前报道的Y.lipolytica的生长最适温度为28 ℃[12]的结果一致。在此条件下,酵母的个体较大,形态饱满,生理状态最佳。酵母活力旺盛,细胞壁吸附能力强,因此可以有效的脱除毒素。本研究中发现,酵母浓度越高对Pat的脱毒效果越好,这与KodamaeaohmeriHYJM34[14]降解Pat的结果类似。酵母浓度越高,细胞壁表面积越大,因此可有效增加酵母细胞壁对Pat的吸附[29]。此外,酵母体内的内酯酶类(如β-lactamase,β-内酰胺酶)在分解Pat的内酯环结构中也发挥了重要作用[30]。
本研究发现,灭活Y.lipolytica去除Pat的结果与之前报道的10株灭活酵母菌降解Pat的结果类似,主要缘自于酵母细胞壁对Pat的吸附[31]。活体Y.lipolytica去除Pat效果更优,说明该酵母既能通过细胞壁物理吸附,又能通过胞内酶生物降解Pat。细胞壁物理吸附Pat受到菌体量的限制,容易达到饱和状态,而生物降解不受限制,只要生物体有活性,便能持续发挥高效的降解作用[16]。细胞壁之所以能吸附Pat可能与细胞壁上的葡聚糖、甘露聚糖和糖蛋白复合物等成分有关[32]。Pat会与酵母细胞壁上的多糖和蛋白质非共价结合,从而达到吸附的目的[33]。此外,酵母细胞壁上的羧基和酰胺基团也可能参与了与Pat的结合[34]。本研究所发现的酵母胞内物质对Pat具有显著脱除作用,这与Rhodosporidiumpaludigenum降解Pat的结果类似[16],表明酵母的胞内物质在Pat降解中发挥了重要作用。Pat先通过酵母细胞壁上的转运蛋白运至酵母体内,然后在相关内酯酶的作用下降解为无毒的脱氧棒曲霉酸(desoxypatulinicacid)[35]。此外,磷酸甘露糖变位酶可能也参与了酵母对Pat的降解[36]。由于酵母培养上清液中多为碳源、氮源、生长因子和无机盐等成分,不具备吸附或降解Pat的功能,因此无法降解Pat[37]。
4 结论
Y.lipolytica能有效地去除Pat,该酵母对Pat的脱毒效果与温度、pH值、Pat及酵母初始浓度有关。不同质量浓度Pat在不同的培养阶段对酵母的生长具有一定的抑制,但整体抑制程度不大,可能与高浓度Pat破坏酵母细胞膜的结构和膜蛋白质的功能有关。活酵母细胞与死酵母细胞均能有效脱除Pat,且活酵母细胞对Pat的脱毒效果更优,说明Y.lipolytica既能通过细胞壁物理吸附Pat,又能通过胞内酶生物降解Pat,其中以胞内酶生物降解的作用最为明显。
