靶向HER2阳性肿瘤的PET/CT分子显像临床研究进展
2019-05-06周妮娜朱华杨志
周妮娜,朱华,杨志
0 引言
人类表皮生长因子受体2(HER2)是由定位于染色体17q21的c-erbB-2基因编码的一种有酪氨酸激酶活性的跨膜受体样蛋白,为表皮生长因子受体(epithelial growth factor receptor, EGFR)家族成员之一,在多种肿瘤组织中均有不同程度的表达[1]。靶向治疗药物曲妥珠单抗(赫赛汀,Herceptin),是人工合成的单克隆抗体,与HER2的胞外结构域结合后,选择性地阻断HER2相关信号通路。1998年,美国食品药品监督管理局(FDA)批准曲妥珠单抗用于转移性乳腺癌的临床治疗,该药在化疗后单独应用或与化疗药物联用已成为早期及转移性乳腺癌临床治疗的一线用药方案。2010年,欧盟和美国又相继批准曲妥珠单抗用于HER2阳性晚期转移性胃癌的临床治疗。该药明显提高HER2阳性乳腺癌、胃癌的总生存时间[2-4]。
准确及时评估肿瘤原发灶及转移灶HER2表达情况是靶向治疗的关键。目前对HER2过表达的检测一般采用取活检标本进行病理学检查,检查。方法主要是免疫组织化学染色(immunohistochemistry, IHC)和荧光原位杂交法(fluorescence in situ hybridization, FISH),HER2阳性定义为HER2 IHC2+/FISH阳性,或IHC3+。但是这种有创性的检查不能作为肿瘤疗效评价的常规检查而多次进行,另外HER2过表达存在空间和时间的异质性[5-6],即原发灶内部、原发灶与转移灶、转移灶间均有可能出现HER2表达的异质性,病灶治疗过程中HER2表达也可能出现变化,例如一些HER2阴性的乳癌患者亦能从抗HER2治疗中获益[7-8]。而原发灶与转移灶HER2表达的异质性、病灶治疗过程中HER2表达变化情况,常常因为位置深在或难以通过反复活检获得。
靶向HER2的PET/CT分子显像,有望实时、无创的监测全身病灶的HER2表达情况。目前靶向HER2的PET/CT分子显像主要包括核素标记抗体显像、核素标记亲和体显像、核素标记抗体片段及纳米抗体显像。
1 核素标记完整单克隆抗体靶向肿瘤HER2显像(表1)
1.1 89Zr-Trastuzumab与89Zr-Pertuzumab PET/CT显像
曲妥珠单抗与HER2受体胞外结构域的IV区结合,通过以下机制抑制肿瘤细胞的增殖、生长和存活:(1)下调HER2的总水平;(2)阻断HER2胞外区的裂解;(3)抑制HER2同源二聚化,从而抑制PI3K细胞内信号转导;(4)减少血管生成;(5)诱导抗体依赖性细胞毒性或裂解通过免疫细胞募集的抗体结合细胞[9-10]。
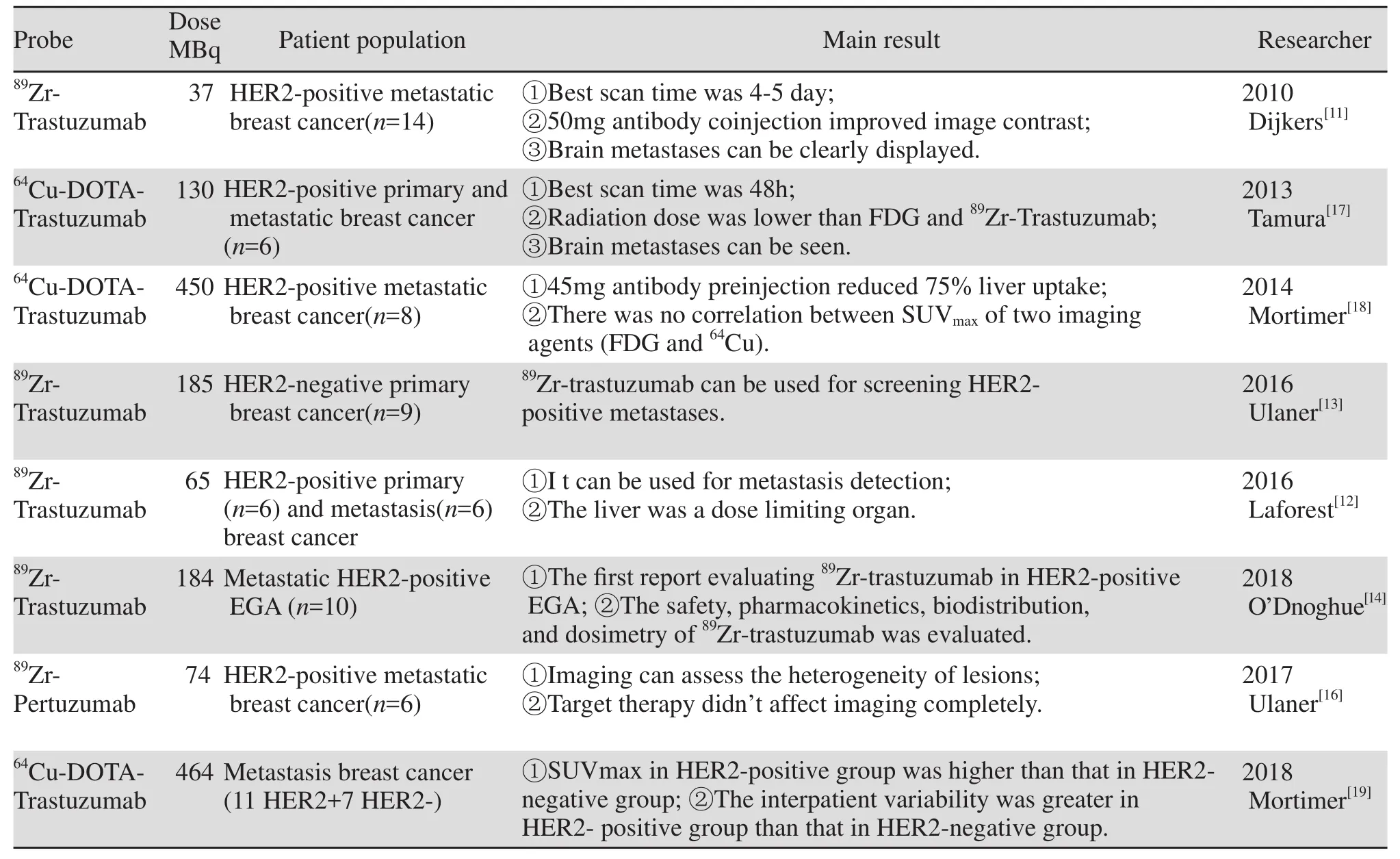
表1 核素标记完整的单克隆抗体显像Table1 Complete radionuclide-labeled monoclonal antibody imaging
由于完整抗体的血液药代动力学较慢,需要半衰期相对长的核素标记,89Zr核素具有相对长的半衰期(78.4 h),并能提供较高的PET空间分辨率,可用于标记完整抗体进行显像。2010年Dijkers等[11]首次应用89Zr-Trastuzumab进行了14例HER2阳性转移性乳腺癌患者的PET/CT显像研究,其中7例为治疗中患者,7例为未接受治疗的患者,结果发现CT或MRI检出的大部分病灶在PET上显影,并且脑转移灶显影,提示血脑屏障的破坏,患者无注射药物相关的不良反应,估算的辐射剂量同两次腹部CT扫描相仿(18 mSv)。未接受过治疗的共注射50 mg抗体、接受治疗的10 mg抗体图像对比度好,脑转移可清晰显示。2016年Laforest等[12]的研究提示注射89Zr-Trastuzumab后5±1天图像对比好,药物在肝、肾、心肌中滞留时间较长,肝脏为剂量限制性器官(1.54 mSv/MBq)。2016年Ulaner等[13]应用89Zr-Trastuzumab对乳腺癌原发灶为HER2阴性的患者进行HER2阳性转移灶的探测,9例患者中5例出现阳性显像结果,经活检证实,其中2例为真阳性,接受靶向治疗,因此研究者认为89Zr-trastuzumab有助于HER2阴性乳腺癌阳性转移灶筛查。
2018年O’Donoghue等[14]首次应用89Zr-Trastuzumab进行了HER2阳性食管胃结合部癌患者的显像,报道药物安全性、药代动力学、生物分布、辐射剂量,2例注射药物时出现轻微寒冷,余无不良反应,T1/2β(消除半衰期)为111 h,5~8天显影最佳,吸收剂量较高的脏器分别为肝脏、心脏壁、肾脏、肺、脾,有效剂量为0.48 mSv/MBq。肿瘤显像:2例未显影,1例可能因为病灶HER2表达为弱阳性(IHC2+、FISH HER2/CEP17 3.4);1例胃癌术后患者,其原发灶和肺转移灶经病理学证实均为HER2阳性表达,肺转移灶未显影可能因为病灶较小(1.1×1.1 cm),腹膜后淋巴结(1.9×1.3 cm)未显影,但是该淋巴结并未进行活检病理学检查。
Pertuzumab(帕妥珠单抗)是另外一种人源化单克隆抗体,结合位点(Ⅱ区)不同于Trastuzumab(Ⅳ区)[15],对于正在接受Trastuzumab或T-DM1治疗的患者,病灶HER2的检测可能较核素标记Trastuzumab更为敏感。2017年Ulaner等[16]进行了89Zr-Pertuzumab在HER2阳性转移性乳腺癌患者的显像,研究表明该药物无毒性反应,血池、肝脏、肾脏、脾脏显影,膀胱内无聚集,2例患者小肠显影,血池、脾脏随时间延长浓聚降低,肝肾持续显影,肝脏、肾脏、心室壁接受的辐射剂量较高,平均有效剂量0.54 mSv/MBq,与Trastuzumab相当(0.48),Pertuzumab在实质脏器(肝脏、肾脏、脾脏、肺)的浓聚略高于Trastuzumab;两例患者同时具有阳性原发灶和阴性原发灶,均发现脑转移阳性显像,一例脑转移经活检证实为真阳性,一例患者活检证实原发灶、肝转移灶为阴性,胸壁转移灶为阳性,显像时仅胸壁病灶为阳性,提示显像可以评估病灶的异质性。
89Zr-Trastuzumab与89Zr-Pertuzumab PET/CT显像时间为注射药物后4~8天[11-14,16],为了降低肝脏的本底摄取,提高显像的敏感度,未接受靶向治疗的患者显像前需要50 mg抗体的预注射或共注射,治疗中的患者需要10 mg抗体的预注射或共注射[11-14,16], 平均辐射剂量为0.47~0.54 mSv/MBq[11-12,16],显像可用于初治及治疗中患者HER2状态的检测[11-12,14,16]。
1.2 64Cu-Trastuzumab PET/CT显像
64Cu-半衰期为12.8 h,亦用于标记抗体显像。2013年Tamura等[17]应用64Cu-DOTA-Trastuzumab进行HER2阳性乳腺癌患者显像,研究表明显像剂安全,无不良反应,显像结果提示CT、MRI发现的大部分病灶均显像;药物辐射的有效剂量为0.036 mSv/MBq,内照射剂量为4.5 mSv, 低于常规FDG(7.0~14 mSv)显像和89Zr-trastuzumab(18 mSv)显像的辐射剂量,脑转移可清晰显示。2014年Mortimer等[18]研究发现50 mg抗体的预注射可降低75%肝脏摄取,对病灶摄取无明显影响,对CT已知病灶检出率的敏感度为1天77%、2天89%,FDG 93%,同一病灶的FDG和64Cu-Trastuzumab摄取值无相关性,同一患者及不同患者间病灶摄取差异大,提示了HER2表达的异质性,药物辐射在安全范围,其有效剂量为12 mSv。
2018年Mortimer等[19]比较了11例HER2阳性与7例阴性乳腺癌患者的64Cu-DOTA-Trastuzumab PET/CT显像结果,发现HER2阳性组中位SUVmax高于阴性组,两组间有重叠,HER2阳性组患者内、患者间变异程度高于阴性组,FDG摄取与64Cu-DOTATrastuzumab摄取无相关性。
64Cu-Trastuzumab的显像时间为注射药物后1~2天[17-19],50 mg抗体预注射可降低肝脏本底[18-19],有效剂量为0.036 mSv/MBq[17],可用于初治治疗中患者的显像。
2 核素标记亲和体(Affibody)显像(表2)
亲合体是一种中等大小的肽,相对分子质量小(6.5 kDa),生物分布快,ABY-025可与HER2胞外Ⅲ区结合[20-21],不同于Trastuzumab和Pertuzumab(Ⅳ和 Ⅱ区),可用于靶向治疗中的患者显像。
2016年Sandström等[22]对8例转移性乳腺癌患者进行显像,吸收剂量最高者分别为肾和肝脏,以注射100 MBq为例,分别为40 mGy和15 mGy,低于科研最高限量50 mGy,200 MBq有效剂量为5.6 mSv, 低于常规的FDG(7 mSv)。2016年Sörensen等[23]对12例原发灶为阳性及4例阴性的转移性乳腺癌患者进行了68Ga-ABY-025 PET/CT显像研究,对比了高剂量和低剂量冷抗共注射对显像的影响,并对其中12例患者的16处病灶进行了活检。研究发现 4 h高剂量冷抗共注射显像最佳;阳性灶摄取值是阴性灶的5倍之多,可重复性好,识别出病灶HER2表达的反转及混合性,3例患者因此改变治疗策略。FDG SUVmax阳性与阴性病灶无差异,68Ga-ABY-025 HER2阳性与HER2阴性病灶的SUV在各个时间点、两种剂量均有差异。HER2阳性灶SUV值随时间延长而升高,HER2阴性灶SUV值无明显变化。HER2评分(0~3+)与SUV有很好的相关性,部分患者转移灶的SUV值变异很大,一些病灶明显高于或低于界值,说明同时存在HER2阳性与阴性灶(2例患者通过活检证实)。
3 核素标记抗体片断及纳米抗体显像(表3)
68Ga半衰期为68分钟。68Ga-DOTA-F(ab’)2-trastuzumab(30 KD)与抗体相比,在血液中滞留时间相对较短,可于较短时间内进行显像。2013年Beylergil等[24]对7例HER2阴性及8例HER2阳性乳腺癌进行68Ga-DOTA-F(ab’)2-Trastuzumab显像,结果显示无注射药物不良反应,药物的生物半衰期约为(3.6±0.9)h,检查中肾脏受到的辐射剂量最高,为0.383 cGy/37MBq。8例阳性患者中有4例病灶显影,4例未显影。未显影的原因:(1)可能是患者接受靶向治疗,体内抗体竞争显像剂的结合;(2)可能是未进行冷抗体的注射。该作者提出优化显像条件,需纳入未接受靶向治疗的患者,并增加冷抗体的注射量。
纳米抗体(Nanobody)是具有完整功能的最小的抗原结合片段(15 KD),相比于常规抗体,纳米抗体的优势有:(1)相对分子质量小,可穿透血脑屏障;(2)原核或真核系统中高表达;(3)特异性强,亲和力高;(4)对人的免疫原性弱[25]。Keyaerts于2016年[26]报道了68Ga-HER2-Nanobody用于乳腺癌患者显像的安全性、生物分布、辐射剂量及靶向肿瘤显像能力。20例患者被分成三组,接受不同的剂量冷抗体注射。结果显示显像剂安全,无药物注射相关不良反应,生物半衰期约1 h,可早期显像(60~90 min),因为肝脏本底持续下降,90 min显像可能更好一些。显像剂通过肾脏清除,估算的辐射剂量为0.04 mSv/MBq,平均有效剂量为4.6 mSv。原发灶的SUV值范围为0.7~11.8,可能提示肿瘤的异质性。2例原发灶为阴性的转移灶出现高摄取,可能是因为原发灶与转移灶HER2表达的不一致。18F为目前生产使用最为广泛的正电子核素,亦可用于相关抗体的标记, Xaviera等[27]进行了18F-FB-anti-HER2 Nanobody在HER2阳性肿瘤移植鼠的体内显像研究,结果表明该探针具有较高的肿瘤特异性摄取,通过肾脏快速清除,具有较高的临床应用潜能。

表2 核素标记亲和体(affibody)显像Table2 Radionuclide-labeled affibody imaging

表3 核素标记抗体片断及纳米抗体显像Table3 Radionuclide-labeled antibody fragments and nanobody imaging
4 18F-FDG PET/CT与HER2表达
HER2阳性与阴性肿瘤的FDG摄取是否具有差异,各研究结果尚无明确一致结论[28-30]。Chen等[28]回顾性分析了64例胃癌患者术前FDG PET/CT,发现当排除了印戒细胞癌后,HER2阴性组(IHC0, IHC1+)SUVmax高于阳性组(IHC2+,IHC3+),以SUVmax=6.2为界值,预测HER2表达的准确性为64.4%。Kim等[29]分析了109例进展期胃癌术前的FDG PET,结果发现HER2阴性组(IHC0, +)低于HER2阳性组(IHC2+, 3+)(3.9±2.1 vs. 6.3±3.7, P=0.02)。以SUVmax3.5为界值,敏感度76.9%和特异性60.2%。Celli等[30]选择31例活检或手术证实的HER2阳性和65例HER2阴性的胃癌/胃食管结合部癌,对年龄和性别进行匹配后,发现阳性组(IHC3+ 或 IHC2+, FISH阳性)与阴性组的FDG SUVmax无差异(9.7 vs. 8.4,P=0.6)。一些研究同时进行了FDG显像与HER2显像[18-19], 结果表明FDG摄取与HER2显像剂摄取均无相关性。由于FDG主要反映病灶的葡萄糖代谢情况,其代谢高低更多的受肿瘤组织病理类型、分化程度的影响,不能直接反应肿瘤HER2表达的情况。新型分子探针直接靶向HER2受体显像,能更加准确的反映肿瘤HER2表达情况。
5 靶向HER2的PET/CT分子显像用于疗效预测
2016年Gebhart等[31]进行了一项前瞻性的临床试验,应用89Zr-Trastuzumab PET/CT和FDG PET/CT对HER2-阳性转移性乳腺癌患者接受T-DM1治疗进行疗效预测。结果发现:56例患者中,29%为HER2-PET/CT阴性,46%的患者体内病灶表现为异质性。以RECIST1.1为标准, HER2-PET/CT的NPV/PPV(阴性预测值/阳性预测值)为88%/72%,早期FDG PET/CT为83%/96%。联合HER2-PET/CT和FDG-PET/CT能够准确的预测形态学反应(PPV and NPV:100%),并能有效地将治疗失败时间(time-to-treatment failure, TTF)值不同的两组患者区别开。治疗前HER2靶向显像与FDG早期代谢反应相结合,可以显示肿瘤异质性,并用于筛选接受T-DM1治疗获益的患者。
6 总结与展望
长半衰期核素标记完整抗体的优点:直接评估HER2结合Trastuzumab的情况,可以有效的预测治疗效果用于患者筛选;用于不易活检病灶HER2状态的评估(如脑转移),可以评价同一病灶内部、同一患者不同病灶的HER2表达异质性;另外,因其无创性,检查可以反复进行,用于治疗中的疗效评价。缺点是完整抗体的血液药代动力学较慢,需要半衰期相对长的核素标记,血液清除率较慢,血池及肝脏背景高,为了获得较好的图像对比度,需要较长时间点的显像,以及注射冷抗体降低肝脏的非特异摄取,患者的配合度较差,另外长半衰期的核素导致较高的辐射剂量。
短半衰期核素标记亲和体显像、抗体片段及纳米抗体显像优点:由于其相对分子质量小,生物分布快,注射药物后短时间内显像(1~4 h),增加患者的便利性,可重复显像,亲合体由于与抗体结合位点不同,可用于靶向治疗中患者的显像,另外辐射剂量明显低于长半衰期核素标记的完整抗体。缺点:亲和体、抗体片段及纳米抗体制备要求高,国内外相关临床研究较少。
既往研究的不足之处在于病例样本较少,且多数为乳腺癌方面的研究,胃癌HER2表达方面的研究较少。另外18F标记相关抗体研究较少。18F为目前生产使用最为广泛的正电子核素,亦可用于相关抗体的标记,已有临床前研究表明18F标记纳米抗体有较高的肿瘤摄取特异性,并且肾脏清除快,具有很好的临床应用前景。目前短半衰期核素以68Ga为主,主要因为标记过程简单,应用锗-镓发生器获得核素方便,18F需要加速器获得,且标记过程相对复杂,随着标记技术的进步,18F标记相关抗体有望更多的应用于临床研究。
综上,靶向HER2的PET/CT分子显像,可实时、无创的监测全身病灶的HER2表达情况,有助于更好的理解HER2表达的异质性,用于原发肿瘤HER2阴性患者阳性转移灶的筛选,用于不易活检病灶HER2状态的评估,同时也可用于预测疗效,以选择适合靶向治疗的患者。短半衰期核素标记亲和体、抗体片段及纳米抗体显像因其较短的显像时间点及较低的辐射剂量,可能更适于临床应用。
