MiR-148a-3p通过靶向SRPK2抑制结肠癌细胞转移
2019-05-05王小东马博昭戚峰
王小东,马博昭,戚峰
(天津医科大学总医院普通外科,天津300052)
随着生活水平的提高和生活方式的改变,结直肠癌(colorectal cancer,CRC)的发病率每年都在增加[1]。肿瘤转移是CRC患者丧失手术机会的最重要原因之一。大约20%~25%的患者在初次诊断CRC时出现肝转移,40%~50%的患者在切除原发性CRC后发生肝转移[2]。尽管目前CRC的诊断和治疗方法取得了显著进展,肿瘤转移仍是影响结肠癌患者生存的重要因素[3]。目前,术后化疗是Ⅲ期结肠癌患者的标准治疗[4]。因此,寻找和开发结肠癌中的靶向治疗剂具有重要的意义。
MicroRNA (miRNA/miR)代表一组独特的非编码RNA分子,其通过与信使RNA(message RNA,mRNA)的3′-UTR区结合而转录后调节基因表达,导致翻译抑制或mRNA降解[5]。越来越多的证据表明,miRNA失调与许多人类疾病有关,并且与各种肿瘤的增殖和转移密切相关,包括CRC[6]、乳腺癌[7]、肺癌[8]和胃癌[9]。很多研究已经证明,CRC中有很多miRNA 的变化。例如,miR-135a、miR-137、miR-143、miR-148a-3p和 miR-31[10-12]。MiR-135a可以通过影响p21和周期蛋白D2影响结肠癌细胞的增殖[13]。MiR-143过表达可以抑制结肠癌增殖,促进结肠癌细胞凋亡[14]。已经有研究显示,miR-148a-3p在早期复发II期和Ⅲ期结直肠癌根治术后具有重要的临床意义。MiR-148a-3p的失调发生在多种肿瘤中,如胰腺癌[15]、胃癌[16-18]、非小细胞肺癌[19]、乳腺癌[20]和鼻咽癌[21]等。MiR-148a-3p通过抑制DNA甲基化酶Ⅰ的表达抑制胃癌的转移和侵袭[18]。MiR-148a-3p可以通过引导DNA甲基化从而调节乳腺癌表面雌激素受体的表达[20]。但是目前,miR-148a-3p对结肠癌的作用研究还很少,发挥作用的机制也不完全清楚。
富含丝氨酸/精氨酸蛋白特异性激酶(Serine/Arginine-rich protein specific kinases,SRPK),如SRPK1和SRPK2,可以磷酸化可变剪接因子/剪接因子2并调节细胞周期[22]。对于SRPK2,其发挥的主要作用是促进肿瘤细胞的转移[23]。但是目前SRPK2在结肠癌中的表达的调控机制还不完全清楚。
在本研究中,笔者发现相对于正常结直肠粘膜上皮细胞,miR-148a-3p在结肠癌细胞中表达降低,SRPK2在结肠癌细胞中表达增高。在结肠癌细胞中过表达miR-148a-3p可以抑制结肠癌细胞的迁移及侵袭能力。相反的,miR-148a-3p inhibitor可以增强结肠癌细胞的迁移及侵袭能力。同时,miR-148a-3p可以影响结肠癌细胞上皮-间质转化。荧光素酶报告系统结果显示,SRPK2是miR-148a-3p的直接作用靶点。MiR-148a-3p过表达可以抑制SRPK2 mRNA和蛋白的表达,而miR-148a-3p敲低时,SRPK2 mRNA及蛋白表达增高。MiR-148a-3p通过调控SRPK2表达可能是影响结肠癌细胞转移的机制之一。
1 材料与方法
1.1 细胞培养 人结肠癌细胞系(SW480,S
W620,LOVO和HCT-116)和人正常结直肠上皮细胞系FHC从中国科学院(中国上海)购买或本实验室冻存。用含有10%胎牛血清(FBS)的DMEM培养基,在37℃,含有5%CO2的培养箱中培养细胞。培养基每2 d更换1次。
1.2 细胞转染 转染前,将2.5×104个细胞接种到6孔板的每个孔中并孵育24 h,然后弃去培养基。用100 nmol/L miR-148a mimic(Ribobio,广州,中国)或200 nmol/L miR-148a inhibitor(Ribobio,广州,中国)及对应的阴性对照(negtive control,NC)转染细胞。使用Lipofectamine 2000试剂促进转染(Invitrogen,Carlsbad,CA,USA)。
1.3 划痕和transwell侵袭实验 通过划痕和带有Matrigel(BD Bioscience,USA)基质胶的transwell小室检测细胞迁移和侵袭能力。对于划痕实验,将转染后的细胞接种于6孔板中,当细胞达到90%汇合时,吸出培养基并用磷酸盐缓冲液(PBS)冲洗两遍。在含有1%FBS的培养基中饥饿培养过夜后吸出培养基。用200 μL移液管尖端在单层细胞表面划出三条平行的划痕,用PBS洗涤细胞以除去碎片,并培养24 h观察划痕距离。对于transwell侵袭实验,将200 μL含有1×105个细胞的无血清培养基加入上室中,并将600 μL含有10%胎牛血清(FBS)的培养基加入到下室中。在37℃培养24 h后,除去基质胶,将穿透基质胶并到达基底膜的细胞在4%多聚甲醛中固定,用0.1%结晶紫染色10 min,并在倒置显微镜下计数细胞数。
1.4 荧光素酶报告系统 将结合miR-148a-3p的野生型(Wt)或突变型(Mut)SRPK2序列克隆到pGL3 Basic载体(Promega)中。将293T细胞接种在24孔板中48 h后,将10 μg pLUC-Wt-SRPK2或pLUC-Mut-SRPK2与miR-148a-3p mimic或inhibitor(Ribobio,广州,中国)共转染到 293T 细胞中。培养箱中培养24 h,裂解细胞并检测荧光素酶活性(Promega,USA)。
1.5 RNA提取和定量实时PCR(qRT-PCR) 通过RNA提取试剂盒(QIAGEN,上海,中国)提取总RNA,并将1 μg总RNA添加至20 μL的反应系统中。GoScript Reverse Transcription试剂盒(Promega,USA)用于HOTAIR的逆转录,miR-148a-5p通过茎环法逆转录(QIAGEN,Shanghai,China)。 GAPDH和U6作为内参。引物序列如下:
miR-148a-3p,上游,5′-GCTAGCCTCCGAAGCAAACAATGAAA-3′,下游,5′-AAGCTTCGTCTACAAGGACTAACCGAAA-3′;
SRPK2,上游,5′-AGCTGGGATTATAGGCGCAT-3′,下游,5′-TTGTTAGGGGAGGGAGCTTG-3′;
Vimentin, 上 游 ,5′-CATTGAGATTGCCACCTAC-3′,下游,5′-CGTTGATAACCTGTCCATC-3′;
E-cadherin,上游,5′-AGAACGCATTGCCACATACA-3′,下游,5′-GAGGATGGTGTAAGCGATGG-3′;
N-cadherin,上游,5′-ATGAAAGACCCATCCAC G-3′,下游,5′-CCTGCTCACCACCACTA-3′;
GAPDH:上游,5′-TGCACCACCAACTGCTTAGC-3′,下游 5′-GGCATGGACTGTGGTCATGAG-3′;
U6:上游,5′-CTCGCTTCGGCAGCACA-3′,下游,5′-AACGCTTCACGAATTTGCGT-3′。PCR 反应进行40个循环,并使用2-ΔΔCt方法计算RNA相对表达。
1.6 蛋白质印迹分析(Western blot) 使用RIPA裂解液裂解CRC细胞以获得总蛋白。每个样本40μg总蛋白分别加入10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)的样本孔中进行凝胶电泳,电泳结束后将蛋白质转移到聚偏二氟乙烯膜(PVDF膜,Millipore,USA)上。用0.5%牛血清白蛋白封闭具有印迹蛋白的膜2h,然后用抗E-cadherin抗体(1∶1500,Cell Signaling Technology(CST),USA),抗 N-cadherin 抗体(1:1 500,CST,USA),抗 Vimentin 抗体(1∶1 500,CST,USA),抗 SRPK2 抗体 (1∶1 500,R&D Systems,USA) 或抗-β-actin 抗体(1∶3 000,CST,USA),4℃过夜孵育。洗涤膜3次并在室温下用稀释的辣根过氧化物酶(HRP)标记的二抗(1∶2 500,CST,USA)孵育2 h。使用化学发光检测试剂盒(Millipore,USA)检测免疫反应性蛋白质条带。通过G-Box系统(Syngene,USA)获得图像并通过Image J软件(美国国立心理健康研究所,USA)进行分析。
1.7 统计学分析 使用t检验或单因素方差分析(ANOVA)分析连续数据。所有数据均使用Statistic Package for Social Science软件(SPSS 19.0,USA)和GrapPad Prism(GraphPad Software,Version 5.0,USA)进行统计学分析。所有数据以±s表示,P<0.05表示有统计学意义。每个实验均进行了3次独立实验。
2 结果
2.1 miR-148a-3p结肠癌细胞系中低表达,SRPK2在结肠癌细胞系中高表达 首先检测了人结肠癌细胞中与人正常结直肠粘膜细胞FHC中miR-148a-3p及SRPK2的表达情况。结果显示,相对于FHC,结肠癌细胞系 HCT-116,SW480,LOVO和 SW620中 miR-148a-3p 表达降低(P<0.05)(图 1a)。相反的,SRPK2 mRNA及蛋白在结肠癌细胞系中高表达(P<0.05)(图 1b,1c)。在接下来的实验中,笔者选择HCT-116和SW480两种细胞进行实验。
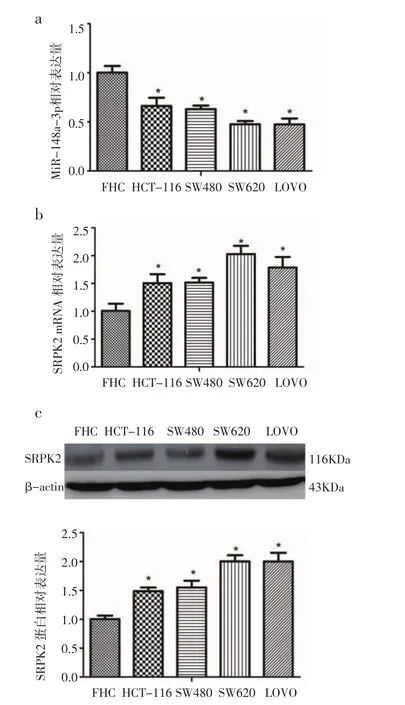
图1 MiR-148a-3p及SRPK2在结肠癌细胞系中的表达Fig 1 The expression of miR-148a-3p and SRPK2 in colon cancer cell lines
2.2 miR-148a-3p抑制结肠癌细胞侵袭及转移 为了检测miR-148a-3p对结肠癌细胞迁移及侵袭能力的影响,笔者进行了划痕试验和transwell试验。使用 miR-148a-3p mimic,miR-148a-3p inhibitor及对应NC转染结肠癌细胞。如图2a所示,miR-148a-3p mimic,miR-148a-3p inhibitor可以明显增加和降低结肠癌细胞中miR-148a-3p的水平(P<0.05)。划痕实验结果显示,过表达miR-148a-3p的结肠癌细胞相对迁移距离明显下降 (P<0.05),而敲低miR-148a-3p的结肠癌细胞相对迁移距离明显增加(P<0.05)(图 2b)。此外,过表达 miR-148a-3p的结肠癌细胞穿透基质胶的细胞数目减少(P<0.05),而敲低miR-148a-3p的结肠癌细胞穿透基底膜的细胞数目增加(P<0.05)(图2c)。这些结果提示我们,miR-148a-3p可以影响结肠癌细胞迁移及侵袭能力。
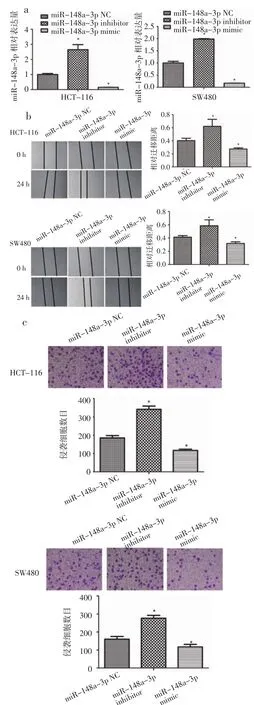
图2 MiR-148a-3p对HCT-116及SW480迁移及侵袭能力的影响Fig 2 The effect of miR-148a-3p on migration and invasion of HCT-116 and SW480
2.3 MiR-148a抑制结肠癌细胞发生上皮-间质转化 上皮间质转化是肿瘤转移过程中的重要生物学过程之一。为了检测miR-148a-3p对结肠癌上皮间质转化的影响,笔者检测了上皮标志E-cadherin,间质标志N-cadherin及Vimentin的表达。结果如图3a,3b显示,过表达miR-148a-3p的结肠癌细胞E-cadherin 表达增加 (P<0.05),N-cadherin 及 Vimentin表达降低 (P<0.05)。而在miR-148a-3p敲低的结肠癌细胞中,E-cadherin表达明显降低 (P<0.05),N-cadherin 和 Vimentin 表达明显增加(P< 0.05)。这些结果提示,miR-148a-3p可以抑制结肠癌细胞上皮-间质转化。
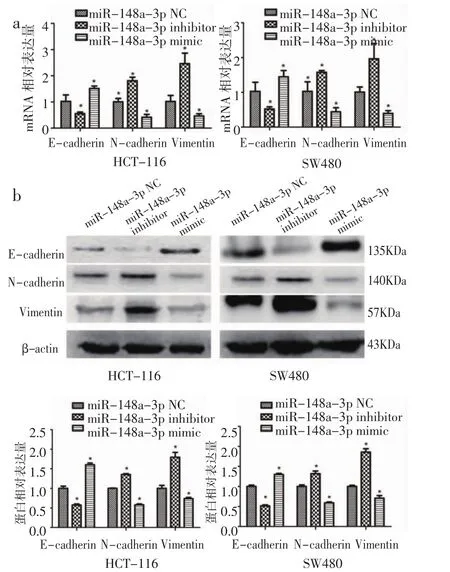
图3 MiR-148a-3p对HCT-116及SW480上皮-间质转化的影响Fig 3The effect of miR-148a-3p on epithelial-mesenchymal transition of HCT-116 and SW480
2.4 SRPK2是miR-148a-3p的直接靶点 为了阐明miR-148a-3p抑制CRC细胞迁移的潜在机制,笔者使用TargetScan 7.2和miRPathDB数据库预测了miR-148a-3p的可能靶点。预测结果显示SRPK2是miR-148a-3p的潜在靶点。为了证明SRPK2是miR-148a-3p的直接靶点,笔者进行了荧光素酶报告实验。将结合miR-148a-3p的野生型(Wt)或突变型(Mut)SRPK2序列克隆到 pGL3 Basic载体中(图 4a),并与miR-148a-3p mimic或miR-148a-3p inhibitor共转染293T细胞后检测荧光素酶活性。实验结果显示,miR-148a-3p mimic和Wt-SRPK2共转染的293T细胞中荧光素酶活性明显下降(P<0.05)(图 4b)。相反,当 Wt-SRPK2和 miR-148a-3p inhibitor共转染到293T细胞中时,荧光素酶活性增加(P<0.05)(图 4b)。这个结果提示,SRPK2 可能是miR-148a-3p的直接作用靶点。

图4 荧光素酶报告实验验证SRPK2是miR-148a-3p的直接作用靶点Fig 4 Verification of SRPK2 as a direct target of miR-148a-3p using the luciferase reporter assay
2.5 MiR-148a-3p抑制结肠癌细胞系中SRPK2的表达 为了证实miR-148a-3p对CRC细胞中SRPK2表达的影响,笔者进一步检测了miR-148a-3p mimic或inhibitor转染的CRC细胞中SRPK2的mRNA和蛋白质表达。结果显示,用miR-148a-3p inhibitor转染结肠癌细胞后,SRPK2的mRNA及蛋白水平明显增加(P<0.05)(图 5a,5b)。相反的,用 miR-148a-3p mimic转染结肠癌细胞后,SRPK2的mRNA及蛋白表达明显降低(P<0.05)(图 5a,5b)。这些结果提示,miR-148a-3p可以直接影响SRPK2表达。
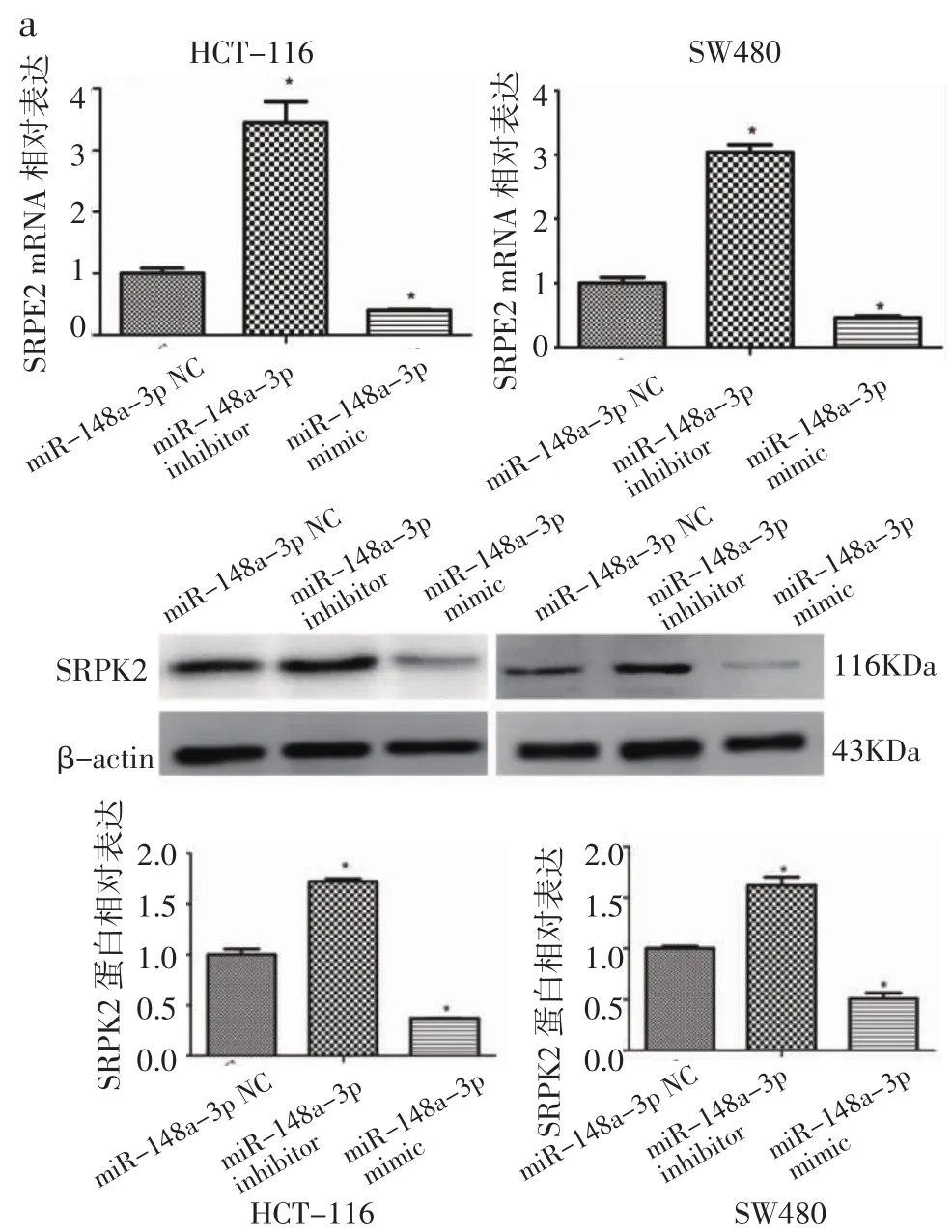
图5 MiR-148a-3p对HCT-116及SW480中SRPK2表达的影响Fig 5 The effect of miR-148a-3p on the expression of SRPK2 in HCT-116 and SW480
3 讨论
MiRNA的失调与几乎所有类型的疾病相关,包括肿瘤[24]。许多研究已经证明miRNA失调在CRC发生和发展中起重要作用[25]。目前,miRNA的预后价值和潜在的作用机制仍有待进一步研究[26]。MiR-148a-3p在结肠癌的低表达可能与结肠癌的发生与不良预后有关[27-28]。但是目前miR-148a-3p在结肠癌中的调控作用还不完全明确。在本研究中,笔者发现miR-148a-3p在结肠癌细胞系中低表达。过表达miR-148a-3p可以抑制结肠癌细胞的转移及侵袭能力,同时抑制结肠癌细胞发生上皮间质转化。荧光素报告实验结果显示SRPK2是miR-148a-3p的直接作用靶点。在结肠癌细胞中过表达miR-148a-3p可以抑制SRPK2的表达。MiR-148a-3p可能通过SRPK2来影响结肠癌的进展。
MiRNA的失调与CRC的发生发展及耐药性的产生关系密切。例如,miR-34c-5p高表达肿瘤患者预后差,可以抑制结肠癌细胞的凋亡[29]。MiR-92b-3p可以促进结肠癌细胞增殖,转移及侵袭[30]。然而,并不是所有的miRNA均表现出肿瘤促进作用,很多研究已经显示有些miRNA在抑制肿瘤过程中起到重要的作用。例如,miR-233可以抑制结肠癌的增殖及促进凋亡[31]。MiR-206可以调节结肠癌细胞对5-氟尿嘧啶的抗性[32]。MiR-153可以抑制IDO1表达从而增强CART的治疗效果。在本研究中,笔者发现miR-148a-3p在结肠癌细胞中低表达,过表达miR-148a-3p可以明显抑制结肠癌的转移及侵袭能力。同时,miR-148a-3p过表达可以抑制结肠癌细胞发生上皮间质转化。
许多研究已经证明,miRNA主要通过调控其靶基因的表达发挥调控作用。例如,miR-218可以通过靶向cFLIP诱导结肠癌细胞凋亡[33]。本研究中,笔者通过TargetScan 7.2和miRPathDB数据库预测了miR-148a-3p的潜在靶点,结果提示SRPK2是miR-148a-3p的潜在靶点。荧光素酶活性实验提示,SRPK2是miR-148a-3p的直接靶点。但是,由于miRNA可能具有多个靶点,通过作用于不同的靶点可发挥不同的生物学作用。因此miR-148a-3p在结肠癌中的作用还需要进一步的探究。
SRPK2主要参与介导哺乳动物细胞中前体mRNA剪接因子的相互作用和定位[34]。近期的研究显示,SRPK2与肿瘤的侵袭与转移相关[23,35]。但是,SRPK2在肿瘤细胞中的表达调控机制还不完全清楚。肿瘤细胞发生上皮间质转化是肿瘤发生转移的重要过程之一。为了进一步探究miR-148a-3p调控SRPK2的表达是否影响结肠癌细胞的上皮间质转化,分别上调或者下调结肠癌细胞中miR-148a-3p的表达水平。在结肠癌细胞中过表达miR-148a-3p时,SRPK2 mRNA及蛋白表达降低,肿瘤的转移及侵袭能力受抑制。相反的,结肠癌中miR-148a-3p敲低时,SRPK2 mRNA及蛋白表达增加,结肠癌细胞转移及侵袭能力增强。因此笔者推测,miR-148a-3p可能通过影响SRPK2的表达,影响结肠癌细胞的上皮间质转化。因此,进一步通过Western blot检测了结肠癌细胞中上皮标志E-cadherin及间质标志N-cadherin和Vimentin的表达。结果显示,miR-148a-3p过表达,SRPK2表达降低的同时,E-cadherin表达增加,而N-cadherin和Vimentin表达降低。相反的,miR-148a-3p敲低时,SRPK2表达增加,上皮标志E-cadherin表达降低,间质标志N-cadherin和Vimentin表达增加。这些结果提示,miR-148a-3p可能通过调节SRPK2的表达,影响结肠癌细胞的上皮间质转化,改变结肠癌细胞的迁移及侵袭能力。
综上所述,笔者发现miR-148a-3p在抑制结肠癌细胞转移及侵袭过程中起到了重要的作用,发现了miR-148a-3p调控结肠癌细胞转移及侵袭的新机制。结果显示miR-148a-3p过表达可以通过降低SRPF2表达抑制结肠癌细胞的转移及侵袭。miR-148a-3p/SRPK2可能参与结肠癌转移的调控,可能成为治疗结肠癌的新靶点。
