氧化石墨烯与淀粉样短肽相互作用的理论研究
2019-04-29谢罗刚
谢罗刚
(郑州轻工业学院 物理与电子工程学院,郑州 450001)
1 引 言
蛋白质是生物体内功能的执行者,通常在生物大分子环境中进行折叠并行使生物学功能,正确的折叠是其行使生物功能的前提和条件. 但是在适当的条件下,蛋白质会发生错误折叠并导致病理性聚集而形成淀粉样纤维[1]. 与蛋白质聚集相关的疾病大约有20多种,像阿兹海默症(Alzheimer’s disease,AD)、帕金森氏症、II型糖尿病等[2-5]. 阿兹海默症,俗称老年痴呆症,是与我们最密切相关的神经性疾病,它的病理性特征是在病人的脑组织里面出现老年斑,这些斑块主要由Aβ(Amyloid-β)组成[6]. Aβ通常具有39-42个氨基酸的缩氨酸,它的病理性聚集将导致不溶于水的淀粉样纤维的形成,进而导致疾病的发生. Aβ16-22片段对全长Aβ蛋白形成β-sheet结构起着关键作用,因为该片段包括中心疏水核(序列为LVFF)[7]. 同时,该片段也是形成与Aβ纤维类似结构的最短片段[8]. 因此,Aβ16-22是研究Aβ聚集的理想蛋白片段.
阿兹海默症等淀粉样变性病与淀粉样肽的错误折叠和聚集有关,为了解决淀粉样肽的聚集,人们一直致力于找寻抑制蛋白以及淀粉样肽聚集的抑制剂. 碳纳米颗粒容易通过血脑屏障进入人体,因而对淀粉样肽聚集的调控研究受到人们的关注. 最近的研究表明,碳纳米颗粒(富勒烯,碳纳米管和石墨烯及其衍生物)能够影响淀粉样肽的聚集以及纤维化的形成[9-14]. 氧化石墨烯(graphene oxide,GO)是典型的二维纳米材料,是石墨烯的衍生物. 氧化石墨烯的结构遵从C10O1(OH)1(COOH)0.5模式,也就是说,每20个碳原子包含2个环氧基、2个羟基、1个羧基. 其中羟基和环氧基位于GO表面上;羧基主要位于GO的边缘部分. 氧化石墨烯能够调控淀粉样肽的聚集已有诸多报道,像国家纳米中心的王琛研究组报道了在GO表面吸附病毒蛋白片段Vpr13-33,该片段结构会发生从α螺旋到β片层的转变,是诱导聚集的[15]. 但是,另外一些研究工作表明氧化石墨烯是抑制蛋白或淀粉样肽的聚集. 譬如,Mahmoudi等提出了氧化石墨烯将会对Aβ蛋白的纤维化有强烈的抑制作用[12]. 他们认为GO片层可以吸附淀粉样肽单体,能够降低溶液中蛋白浓度,进而抑制蛋白聚集. 另外,Li[16]以及Zhou[17]等研究组也相继提出了氧化石墨烯以及氧化石墨烯的衍生物能够强烈抑制Aβ33-42蛋白片段以及全长的hIAPP蛋白的淀粉样聚集. 从上面的研究结果可以看出,GO能够调控淀粉样肽的聚集,但是GO对蛋白质聚集的影响结果不相同.
分子动力学(molecular dynamics,MD)和副本交换分子动力学(replica exchange molecular dynamics,REMD)方法能够跟踪系统中各原子的运动轨迹,获得许多纳米尺度上的细节[18-21]. 目前,该方法被广泛应用于研究淀粉样肽的聚集以及蛋白质与生物小分子的相互作用[13, 14]. GO调控淀粉样肽聚集的研究主要集中在实验工作方面,相关的理论工作还比较少,GO与蛋白质间相互作用的分子机制仍不清楚,需要利用计算机模拟作进一步研究. 在本文中,我们将选择Aβ16-22为模型片段,利用REMD模拟对比研究Aβ16-22在加入石墨烯以及氧化石墨烯前后的聚集情况,找出氧化石墨烯影响淀粉样肽聚集的物理机制,为实验研究提供理论基础.
2 模型与方法
我们的模拟体系包括:Aβ16-22以及加入氧化石墨烯后的Aβ16-22+GO体系;为了对比研究,我们还考虑加入石墨烯(graphene,G)后的Aβ16-22+G体系. Aβ16-22的氨基酸序列为Ac-KLVFFAE-NH2,两端被乙酰基和氨基保护. 我们模拟的体系是中性pH值,Lys和Glu两个氨基酸的侧链分别带上正负电荷. 我们选择8条氨基酸来模拟其聚集,初始结构呈无序状态. 石墨烯和氧化石墨烯每个体系加入3片,每片碳原子选择60个(如图1所示),为了方便与之前的研究富勒烯C60调控淀粉样肽聚集的结果作对比[14]. 氧化石墨烯还包括3个羧基、6个羟基和6个环氧基,如图1所示. 每个体系都放在大小(6.8×6.8×6.8 nm3)的立方体的tip3p水模型的盒子里面,蛋白到水盒子壁的最近距离为0.9 nm. 这三个体系(Aβ16-22、Aβ16-22+G和Aβ16-22+GO)的总原子数分别为:29710,29536和29578.

图1 氧化石墨烯的结构图. (A)顶视图,(B)侧视图. 银色代表C原子,红色代表O原子,白色代表H原子Fig. 1 The chemical structure of GO molecule: (A) top view and (B) side view, carbon atoms are in silver, oxygen atoms in red, and hydrogen atoms in white.
三个体系均采用REMD[22]进行模拟,时长均为200 ns. 我们采用的是GROMACS-4.5.3程序包[23, 24],amber99sb-ildn力场以及NPT系综. 每个REMD模拟用48个副本,温度范围是从308 K到410 K之间呈指数增长. 温度耦合采用速度标度耦合方法,耦合时间为0.1 ps. 压强耦合采用Parrinello-Rahman方法,耦合时间为1.0 ps. 静电相互作用采用的是particle mesh Ewald方法,截断半径为1.0 nm. GO的力场参数平移于amber99sb-ildn力场.
分析方法主要基于GROMACS软件包里面的程序以及我们自己开发的一些程序. 结果分析时,去掉前面100 ns的数据,因此我们三个体系的数据分析都是基于后100 ns的REMD模拟. 分析的数据是在310 K温度下的副本. 利用DSSP方法,我们将对3个体系中氨基酸链的二级结构进行分析. 利用Daura团簇分析方法,对基于REMD模拟得到的构型进行分类分析,其中Cα-RMSD截断半径我们选取0.3 nm. 我们计算了Aβ16-22氨基酸链间以及Aβ16-22与GO之间的氢键相互作用以及氨基酸链间主链和主链以及侧链和侧链的相互接触几率,主要考虑两类原子对:Cα原子对之间要小于0.54 nm,其它原子对要小于0.46 nm. 本文所有的结构图都是用VMD软件画出[25].
3 结果与讨论
我们首先比较了100-150 ns和150-200 ns两个时间段内Aβ16-22、Aβ16-22+G和Aβ16-22+GO三个体系中各氨基酸二级结构(coil和β-sheet)的几率. 根据我们对二级结构的计算(如图2所示),发现coil和β-sheet是最主要的二级结构,因此在这里只给出该两种二级结构的几率,如表1所示. 通过对比我们发现,在这两个时间段内除了端部2个氨基酸外,其他各二级结构的几率变化不大,差别在0.1 % ~ 10.8 %之间. 这些数据表明我们的模拟已基本收敛.
表1 氨基酸在100-150 ns和150-200 ns两个时间段内二级结构的几率. 括号内为150-200 ns时段二级结构的几率
Table 1 The calculated secondary structure probability of each residue in the REMD runs within the time intervals of 100-150 ns and 150-200 ns (in bracket) for Aβ16-22

氨基酸Coil (%)β-sheet (%)Aβ16-22Aβ16-22+GAβ16-22+GOAβ16-22Aβ16-22+GAβ16-22+GOK160(0)0(0)0(0)0(0)0(0)0(0)L1747.90 (42.86)49.50 (46.35)70.13 (69.33)44.83 (40.77)36.43 (37.54)21.84 (21.61)V1827.48 (23.52)30.21 (28.37)48.85 (52.56)60.14 (65.51)50.33 (51.42)26.23 (24.71)F1921.70 (20.27)22.41 (24.58)45.81 (43.97)63.82 (67.30)54.21 (55.49)29.68 (29.67)F2031.90 (32.96)33.23 (32.95)55.71 (56.03)53.13 (55.35)47.55 (45.34)22.25 (25.22)A2161.46 (61.33)62.73 (61.89)80.91 (80.20)30.53 (30.57)30.21 (30.78)12.03 (14.05)E220(0)0(0)0(0)0(0)0(0)0(0)
3.1 GO对Aβ16-22八聚体二级结构的影响
图2给出了Aβ16-22、Aβ16-22+G和Aβ16-22+GO三个体系中Aβ16-22八聚体二级结构的几率,该几率是对所有氨基酸做了平均. 从图中我们可以看出,coil和β-sheet是两种最主要的二级结构,β-bridge、bend、turn和helix的几率都比较低. 纯的Aβ16-22蛋白片段,初始结构是无定型的、无规卷曲的八聚体,可以形成富含β-sheet的聚集体结构,与我们之前的结果一致[14],我们得到β-sheet的平均几率为51.19 %. 当我们在体系中添加石墨烯时,二级结构几率略有下降,β-sheet的几率由51.19 %降到43.59 %,下降了14.85 %. 当在体系中添加氧化石墨烯时,β-sheet的几率出现明显的降低,从51.19 %降到22.73 %,降低了将近56%;而coil结构的几率则由37.14 %增加到60.35 %. 值得注意的是,我们之前研究了C60对Aβ16-22聚集的影响,发现β-sheet的几率由45.20 %降到25.70 %,降低了50 %[14]. 相同的碳原子数,氧化石墨烯对Aβ16-22聚集的抑制作用略强于C60. 我们的研究结果表明,氧化石墨烯的加入对Aβ16-22中β-sheet的形成有着明显的抑制作用. 另外,β-bridge、bend、turn和helix的几率在加入石墨烯或者氧化石墨烯前后变化并不明显.

图2 Aβ16-22、Aβ16-22+G和Aβ16-22+GO三个体系中Aβ16-22八聚体二级结构几率分布图.Fig. 2 Calculated secondary structure probabilities of Aβ16-22 octamers in the absence and presence of graphene and graphene oxide nanoparticles.
我们进一步计算了Aβ16-22、Aβ16-22+G和Aβ16-22+GO三个体系中各个氨基酸的β-sheet几率,如图3所示. 我们发现,在Aβ16-22体系中,中心疏水区域L17-V18-F19-F20-A21各氨基酸的β-sheet几率为30.55 ~ 65.56 %,其中以V18和F19的几率最高,分别为62.82 %和65.56 %. 在Aβ16-22+G体系中,CHC区域各个氨基酸的β-sheet几率为30.72 ~ 54.42 %,L17-F20的几率略有下降,A21的几率不变. 当体系中加入GO后,CHC区域氨基酸的β-sheet几率下降为13.04 ~ 29.68 %,下降非常显著,降低了将近50 %. 这些结果进一步表明GO能够显著降低Aβ16-22中β-sheet形成的几率,这对淀粉样肽的聚集是不利的.
3.2 GO对Aβ16-22八聚体三级结构的影响
为了研究GO对Aβ16-22形成的聚集体结构影响,我们对50,000个构象做了基于RMSD的结构类聚法分析,其中,Cα-RMSD截断半径取0.3 nm. 对这三个体系进行分析,我们得到Aβ16-22、Aβ16-22+G和Aβ16-22+GO体系分别有201、227和272个类结构. 图4分别给出了三个体系前六个几率最高的团簇的中心结构以及他们的几率. 这六个团簇分别占据了这三个体系所有构型的32.5 %,46.5 %和34.3 %. 从图中我们可以看到,在纯的Aβ16-22体系中,团簇主要呈现各种有序以及无序的富含β-sheet的结构.

图3 Aβ16-22、Aβ16-22+G和Aβ16-22+GO三个体系中各个氨基酸的β-sheet几率分布图.Fig. 3 Calculated β-sheet probability of each residue of Aβ16-22 octamers in the absence and presence of graphene and graphene oxide nanoparticles.

图4 Aβ16-22八聚体在加入石墨烯和氧化石墨烯前后平衡态下的构型,取前6个几率最高的团簇构型并给出相应的几率.Fig. 4 Representative conformations of the top six most-populated clusters for the Aβ16-22 octamers in the absence and presence of graphene and graphene oxide nanoparticles.
有趣的是,当体系中加入石墨烯后,石墨烯初始是无序地分布在水盒子里面,当进行200 ns的副本交换分子动力学模拟后,3片石墨烯则面对面对齐排列在一起,周围包裹着Aβ16-22聚集体,如图4中间所示. 我们知道,纯的石墨烯是高疏水性分子,能够与蛋白片段Aβ16-22中的疏水氨基酸(L17-A21)发生疏水相互作用. 但是需要注意的是,高疏水的石墨烯片层结构在水溶液中自身容易发生团聚,这样就会减少与Aβ16-22蛋白片段氨基酸的接触面积,进而会弱化与Aβ16-22蛋白的相互作用. 因此,石墨烯对Aβ16-22蛋白聚集的影响很有限,与我们前面对二级结构的分析结果一致. 当体系中加入GO后,我们发现Aβ16-22主要以无定型状态存在,从图4下可以看出聚集体主要包含无序的氨基酸链以及一些二聚体和三聚体. 这些结果表明,GO能够使Aβ16-22八聚体从富含β-sheet的结构向无序状聚集体结构转变,从而影响淀粉样肽的聚集.
3.3 GO与Aβ16-22蛋白片段间的氢键相互作用
通过对二级结构以及三级结构分析,我们发现石墨烯对淀粉样肽Aβ16-22片段聚集的影响很有限. 因此,在这里我们将主要研究Aβ16-22+GO体系中GO与Aβ16-22-氨基酸链间的相互作用. 相比石墨烯,氧化石墨烯表面有3类极性基团,包括羟基,羧基和环氧基,很容易与Aβ16-22蛋白片段的主链以及部分侧链形成氢键. 图5给出了Aβ16-22和Aβ16-22+GO体系中,氨基酸链间(Aβ-Aβ)以及氨基酸链与GO之间(Aβ-GO)的氢键数目(包括主链和侧链)的几率密度分布. 我们发现和Aβ16-22体系相比,氨基酸链间Aβ-Aβ的氢键数目在Aβ16-22+GO体系中有着明显的降低,从27降到14. 其中很重要的原因就是Aβ16-22氨基酸链与GO形成多达20个氢键. Aβ-GO之间的氢键作用很明显将与氨基酸链间的氢键相互作用产生竞争,进而破坏Aβ16-22聚集体的氢键网络,最终达到抑制淀粉样肽Aβ16-22聚集的目的.
我们进一步计算了Aβ16-22和Aβ16-22+GO体系中不同氨基酸链间主链-主链以及侧链-侧链间的接触几率,如图6所示. 我们发现两个体系呈现不同的链间作用模式,表明氧化石墨烯对链间相互作用有重要的影响. 图6(A和C)给出了Aβ16-22体系中八聚体各氨基酸主链和侧链的接触几率图. 主链间主要相互作用对包括:V18-V18、V18-F19和F19-F19,接触几率分别是8.92 %、8.94 %和7.83 %. 侧链间的主要相互作用对包括:L17-F19、F19-F19和F19-F20,接触几率分别是11.19 %、11.68 %和10.64 %. 图6(A)中,接触几率比较高的地方是沿左对角线方向,该结果表明氨基酸链间排列将主要以反平行堆积为主,该结果与之前实验报道的Aβ16-22氨基酸链形成反平行对齐的堆积模式的结论一致[8]. 当体系中加入GO纳米颗粒时,我们发现尽管氨基酸链间仍然采用反平行的排列模式,但是氨基酸间的接触几率明显降低,如图6(B)和(D)所示. 稳定主链间相互作用的氨基酸对的接触几率不高于4.75 %,稳定侧链间相互作用的氨基酸对的接触几率不超过6.5 %,与Aβ16-22体系相比,接触几率下降了50 %. 我们的计算结果表明,氧化石墨烯颗粒极大地弱化了氨基酸间的相互作用,特别是对β-sheet的形成以及Aβ16-22的纤维化形成有重要作用的氨基酸对,进而抑制Aβ16-22淀粉样肽的聚集.
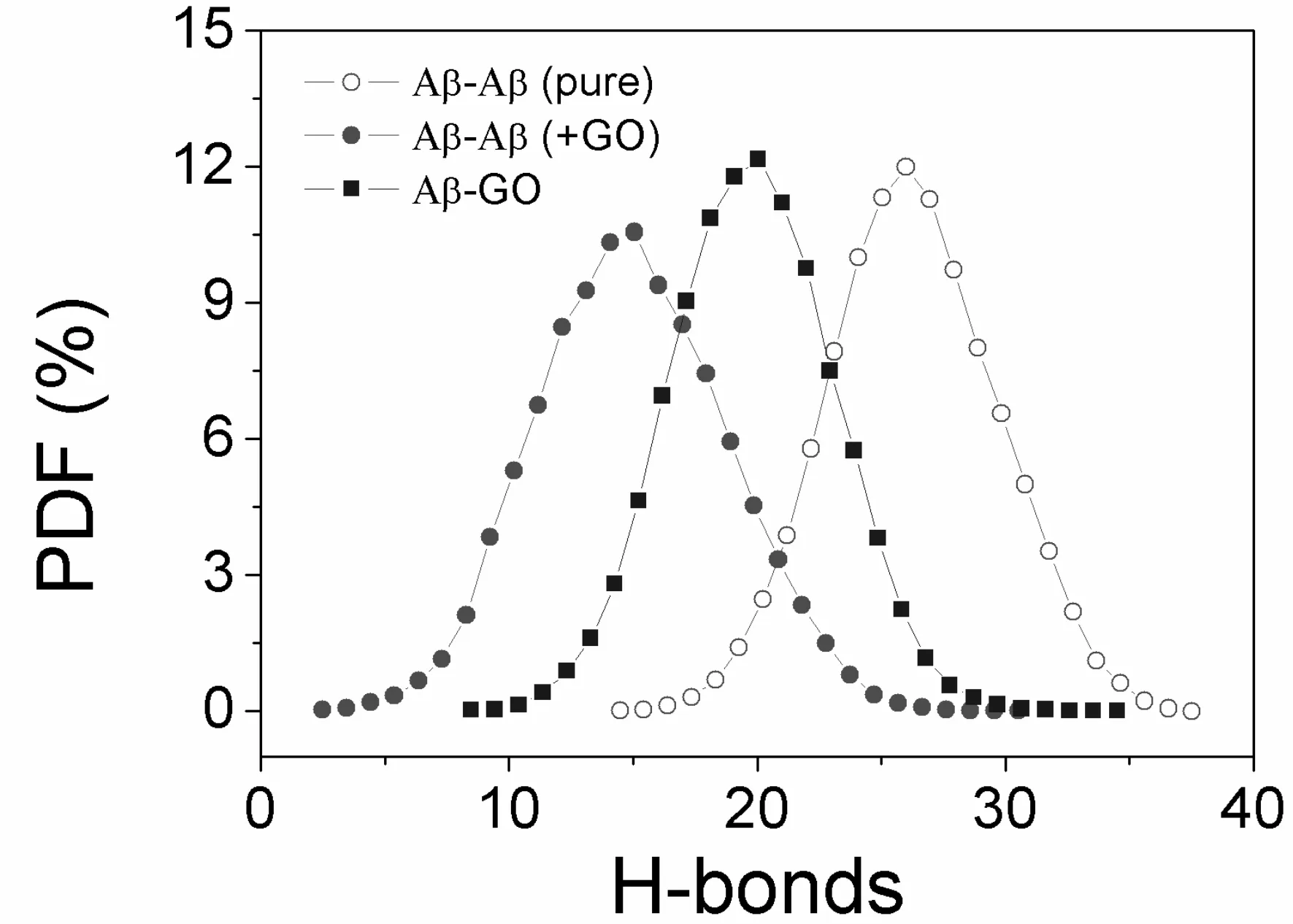
图5 加入GO前后,氨基酸链间(Aβ-Aβ)以及氨基酸链与GO间(Aβ-GO)氢键数目的几率密度分布.Fig. 5 Probability distribution functions (PDF) of the number of H-bonds for Aβ16-22 octamers (Aβ-Aβ) and between Aβ16-22 and GO (Aβ-GO) in the absence and presence of GO nanoparticles.

图6 Aβ16-22(A和 C)和Aβ16-22+GO(B和 D)体系中各氨基酸主链以及侧链间接触几率图.Fig. 6 Main chain - main chain and side chain - side chain contact probability maps for Aβ16-22 octamers in the absence (A and C) and presence (B and D) of GO nanoparticles.
4 结 论
利用副本交换分子动力学模拟方法,我们研究了Aβ16-22八聚体在加入石墨烯和氧化石墨烯前后的聚集情况. 我们的研究结果包括如下:(1)纯的Aβ16-22八聚体会形成富含β-sheet的聚集体结构,与我们之前的模拟结果一致;(2)石墨烯对淀粉样肽Aβ16-22片段聚集的影响很有限,主要原因是石墨烯在水溶液中容易发生团聚,这将大大减少与蛋白片段中氨基酸的接触面积,弱化了对淀粉样肽聚集的影响;(3)氧化石墨烯对Aβ16-22片段的聚集具有很强的抑制作用,主要原因是氧化石墨烯与Aβ16-22蛋白片段中的氨基酸间的疏水相互作用以及氧化石墨烯表面的极性基团与Aβ16-22形成的氢键作用将大大地弱化了Aβ16-22氨基酸链间的相互作用,最终抑制Aβ16-22的纤维化. 我们的研究结果将为找寻抑制淀粉样肽聚集的抑制剂提供理论帮助.
