常压室温等离子体诱变选育DHA高产菌株
2019-04-29龚定芳熊祎楠孙佼文史仲平
龚定芳,熊祎楠,孙佼文,史仲平
(江南大学生物工程学院,工业生物技术教育部重点实验室,江苏 无锡 214122)
二十二碳六烯酸(DHA)是一种重要的ω-3系列多不饱和脂肪酸,对智力和视网膜的发育有重要影响[1]。研究表明DHA能抑制癌细胞增殖、抵御炎症、预防心血管疾病,同时还具有抗皱保湿、防衰老等作用[2]。传统的深海鱼油DHA受到季节限制、环境影响,产品性质不稳定且带有鱼腥味[3]。裂殖壶菌是一种海洋真菌,因DHA含量高、生长速度快、易于培养、无毒无污染等诸多优点而成为当下研究的热点。野生型裂殖壶菌的DHA产量较低,难以满足工业化需求。诱变育种是筛选优良菌种的主要手段。
常压室温等离子体(ARTP)诱变通过释放活性粒子,作用于微生物的细胞壁或细胞膜,使其结构和通透性发生变化,引起基因损伤致使突变[4]。与传统诱变方法相比,ARTP诱变育种具有突变率高、操作简便、成本低、无毒无害等优点。袁军等[5]通过ARTP诱变,2,2′- 联吡啶平板筛选成功获得高产 DHA 的菌株,DHA产量达到7.31 g/L,比初始菌株提升了29.8%。
本文以裂殖壶菌SR21为出发菌株,利用ARTP诱变,结合丙二酸、碘乙酸及丙二酸-碘乙酸混合平板的方式进行筛选,并以摇瓶培养的方式考察突变株积累DHA的水平,以期获得一株高产DHA的菌株。
1 材料与方法
1.1 实验材料
裂殖壶菌菌株(SchizochytriumlimacinumSR21):购自美国菌种保藏中心(ATCC),-80℃保存于ATCC By+790培养基中。活化培养基:ATCC By+790固体培养基。种子培养基:葡萄糖 30 g/L,酵母粉6 g/L,鱼粉蛋白胨6 g/L,pH自然,121℃灭菌15 min。发酵培养基:参考文献[6]配制。
1.2 实验方法
1.2.1 菌种培养
将保藏于-80℃条件下的菌种转接于菌种活化平板上,25℃条件下培养3 d。接种环刮取一环,接入装有50 mL种子培养基的250 mL三角瓶,25℃、200 r/min摇床培养48 h。以10%的接种量接种到装有50 mL发酵培养基的250 mL三角瓶中,摇瓶发酵120 h。
1.2.2 生物量及葡萄糖质量浓度的测定
参考文献[7]测定生物量及葡萄糖质量浓度。
1.2.3 油脂提取
油脂提取:准确称取0.05 g菌体于10 mL具塞玻璃试管中,加入1.5 mL蒸馏水,混匀后加入2 mL盐酸;65℃水浴至菌体完全消化,冷却至室温后加入2 mL正己烷-乙醇(2∶1)溶液,摇匀后静置分层,取上层有机相转移至新的10 mL玻璃试管中,试管提前称重,用正己烷-乙醇溶液重复洗涤3次,将有机相合并后,充氮去除溶剂,得到油脂。
1.2.4 脂肪酸组成分析
脂肪酸甲酯化:参照文献[8]。向待测油脂样品中加入內标物1 mg/mL十九烷酸1 mL,加入0.5 mol/L NaOH-CH3OH溶液1 mL,60℃水浴振荡至油珠完全溶解,冷却后加入14% BF3-乙醚溶液2 mL,60℃水浴酯化20 min,冷却后加入2 mL正己烷,振摇,涡旋2 min,加入2 mL饱和NaCl溶液振摇,静置。取1 mL上层有机相于1.5 mL EP管中,加入少许无水Na2SO4以除去微量的水,离心后将样品稀释25倍后装于棕色瓶待测。
利用气相色谱(日本岛津GC-2010PLUS)对脂肪酸进行定量分析,色谱柱Rtx-WAX(30 m×0.32 mm×0.25 μm),色谱测定条件参照文献[7] 。
1.2.5 单细胞菌悬液的制备及ARTP诱变
将培养至对数期的菌体接种到铺有20颗玻璃珠的250 mL三角瓶中,装液量为50 mL, 25℃、200 r/min 振荡培养20 min,四层擦镜纸过滤得到单细胞菌悬液。稀释一定倍数,使其菌浓度在105~106CFU/mL之间。
将10 μL单细胞菌悬液均匀涂布在金属载片的上表面,用镊子将载片转移至载物台。ARTP诱变设置参数如下:功率100 W,气流量10 L/min,照射时间依次为 0(对照)、5、10、15、20、25、30 s。处理后将载片转移到装有1 mL生理盐水的EP管中,振荡洗脱形成新的菌悬液,涂布平板后25℃培养3 d后对平板菌落进行计数,计算致死率。致死率=(未经诱变处理菌落数-经诱变处理菌落数)/未经诱变菌落数×100%。每组3个平行。
将诱变处理后的菌液转移到装有1 mL生理盐水的EP 管中,振荡洗脱形成新的菌悬液,稀释一定倍数,取100 μL菌浓度在105~106CFU/mL之间的菌液涂布于加入一定质量浓度丙二酸、碘乙酸、丙二酸-碘乙酸混合的筛选平板后25℃培养3 d,挑选出生长良好的单菌落进行扩大培养,然后按照1.2.1所述进行摇瓶发酵,并测定DHA产量。
2 结果与讨论
2.1 原始菌株的生长特性
为确定裂殖壶菌SR21对数期时间,每6 h取4 mL培养液,8 000 r/min离心5 min洗涤获得菌体,冻干至恒重。以生物量为纵坐标,绘制生长曲线如图1 所示。
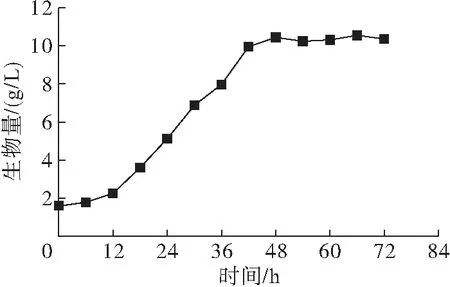
图1 裂殖壶菌SR21生长曲线
从图1可以看出,菌体在培养12 h后进入快速生长阶段,48 h之后逐渐进入稳定期。
为确定最佳种龄,选择对数期中后期几个时间点的种子液接入摇瓶,进行摇瓶培养,并测定最终的生物量、油脂总量及DHA产量,结果见表1。
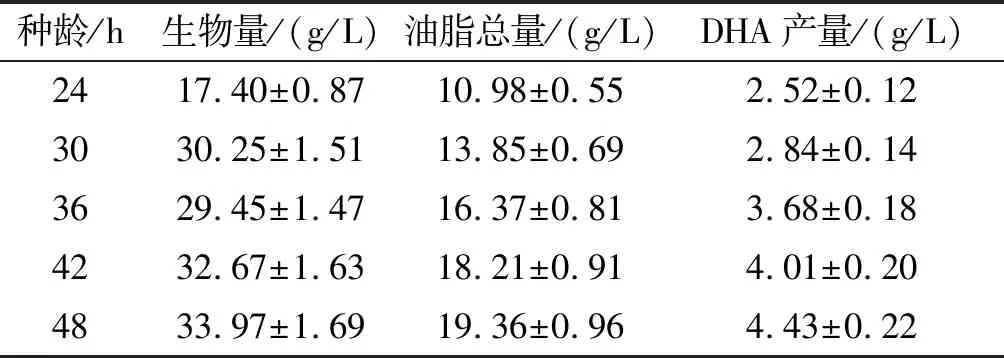
表1 种龄对裂殖壶菌SR21发酵生产DHA的影响
从表1可以看出,种龄为48 h时,生物量、油脂总量和DHA产量均最高。因此,在后续的研究中种子的培养时间确定为48 h。
以48 h为种龄,对原始菌株进行摇瓶培养,研究其细胞生长、底物消耗及产物合成特性。每隔12 h采集 一次发酵液样品,测定生物量、残糖以及DHA产量,结果如图2所示。
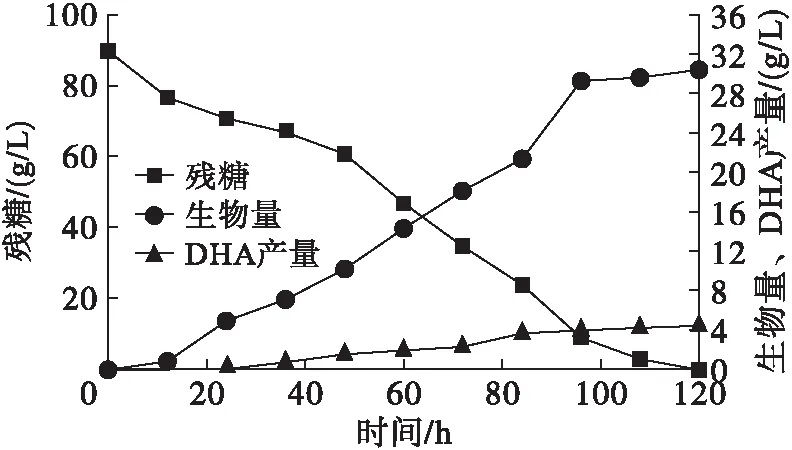
图2 残糖、生物量及DHA产量随培养时间的变化曲线
从图2可以看出,葡萄糖在120 h时全部耗尽,此时的生物量和DHA产量分别达到30.48、4.51 g/L。以这一批次的摇瓶培养实验作为后续诱变和筛菌研究的对照批次,该批次油脂总量为19.36 g/L,并确定后续研究中的摇瓶培养周期为120 h。
2.2 ARTP诱变时间的确定
ARTP诱变是一种新型的诱变方式,目前广泛地应用于微生物诱变育种。程功等[9]利用ARTP选育L-高精氨酸和8-氮鸟嘌呤抗性菌株,该菌株的L-精 氨酸产量比出发菌株提高了49.79%。ARTP诱变处理时间不同,菌株的突变率也不一样。在不同的诱变时间下,分析菌体的致死率,结果如图3所示。
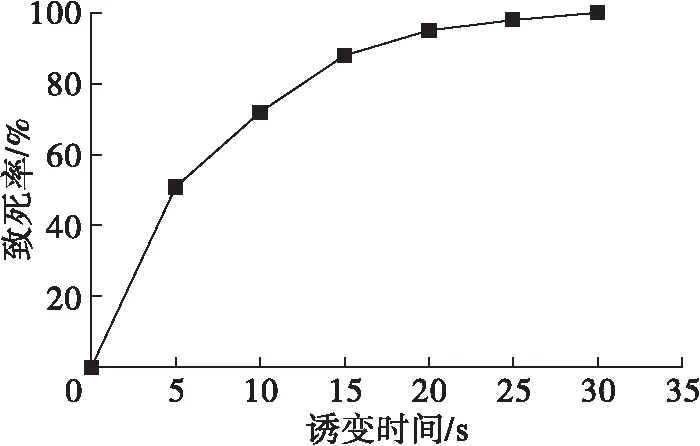
图3 ARTP不同诱变时间下菌体的致死率
从图3可以看出,在0~15 s内,随着诱变时间的延长,致死率快速增加,15 s后随着诱变时间的延长致死率增加缓慢。当诱变时间达到30 s时,致死率达到100%。据文献[10]报道,当致死率处于85%~95%之间时,可获得较高的正突变率。诱变时间为15 s时,致死率为88%,因此选用15 s作为后续诱变的处理时间。
2.3 筛选条件的确定
2.3.1 丙二酸筛选
丙二酸是琥珀酸脱氢酶抑制剂,能够抑制三羧酸循环,造成柠檬酸的大量积累。所积累的柠檬酸能够在柠檬酸裂解酶的作用下生成乙酰-CoA,为脂肪酸的合成提供更多前体物质[11]。将诱变后菌株涂布在添加有不同质量浓度丙二酸平板上,25℃条件下培养3 d,菌株的生长情况如表2所示。

表2 诱变后菌株在不同丙二酸质量浓度平板上的生长情况
注:+.菌落个数在10~25之间;+/-.菌落个数在1~10之间;-.不生长。下同。
从表2可以看出,当丙二酸质量浓度为1.4 g/L时,菌体生长完全被抑制,因此选取1.2 g/L作为筛选平板中丙二酸的添加质量浓度。
2.3.2 碘乙酸筛选
碘乙酸能够不可逆地抑制脂肪酸合成酶和磷酸甘油醛脱氢酶,从而抑制EMP途径。经过诱变的菌株,只有少数变异的细胞具有较强的 HMP,能够在EMP途径受到抑制后,依靠HMP途径存活下来。因此,具有碘乙酸抗性的菌株有较强的HMP途径,能够提供更多的NADPH,促进脂肪酸的合成,有益于DHA的积累[12]。将诱变后菌株涂布在添加有不同质量浓度碘乙酸平板上,25℃条件下培养3 d,菌株的生长情况如表3所示。

表3 诱变后菌株在不同碘乙酸质量浓度平板上的生长情况
从表3可以看出,当碘乙酸质量浓度为0.14 g/L 时,菌体生长完全被抑制,因此选取筛选平板中碘乙酸的质量浓度为0.12 g/L。
2.3.3 复合筛选
有研究表明,复合因子筛选平板根据双重作用可以提高筛选效率[13]。对混合筛选平板中丙二酸和碘乙酸的质量浓度进行了研究,组合方式及裂殖壶菌SR21的生长情况如表4所示。
从表4可以看出,在2号和4号平板中菌体致死率均较高,对2号筛选平板和4号筛选平板上的菌落数进行计数,发现2号平板中的致死率略高于4号。因此,可以确定2号平板的组合为混合平板最佳的组合方式,即碘乙酸质量浓度为0.06 g/L,丙二酸质量浓度为0.4 g/L。
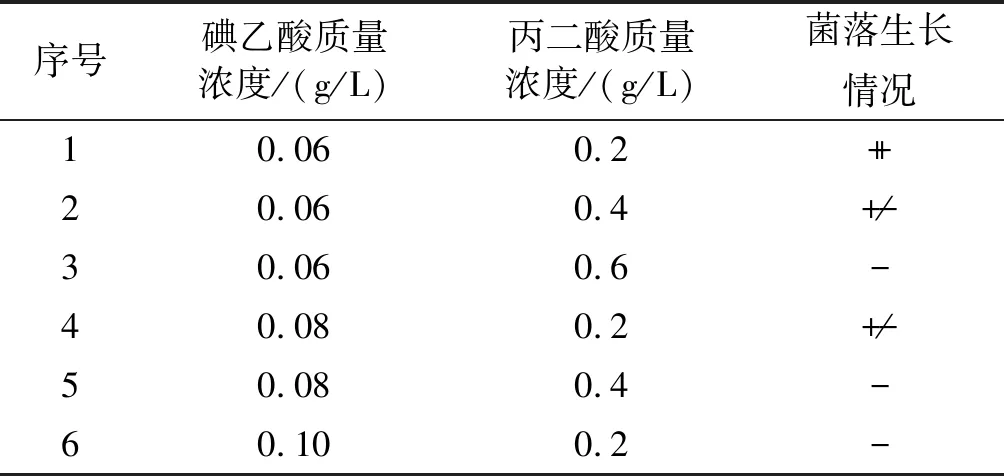
表4 诱变后菌株在不同质量浓度丙二酸-碘乙酸复合筛选平板上的生长情况
2.4 诱变选育
利用上述3种平板(1.2 g/L丙二酸筛选平板、0.12 g/L碘乙酸筛选平板和0.4 g/L丙二酸-0.06 g/L碘乙酸混合筛选平板)筛选后,共获得27株突变株,其中利用丙二酸筛选得到的8株突变株依次命名为NA1~NA8,利用碘乙酸平板筛选获得的8株突变株依次命名为NB1~NB8,利用丙二酸-碘乙酸混合平板筛选得到的11株突变株依次命名为NC1~NC11。测定所有诱变菌株经120 h摇瓶发酵后的生物量、油脂总量及DHA产量,结果如图4所示。
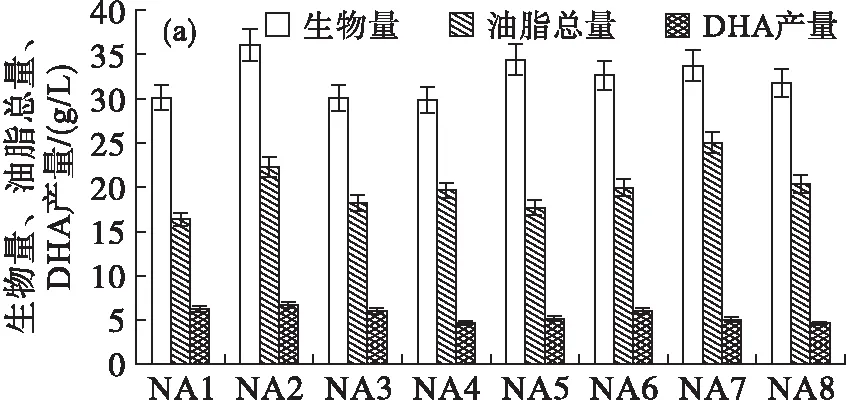
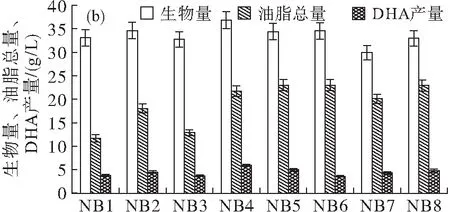
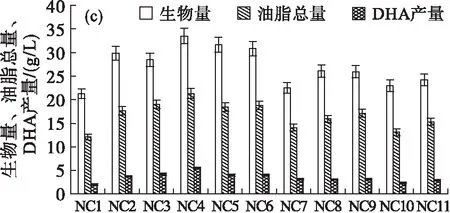
图4 诱变菌株经120 h摇瓶发酵后的生物量、
从图4可以看出:NA1~NA8经摇瓶培养后生物量差异较小,DHA产量相对较高的3株为NA1、NA2和NA3(图4(a)); NB1~NB8的生物量差异也较小,DHA产量相对较高的3株为NB4、NB5和NB8(图4(b));NC1~NC11的生物量存在较大差异,DHA产量相对较高的3株为NC3、NC4和NC6(图4(c))。
本实验选取了每个筛选批次中DHA产量较高的3株菌,比较其发酵特性,结果如表5所示。

表5 不同筛选方法DHA产量比较
从表5可以看出,丙二酸抗性菌株、碘乙酸抗性菌株和丙二酸-碘乙酸复合抗性菌株的平均DHA产量与出发菌株相比,分别提高了37.92%、14.41%、7.76%。单一筛选平板选育的菌株其生物量相对稳定,且诱变的效果更好,其中丙二酸筛选法对提高DHA的产量有更为明显的效果。最佳的混合筛选平板质量浓度并不是丙二酸筛选质量浓度与碘乙酸筛选质量浓度的简单结合,这说明复合筛选平板具有的双重筛选能力具有更强的致死效应,致死率过高,往往产生的负突变更多,这可能是复合筛选平板效果并不理想的原因。本实验最终确定以DHA产量最高的NA2作为后续研究的出发菌株。
2.5 遗传稳定性
对菌株NA2进行连续传代培养(即将平板上活化的菌落接种到另一个平板上进行培养的过程,转接一次为一代,以此类推),以4℃冰箱保存且生长良好的第二代菌株为对照,连续传代5次。对每一代菌株进行摇瓶培养,DHA产量如表6所示。
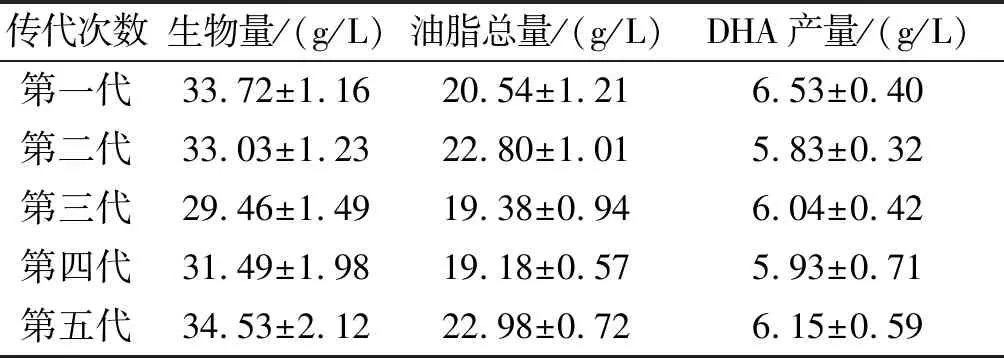
表6 NA2传代5次的测定结果
从表6可以看出,DHA产量并没有随着传代次数的增加而出现明显的下降趋势,因此可以证明突变株NA2具有良好的遗传稳定性。
3 结 论
以裂殖壶菌SR21为出发菌株,经ARTP诱变15 s,稀释一定倍数,使其菌浓度在105~106CFU/mL之间,取100 μL涂布于1.2 g/L丙二酸筛选平板上,摇瓶发酵120 h后测定诱变株的生物量、油脂总量、DHA产量。最终获得突变株NA2,其生物量、油脂总量、DHA产量达到36.00、22.24、6.59 g/L,与原始菌株相比分别提高18.11%、14.87%和46.12%。传代5次后,NA2遗传性状稳定。
