不同抗旱类型胡麻幼苗对干旱胁迫的生理响应
2019-04-29吴瑞香杨建春王利琴郭秀娟
吴瑞香,杨建春,王利琴,郭秀娟
(山西省农业科学院 高寒区作物研究所,山西 大同 037008)
水资源短缺是全球公认的环境和资源问题之一,同时也是限制农业生产的主要非生物逆境因子之一[1]。全世界约有36%的土地为干旱、半干旱地区,占农耕地的43%。我国情况也不容乐观,全国土地总面积的1/2表现出不同程度的干旱,主要位于华北和西北各地[2]。随着近年来气候的恶性变化,干旱程度仍在不断加重。山西省是华北地区干旱最严重的省份之一,尤其是春旱、伏旱严重,已严重影响了农业生产,作物的产量和品质严重降低,影响了该区域农作物的高产、稳产以及种植结构。国内外除采用开辟水源和节水灌溉以提高水分利用率外,研究改变栽培措施和培育抗旱作物品种抵抗干旱胁迫的不利影响已成为学者们关注的热点问题[3]。
胡麻(LinumusitatissimumL.)即油用亚麻,属亚麻科亚麻属1年或多年生草本植物,是我国西北和华北高原高寒干旱区的主要油料作物,也是干旱、半干旱地区的主要经济作物,主要分布于新疆、宁夏、甘肃、山西、河北、内蒙古等省份[4],这些地区年降水量一般在400~500 mm,少数重干旱生态区降水量只有200~300 mm[5],加上地下水资源缺乏,严重限制了作物的生产。胡麻具有较强的耐旱、耐寒、耐瘠薄能力,且生长周期短、适应性强,加上其营养价值丰富,在人们的日常生活及工业生产中占有重要的地位,也是北方干旱地区重要的食用油来源[6-7]。
国内外学者就小麦、玉米、大豆、高粱等农作物[8-16]以及果树对干旱胁迫的响应及其抗旱生理生化机制已进行了大量的研究。干旱胁迫下,作物一般表现植株矮小、叶片数减少、叶面积下降、产量和品质降低,渗透调节物质脯氨酸(Pro)含量、可溶性蛋白含量增加,膜脂过氧化产物丙二醛(MDA)含量、质膜透性增加,抗氧化酶POD、SOD活性加大,但不同抗旱类型胡麻间变化不尽相同,不同的品种(系)由于其自身的遗传基础等因素,对干旱的适应性反应在生理变化上面存在一定差异。
本试验采用盆栽法,人工控水模拟干旱胁迫环境,研究了干旱胁迫下抗旱性存在明显差异的4个胡麻品种生理生化变化,以初步探讨胡麻幼苗在干旱处理条件下的表型变化以及生理响应机制,旨为深入研究胡麻抗旱的生理和分子机制奠定基础,为胡麻抗旱品种选育及抗旱栽培提供理论依据。
1 材料和方法
1.1 试验材料
供试材料由山西省农业科学院高寒区作物研究所提供,分别是晋亚7号、晋亚10号、晋亚11号、E051-20共4个胡麻品种,其中,抗旱性大小为晋亚7号>晋亚10号>晋亚11号>E051-20。
1.2 试验设计
试验于2017-2018年在山西省农业科学院高寒区作物研究所试验基地进行。选取颗粒饱满、大小一致的种子,播种于塑料花盆中,花盆口内径为24 cm,盆底内径16.5 cm,深18 cm,盆内装有大田过筛壤土(孔径1 cm)与蛭石体积比为3∶1的基质,配施250 g有机肥,混合搅拌均匀。每天浇水保持基质湿润,待4片真叶展开后进行第1次间苗,7~8片真叶时进行定苗,每盆保苗50株。10片真叶时于每天18:00进行控水处理。试验共设3个处理:CK. 适宜水分,为田间最大持水量的70%~75%; MD. 中度胁迫,为田间最大持水量的55%~60%;SD. 重度胁迫,为田间最大持水量的40%~45%。田间最大持水量为24.11%。每个处理重复3次,胁迫处理开始后,每隔5 d取叶片测定一次生理指标,每次取植株上部心叶以下部分功能叶进行测定处理,胁迫20 d后每重复取10株幼苗测定生长指标。
1.3 测定指标及方法
1.3.1 生长指标测定 参照《亚麻种质资源规范和数据标准》中的相关规定[17],测定株高、茎粗、叶片数、根长等生长指标,并对整个植株在110 ℃下杀青10 min后在80 ℃下烘干15 h至恒质量,得出植株干质量表示生物量,同时通过公式计算叶片相对含水量。
叶片相对含水量=(叶片鲜质量-叶片干质量)/(饱和鲜质量-叶片干质量)×100%
1.3.2 生理指标测定 质膜透性采用电导率仪测定[18];可溶性蛋白含量测定采用考马斯亮蓝染色法[19];Pro含量测定采用水浴浸提法[18];MDA含量测定采用硫代巴比妥酸法[20];POD活性测定采用愈创木酚法[21]。
1.4 数据统计分析
数据采用Excel 2010软件进行整理和作图,采用SPSS 18.0软件进行方差分析及相关性分析。
2 结果与分析
2.1 干旱胁迫对胡麻幼苗生长的影响
方差分析表明,随浇水量的减少,4个胡麻品种幼苗的株高、茎粗、生物量、叶片相对含水量均显著降低(表1)。与CK相比,MD处理下的株高、茎粗、生物量及叶片相对含水量晋亚7号的降幅分别为14.31%,10.88%,16.81%和1.63百分点,晋亚10号的降幅分别为19.61%,12.62%,16.59%和0.80百分点,晋亚11号的降幅分别为21.21%,12.77%,29.78%和3.77百分点,E051-20的降幅分别为24.20%,19.32%,35.02%和8.16百分点;SD处理下株高、茎粗、生物量及叶片相对含水量晋亚7号的降幅分别为33.51%,21.90%,46.98%和6.73百分点,晋亚10号的降幅分别为49.27%,32.54%,50.22%和7.62百分点,晋亚11号的降幅分别为47.55%,32.61%,60.44%和9.72百分点,E051-20的降幅分别为56.85%,35.80%,70.05%和15.52百分点。其中,晋亚7号无论是MD还是SD处理下降幅度均比其他3个品种小,E051-20在MD和SD这2个处理下降幅均较其他3个品种大。说明干旱胁迫能够抑制植株的生长,特别是重度胁迫严重抑制了胡麻植株的形态生长,抑制了胡麻的生物量积累,使植株含水量也明显降低,但是抗旱性强的品种受胁迫的影响较低,降幅较小,说明抗旱性强的品种能够有效地保持细胞中的自由水含量,促进植株生物量的积累。在生长指标方面最直观的表现就是株高和茎粗的降低。

表1 干旱胁迫对胡麻幼苗形态指标的影响Tab.1 The effect of drought stress on the morphological indexes of the seedlings of flax
注:不同小写字母表示处理间差异显著(P<0.05)。图1-5同。
Note: Different small letters show significant difference among treatments (P<0.05). The same as Fig.1-5.
2.2 干旱胁迫对胡麻幼苗膜脂过氧化的影响
从图1可以看出,与CK相比晋亚7号的MDA含量在MD处理下随着时间的延长上升幅度变化不大,在SD处理下呈上升趋势,但在15 d时涨幅均有所下降,在20 d时涨幅分别为10.67%,38.10%;晋亚10号在胁迫20 d时涨幅分别为17.10%,45.89%;晋亚11号在胁迫20 d时的涨幅分别为17.8%,54.85%;晋亚10号、晋亚11号在MD处理下涨幅基本一致,在SD处理下,晋亚11号涨幅略高于晋亚10号,而E051-20不论是MD还是SD处理下,涨幅均呈现先增加后降低的趋势,在MD处理下,15 d时涨幅达到最高为30.25%,SD处理下,10 d时涨幅达到峰值为80.64%,在20 d时的涨幅分别为26.51%,58.15%;在胁迫的每一个时期E051-20的涨幅均大于其他3个品种,且远远大于晋亚7号。在MD处理下,晋亚10号和晋亚11号降幅相似,而在SD处理下,晋亚11号又和E051-20的降幅差不多,说明晋亚11号在中度胁迫下,抗性较强,而在重度胁迫下,抗性较差。除晋亚7号外,其余3个品系的MDA含量均随胁迫程度的增加而显著增加,且MDA含量有随胁迫时间延长总体呈现增加的趋势。
从图2可以看出,质膜透性随胁迫时间的变化不同品系表现不同。在MD处理下,晋亚7号和晋亚10号上涨幅度呈现交替上升的趋势,20 d时的涨幅分别为3.03,3.55百分点;晋亚11号和晋亚10号的涨幅基本一致,20 d时涨幅为3.88百分点;E051-20呈明显上涨趋势,20 d时涨幅达到5.99百分点;而在SD处理下,晋亚7号、晋亚10号与晋亚11号均在10 d时达到最大涨幅,分别为7.49,8.01,9.40百分点,20 d时的涨幅分别为5.91,5.73,9.34百分点;E051-20呈大幅上涨趋势,在15 d时到达高峰,涨幅为13.79百分点,20 d时的涨幅为9.80百分点;随胁迫时间的增加,总体均呈上涨趋势,MD处理下,晋亚7号涨幅最小,E051-20最大,而晋亚10号与晋亚11号相差不多。SD处理下,E051-20涨幅最大,晋亚11号次之,晋亚7号和晋亚10号差不多,涨幅较小。说明干旱胁迫对胡麻造成了膜脂过氧化伤害,严重破坏了细胞膜的结构,其中,E051-20的细胞膜受损最严重,晋亚11号次之,晋亚7号和晋亚10号受损最小。
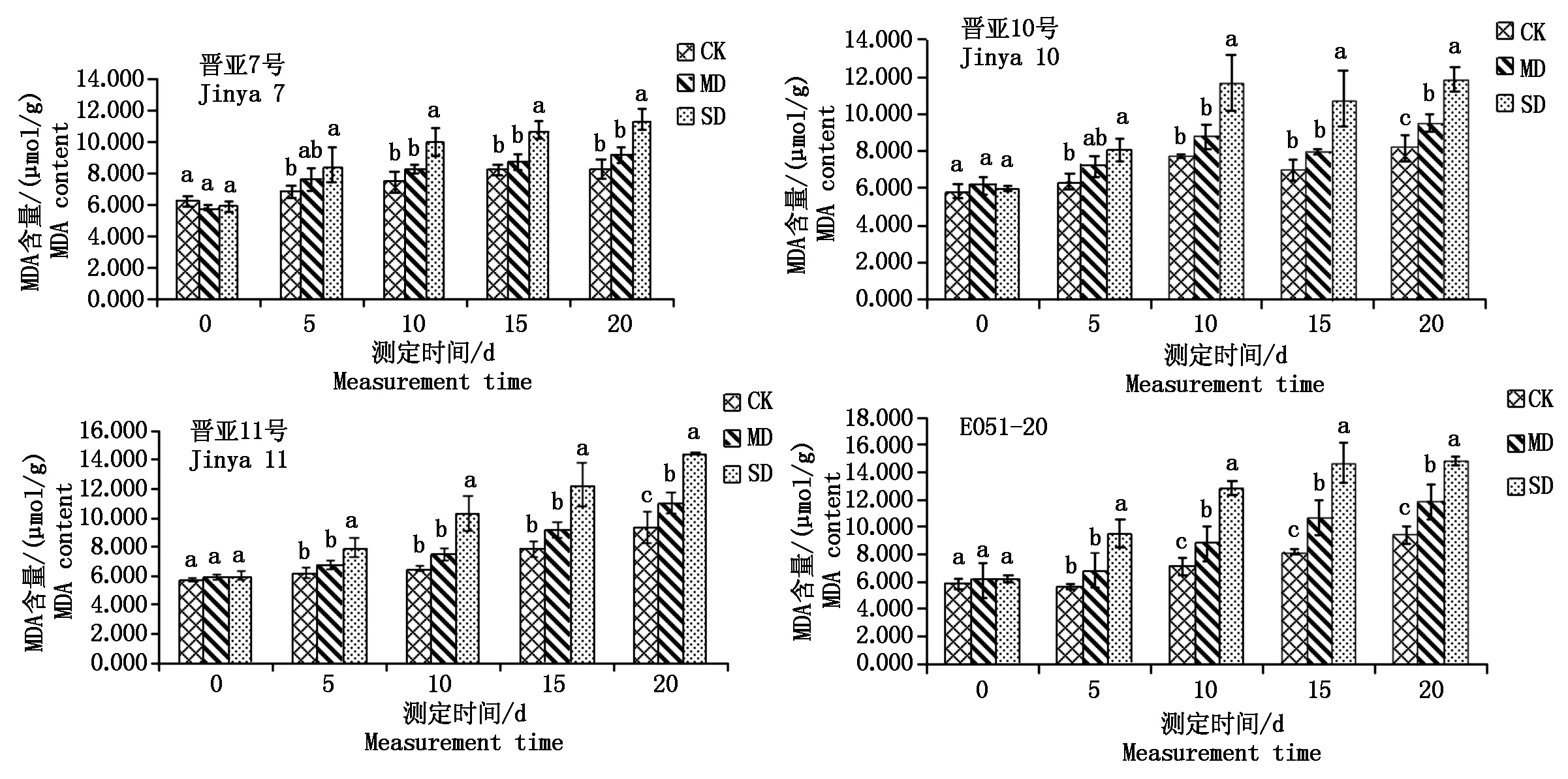
图1 干旱胁迫对MDA含量的影响Fig.1 Effects of drought stress on MDA content of leaves

图2 干旱胁迫对质膜透性的影响Fig.2 Effects of drought stress on relative electric conductivity of leaves
2.3 干旱胁迫对胡麻幼苗有机渗透调节物质含量的影响
从图3可以看出,4个品系的可溶性蛋白质含量在前10 d没有明显的变化,均保持相对稳定。在胁迫15 d时不论是MD还是SD处理,可溶性蛋白质含量均有所增加,其中,晋亚10号的增加量最高,为17.56%,31.37%;晋亚7号次之,为5.57%,8.83%;晋亚11号增加3.55%,1.81%;E051-20增加5.66%,0.01%。胁迫20 d时,MD处理下晋亚10号增加18.34%,其次是晋亚11号增加16.44%,晋亚7号增加9.19%,E051-20下降2.64%;SD处理下,晋亚10号增加38.75%,其次是晋亚7号增加19.34%,晋亚11号增加8.76%;E051-20下降14.82%,但从方差分析来看,除晋亚10号在胁迫结束时不同处理间差异显著外,其他品种(系)处理间差异均不显著。认为可溶性蛋白质的变化对胡麻干旱胁迫下的渗透调节几乎不起作用。
图4结果显示,随干旱胁迫程度的增加,胡麻叶片Pro含量显著增加,其中,在 MD处理下,晋亚7号和晋亚10号在10 d时出现最大涨幅,分别是393.97%,196.49%;在SD处理下,最大涨幅仍在10 d时出现,分别是652.4%,327.10%。胁迫20 d时晋亚7号和晋亚10号在MD处理下涨幅分别为178.27%,182.33%;SD处理下涨幅分别是346.92%,326.58%;而晋亚11号和E051-20的最大涨幅均在20 d时出现,MD处理下分别是191.98%,103.87%;SD处理下分别是309.10%,259.61%。说明干旱胁迫下胡麻可通过合成和积累Pro而抵抗缺水造成的渗透胁迫。

图3 干旱胁迫对可溶性蛋白质含量的影响Fig.3 Effects of drought stress on soluble protein of leaves

图4 干旱胁迫对Pro含量的影响Fig.4 Effects of drought stress on Proline content of leaves
2.4 干旱胁迫对胡麻幼苗保护性酶活性的影响
从图5可以看出,不论是MD处理还是SD处理,POD活性涨幅均呈现先增后减的趋势,但出现的峰值处在不同的时期,在MD处理下,不同的品系最大涨幅均出现在15 d,分别为118.39%,97.93%,80.95%,64.64%;在20 d时涨幅又有所下降,分别为92.00%,60.78%,50.87%,45.95%;但总体呈增长趋势。在SD处理下,晋亚7号、晋亚11号、E051-20最大涨幅均在10 d时出现,分别为157.47%,97.00%,71.33%;晋亚10号峰值出现在15 d时为147.89%,在20 d时晋亚7号的涨幅为153.45%,晋亚10号为99.85%,晋亚11号是29.95%,而E051-20则是呈下降趋势,降幅为9.29%。
2.5 干旱胁迫下胡麻幼苗各生长生理指标间的相关性分析
由表2,3可知,晋亚7号的株高、茎粗分别与RWC、生物量呈极显著正相关,与MDA、质膜透性、可溶性蛋白、Pro、POD均呈极显著负相关;晋亚10号的株高与RWC、生物量呈极显著正相关,与其余指标均呈极显著负相关,而茎粗与RWC呈显著正相关,与生物量呈极显著正相关,与其余指标均呈极显著负相关;晋亚11号的株高与RWC、生物量呈极显著正相关,与质膜透性呈显著负相关,与可溶性蛋白和POD不相关,与MDA、Pro均呈极显著负相关,茎粗与RWC呈显著正相关,与生物量呈极显著正相关,与可溶性蛋白、POD不相关,与MDA、质膜透性、Pro均呈极显著负相关;而E051-20的株高、茎粗均与RWC、生物量呈极显著正相关,与可溶性蛋白呈显著正相关,与POD不相关,与MDA、质膜透性、Pro均呈极显著负相关。各个品系的株高与茎粗均与生物量呈极显著正相关,与MDA、Pro含量呈极显著负相关,而生物量又均与MDA、Pro呈极显著负相关,MDA与Pro则呈极显著正相关。植株受到干旱胁迫时最直接的反应就是株高与茎粗的降低,干旱胁迫下,胡麻幼苗细胞膜受损,MDA、Pro含量增加,植株表现为生长受到抑制,从而导致生物量积累下降。
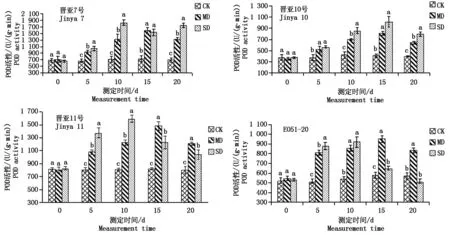
图5 干旱胁迫对POD活性的影响Fig.5 Effects of drought stress on POD activity of leaves

指标IndexPHSDRWCBIOMDAMPSPProPODPH0.937∗∗0.862∗∗0.936∗∗-0.948∗∗-0.849∗∗-0.940∗∗-0.977∗∗-0.962∗∗SD0.884∗∗0.748∗ 0.803∗∗-0.958∗∗-0.897∗∗-0.871∗∗-0.932∗∗-0.940∗∗RWC0.964∗∗0.846∗∗ 0.926∗∗-0.840∗∗-0.615-0.808∗∗-0.791∗-0.765∗BIO0.962∗∗0.927∗∗0.917∗∗-0.883∗∗-0.717∗0.892∗∗-0.882∗∗-0.842∗∗MDA-0.942∗∗-0.849∗∗-0.963∗∗-0.933∗∗0.867∗∗0.857∗∗0.924∗∗0.929∗∗MP-0.884∗∗-0.871∗∗-0.758∗-0.895∗∗0.762∗ 0.755∗0.921∗∗0.939∗∗SP-0.885∗∗-0.798∗∗-0.840∗∗-0.865∗∗0.888∗∗0.731∗0.912∗∗0.902∗∗Pro-0.937∗∗-0.940∗∗-0.860∗∗-0.962∗∗0.890∗∗0.956∗∗0.834∗∗0.992∗∗过氧化物酶POD-0.929∗∗-0.900∗∗-0.834∗∗-0.945∗∗0.872∗∗0.949∗∗0.836∗∗0.990∗∗
注:*、**分别表示P<0.05、P<0.01水平上显著或极显著相关。表中PH、SD、RWC、BIO、MDA、MP、SP、Pro、POD分别表示株高、茎粗、叶片相对含水量、生物量、丙二醛、质膜透性、可溶性蛋白、脯氨酸、过氧化物酶。表3同。表中左下角为晋亚7号的相关系数,右上角为晋亚10号的相关系数。
Notes:*,**represent significance or extreme signifcance atP<0.05,P<0.01, respectively.The table PH,SD, RWC, BIO, MDA,MP,SP,Pro,POD showed the Plant height(PH),Stem diameter(SD),Leaf relative water content(RWC),Biomass,Malondialdehyde(MDA),Membrane permeability(MP),Soluble protein(SP),Proline(Pro), Peroxidase(POD). The same as Tab.3. The correlation coefficient of Jinya 7 is in the lower left corner of the table, the upper right angle is the correlation coefficient of Jinya 10.
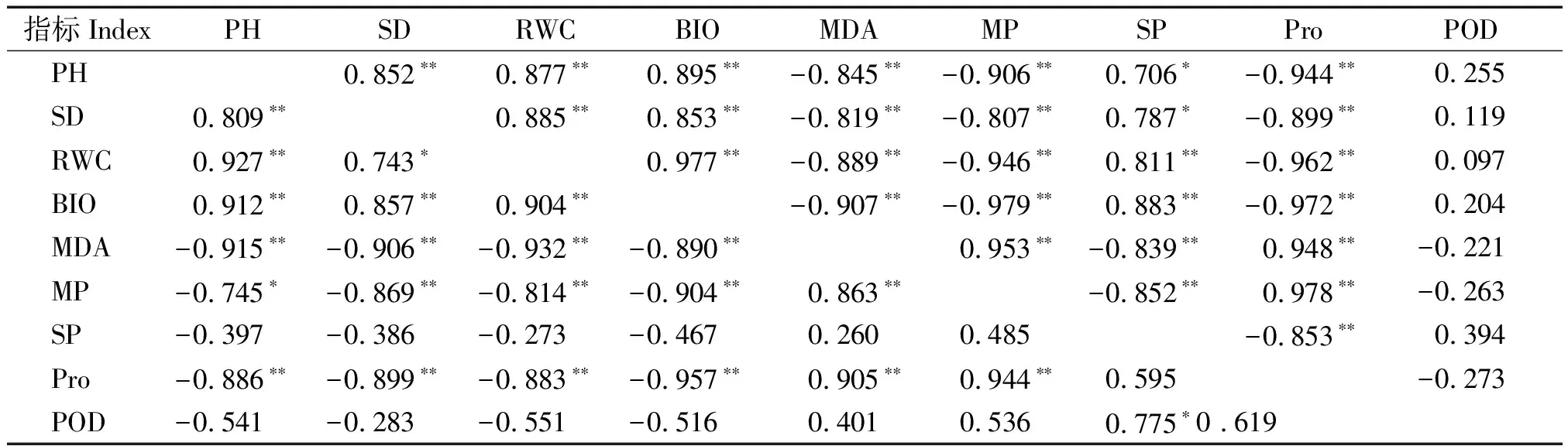
表3 晋亚11号和E051-20各生长生理指标间的相关系数Tab.3 Correlation coefficient between physiological and biochemical indexes of Jinya 11 and E051-20
注:表中左下角为晋亚11号各项指标的相关系数,右上角为E051-20胡麻各项指标的相关系数。
Notes: The correlation coefficient of Jinya 11 is in the lower left corner of the table, the upper right angle is the correlation coefficient of E051-20 flax.
3 结论与讨论
干旱对作物的危害是一个复杂的生理过程,而作物抵抗逆境胁迫也是一个多系统的综合生理反应。干旱胁迫下,植物根系首先受到影响,并快速向上传递胁迫信号,然后植株体内水分状况异常,细胞渗透压改变,失水皱缩,加上活性氧大量产生造成的膜脂过氧化,使原生质体受到损伤,最终表现为对植株生长的抑制。因此,植物在干旱胁迫下最显著的症状就是生长减慢,甚至植株死亡[22-23]。也就是说在干旱胁迫下,植株最直观的表现就是株高降低、茎秆变细。在本试验中,干旱胁迫下4个胡麻品系的株高、茎粗随着胁迫程度的加深和时间的延长,均表现为极显著下降,同时,生物量的积累又随着株高、茎粗的降低而降低。
植物细胞膜对控制物质进出细胞和维持细胞代谢稳定具有重要的生理功能[22]。干旱胁迫下,细胞内自由基的产生和清除遭到破坏,细胞膜透性加大,膜脂过氧化产物MDA大量积累[24-26]。因此,MDA含量可作为反映细胞膜过氧化伤害的指标。本研究表明,晋亚7号、晋亚10号、晋亚11号和E051-20这4个品系虽然都有不同程度的增加,变化趋势基本一致,但是不同品种间的差异较大,抗旱性弱的品种的增加量明显高于抗性强的品种。说明胡麻幼苗的抗旱性越强,膜脂过氧化程度越低,植株清除自由基的能力越高,叶片MDA积累越少。本试验结果还表明,随着干旱胁迫的增加,MDA含量和相对电导率均显著增加,但相关性分析表明,只有MDA与株高、茎粗以及生物量之间均呈极显著负相关,说明随着胁迫的增加,抗旱性弱的胡麻幼苗中MDA含量大量积累,质膜透性加大,细胞膜严重受损,导致了植株生长降低,生物量积累减少。
植物在干旱条件下通常会通过积累小分子有机溶质来增强渗透调节能力,降低渗透势,从而适应不良环境[27-29]。前人大量研究表明,可溶性蛋白和脯氨酸是重要的渗透调节物质[30-31]。李德全等[28,32]研究认为,Pro在植物干旱胁迫下能有效防止水分丧失,减轻渗透胁迫,且对蛋白质的稳定起保护作用,但不能作为植物抗旱性评价的标准。本研究中,随着干旱胁迫的增加,4个品种(系)的Pro含量显著增大,相关性分析也表明,Pro含量与株高、茎粗及生物量存在极显著负相关。说明胡麻幼苗受到干旱胁迫时,Pro通过大量积累来增加细胞液的浓度,从而调节植株渗透能力,保护质膜的稳定,防止细胞失水而受到伤害。且相关性分析表明,Pro与株高、茎粗、生物量及MDA含量呈极显著相关。而可溶性蛋白的变化在不同品种(系)间差异较大,除晋亚10号在处理间有显著差异,在处理后期有显著增加外,其他品系均较为稳定,可能是因为在一定时期内,Pro的大量积累稳定了蛋白质的结构,使蛋白质的合成与分解达到一种相对的平衡,使得可溶性蛋白的含量在胡麻幼苗适应干旱胁迫的过程中基本不起作用。
一般认为,POD是植物酶促反应体系的重要保护酶,能够有效防御膜脂过氧化反应产生的活性氧对细胞造成的伤害,稳定膜透性。胡麻幼苗通过维持较高水平的POD活性来适应干旱胁迫,减轻干旱胁迫对自身的伤害。在本试验中,4个品种(系)的POD活性均表现为先升后降,品种的抗性不同出现最大涨幅的时期也不同,抗旱性强的品种虽然先升后降,但最终的涨幅远远大于抗旱性弱的品种,E051-20在重度胁迫结束时,POD活性低于对照,这时其体内的POD可能已参与活性氧的生成、叶绿素的降解,并引发膜脂过氧化作用,由最初的保护效应已转变为最终的伤害效应。导致此时的MDA含量大量增加,膜脂过氧化反应加剧,植株受到严重伤害。
综上所述,随着胁迫程度的增加以及时间的延长,不同品系的胡麻幼苗受到不同程度的损伤。抗旱性强的品种在生理代谢方面具有较强的协调能力以及较强的保水能力,多表现为保护酶活性迅速提高、有机渗透调节物质含量显著增加,抗旱性差的品种则表现保护酶活性较低、有机渗透调节物质含量较少,膜脂过氧化产物大量积累。由此可见,胡麻幼苗通过多种方式来适应干旱胁迫,增加抵抗逆境的能力。综合生长指标、生理指标及相关性分析,可以把生物量、脯氨酸及丙二醛作为鉴定胡麻幼苗抗旱性的生理指标。
